丘脑深部电刺激对脑外伤昏迷大鼠意识状态及前额叶皮质Orexins受体OX1R表达的影响
钟琳阳,江 健,方龙君,冯 珍
(南昌大学a.研究生院医学部2017级; b.第一附属医院康复医学科,南昌 330006)
全球伤残和死亡的主要原因中脑外伤(TBI)占首位,流行病学显示每10万个人中就有73个人会因意外发生脑外伤,专家预测在2020年脑外伤将成为全球第三大疾病负担[1]。随着现代医学的不断进步,TBI患者的病死率明显下降,但仍有约14%的患者在手术治疗后不能苏醒,长期处于最小意识状态(MCS)和持续植物状态(PVS),这不仅严重影响了疾病的发展和预后,降低了患者的生存质量,还给家庭及社会造成了严重的精神压力和经济负担[2]。因此TBI昏迷患者的有效促醒具有重要的意义。
目前,临床上对TBI昏迷促醒的主要方法包括:药物治疗、高压氧治疗、感觉刺激、干细胞移植和神经电刺激等[3-6]。神经电刺激主要包括迷走神经电刺激、正中神经电刺激、经颅直流电治疗以及深部脑刺激(deep brain stimulation,DBS)。有研究[7]表明,DBS能通过刺激TBI患者脑内相应靶点来提高患者的意识状态水平。YAMAMOTO等[8-9]研究表明,对TBI造成的PVS患者的脑内相应靶点进行刺激后,患者大脑内局部血流量(CBF)明显增加,意识状态发生改变,并出现了觉醒反应。然而,当前DBS对TBI患者昏迷促醒的机制尚不明确,有学者[10]认为,中枢神经递质Orexins及其受体(OX1R)在TBI昏迷促醒中扮演着关键作用。本课题组的前期研究中,通过迷走神经电刺激对TBI昏迷大鼠进行促醒,测得苏醒后的大鼠前额叶皮质区(PFC)Orexins受体OX1R水平升高,提示中枢神经递质Orexins及其受体OX1R在TBI昏迷促醒中扮演着关键作用[11]。本研究旨在探讨DBS对TBI昏迷大鼠的促醒效果及对PFC区OX1R表达的影响。
1 材料与方法
1.1 实验动物、材料及仪器
普通级,体重250~300 g的成年Sprague-Dawley大鼠54只,由南昌大学医学部动科部提供,适应环境饲养1周后开始实验。抗OXlR抗体(ab77370,香港Abcam有限公司)、抗GADPH单克隆抗体(ab181602,香港Abcam有限公司)、组织蛋白抽提试剂盒(CWB10,北京康为世纪生物科技有限公司)、ZS-BS数显脑立体定位仪(北京众实迪创科技发展有限公司)、电刺激仪(ES-420,日本伊藤超短波株式会社)、切片机(RM2015,LEICA)、平头微量进样器(10 μL,宁波镇海三爱仪器厂)、牙科钻(上海美耐特实业有限公司)。
1.2 动物分组及模型建立
将54只SD大鼠按随机数字表法分为3组:空白对照组(n=18,不做任何处理);对照组(n=18)和DBS组(n=18)通过自由落体撞击大鼠脑部建立脑外伤昏迷大鼠模型,造模成功后对照组大鼠丘脑植入电极,但不予DBS,DBS组大鼠丘脑植入电极,并予DBS。
通过吸入乙醚麻醉大鼠,然后使其自然呼吸空气。麻醉后,进行5 mm垂直切口以暴露颅骨。用注射器针头在靠近左中线2 mm处和冠状缝合线前1 mm处标记冲击目标。接下来,从38~42 cm的垂直高度落下一个圆柱形冲击锤(质量400 g,直径2 cm),使大鼠头部产生颅骨的凹陷骨折。造模成功后,缝合头部皮肤,关闭切口,对每只造模成功大鼠进行消毒并置于笼中[12]。共有10只大鼠在造模过程中死亡(死亡率为19%),补充同等数量的大鼠继续造模。
1.3 意识状态评估
造模成功后1 h根据大鼠的感觉、运动功能,按照意识状态水平6级评分法将大鼠分为6级:Ⅰ级,可正常在笼内活动;Ⅱ级,在笼内活动的频率减少;Ⅲ级,在笼内活动的评率明显减少并并伴有运动失调;Ⅳ级,将大鼠翻转放在桌面上,大鼠能左右滚动(翻转反射存在),但不能站立;Ⅴ级,将大鼠翻转放在桌面上,大鼠不能左右滚动(翻正反射消失)但用力捏大鼠四肢,肢体有回缩反应(对疼痛刺激有反应);Ⅵ级,对任何刺激无反应。根据意识状态6级评分法中规定意识状态Ⅴ级和Ⅵ级的大鼠为昏迷状态[13]。
1.4 深部脑电刺激
建立昏迷大鼠模型后1 h,将对照组和DBS组大鼠剥离骨膜,利用三维立体定向仪将同轴双极铂铱合金电极置入双侧丘脑(距前囟点后:-1.70 mm,外:±1.00 mm,深-3.00 mm),通过CT定位明确电极已植入丘脑部位,给予连续的丘脑电刺激(Deep brain stimulation,DBS)。刺激参数:频率200 Hz:脉宽0.1 ms;电压2~4 V;刺激方式:依次刺激左侧和右侧丘脑,左右交替刺激,每次5 min,持续1 h[14]。
1.5 组织提取及检测方法
在DBS结束后,再次评定大鼠意识状态。在DBS刺激完成后的12 h,将3组大鼠每组分别处死6只大鼠用来组织提取和检测,剩余大鼠依据动物伦理学,断头处理。用10%水合氯醛(0.1 g·mL-1)给每组用来检测的大鼠腹腔注射,使大鼠深度麻醉,深度麻醉后,向大鼠心脏灌注4%多聚甲醛至大鼠全身僵硬死亡。用组织蛋白抽提试剂盒提取大鼠PFC区组织蛋白,冷冻离心处理后,取上清液,用BCA法测定蛋白浓度。运用Western-blot(WB)、免疫荧光技术分别测定3组大鼠PFC区OX1R的表达情况。
1.5.1 WB
在冰盒上分离并收集大鼠PFC区组织,将脑组织置于低温高速离心机中离心10 min,得到蛋白质膜,依次进行配胶、蛋白上样、电泳、转膜,转膜结束后,将PVDF膜取出,置于含5%脱脂奶粉的TBST内,室温下60 r·min-1摇床上孵育1 h。孵育结束后用TBST在80 r·min-1的摇床上漂洗3次×5 min。根据目的蛋白分子量的大小,裁剪条带,置于一抗内。4 ℃冰箱孵育过夜。将条带取出后用TBST在80 r·min-1的摇床上漂洗3次×5 min。山羊抗兔IgG使用含5%脱脂奶粉的TBST稀释(稀释比例1:2000),室温下60 r·min-1摇床上孵育1 h。取出条带,用TBST在80 r·min-1的摇床上漂洗3次×5 min。用覆盖上曝光液进行曝光,曝光结束后存储照片。使用Image Lab对曝光后条带的灰度值进行分析,导出数据,计算目的蛋白与β-actin的比值。
1.5.2 免疫荧光技术
用4%水合氯醛深度麻醉大鼠后,向大鼠心脏灌注4%多聚甲醛至大鼠全身僵硬死亡并断头取脑,取前额叶皮质区组织蛋白。将取出的蛋白组织冠状切片,片厚4 μm,用PBS漂洗,漂洗后用0.3%的H2O2处理30 min,滴加稀释好的一抗并放入湿盒,孵育过夜,过夜温度4 ℃,随后滴加稀释好的荧光二抗,放入湿盒中孵育1 h,湿盒内温度控制在20~37 ℃,PBS漂洗后再滴加DAPI避光孵育5 min,对标本进行染核,PBS 5 min×4次洗去多余的DAPI,在荧光显微镜下观察采集图像,从中选取最有意义的组织相进行分析处理。
1.6 统计学方法
所得数据使用SPSS 21.0软件进行统计处理。计数资料采用Mann-Whitney秩和检验;计量资料先行方差齐性检验,若方差齐,则采用方差分析;若方差不齐,则采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 意识状态水平
DBS前,2组意识状态水平比较差异无统计学意义(P=0.323)。DBS刺激1 h后,DBS组16只出现翻正反射(16/18),对照组昏迷大鼠中7只出现翻正反射(7/18),DBS组行为学状态好于对照组(U=96.00,P=0.026)。见表1。

表1 DBS前大鼠意识状态评估 只
2.2 大鼠前额叶皮质区OX1R表达
WB结果显示:各组大鼠前额叶皮质区OX1R的表达,DBS组高于对照组(P<0.05),对照组低于空白对照组(P<0.05)。见图1、表2。
免疫荧光技术显示:各组大鼠前额叶皮质区OX1R的表达,DBS组明显高于对照组(P<0.05),对照组明显低于空白对照组(P<0.05)。见图2、表2。
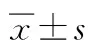
表2 WB和免疫荧光技术检测各组大鼠前额叶皮质区OX1R相对表达量
3 讨论
DBS最初仅运用于癫痫、帕金森病、特发性震颤等疾病的治疗,近年在神经学领域[7,15]应用广泛。2017年,由多个国家参与的临床研究[16-18]发现,DBS可明显改善由于重型颅脑损伤所导致昏迷的患者的意识状态水平。大量研究[8-9,19]显示,DBS可通过刺激前额叶皮质区释放更多的神经递质,最终提高昏迷患者各方面的行为学功能和意识状态水平。目前国内外DBS促醒治疗的靶点主要集中在丘脑和中脑两个部位[5]。本研究旨在探讨DBS促醒的有效性。
本实验中,DBS 1 h后,再次行意识状态评估,空白对照组18只大鼠苏醒(Ⅰ级18只);DBS组中16只大鼠苏醒(Ⅲ级10只,Ⅳ级6只),2只大鼠昏迷(Ⅴ级2只);对照组中7只大鼠苏醒(Ⅲ级7只),11只昏迷(Ⅴ级5只,Ⅵ级6只),DBS组意识状态水平好于对照组(U=96.00,P=0.026)。提示,DBS能够改善脑外伤昏迷大鼠的意识状态水平,加速脑外伤昏迷大鼠的觉醒反应。
当前DBS促醒的机制尚不明确,其可能机制主要包括:增加脑血流量及代谢水平;兴奋大脑皮质及脑干网状结构;增强脑电活动;影响神经递质的分泌[20]。DBS可使受损的神经细胞内外电位回复致正常水平,促进神经细胞修复和神经通路的正常运行,使TBI昏迷患者脑脊液中神经递质恢复到正常水平,进而提高其意识状态水平,达到促醒的效果。
中枢神经递质主要包括两类,即兴奋性递质和抑制性递质。抑制性递质主要包括γ-氨基丁酸(GABA)、5-羟色胺(5-HT),β-内啡肽(β-EP)等,能够促进睡眠;兴奋性递质主要包括乙酰胆碱(Ach)、谷氨酸(Glu)、和食欲素(Orexins)等,能够促进觉醒反应[21-23]。其中Orexins是由外侧下丘脑外侧区分泌合成的一种神经多肽,在维持觉醒中扮演着重要的作用[14]。Orexins主要包括Orexins-A和Orexins-B,Orexins-A的受体主要是Orexins 1受体(OX1R),Orexins-B的受体主要是Orexins 2受体(OX2R),他们都在大脑皮层中有广泛的投射。有研究[24]发现,给麻醉大鼠模型侧脑室注射Orexins-A可加速大鼠的苏醒,缩短其昏迷时间;反之,给予OX1R拮抗剂可使麻醉大鼠的昏迷时间延长。本课题组前期研究[21]也发现,MNS和VNS能够提高前额叶皮质区Orexins及其受体的表达,进而促进脑外伤昏迷大鼠的意识状态水平恢复。唐丽娜等[25]发现,Orexins神经元发出兴奋性投射至除小脑之外的整个中枢神经系统。盛晴等[26]指出,丘脑底核接受来自下丘脑Orexins能纤维支配,并表达Orexins受体,故丘脑也可能通过调节Orexins的表达来促醒。
本实验中WB、免疫荧光技术结果显示:空白对照组大鼠前额叶皮质区OX1R的表达水平明显高于对照组大鼠(P<0.05),对照组低于空白对照组(P<0.05),提示DBS促醒的可能机制是,DBS通过上调前额叶皮质区Orexins受体OX1R的表达水平,进而提高TBI后昏迷大鼠的意识状态水平。
本研究的局限性和不足:1)在大鼠的行为学评估上仅用了意识状态六级评分法作为评估标准,脑电图、诱发电位将进一步应用以完善评估体系;2)未来将通过利用OX1R受体拮抗剂进一步验证其关键性作用;3)DBS促醒机制是否与其他神经递质的表达有关,未来仍需进一步的深入研究。
综上所述,本研究进一步验证了DBS促醒的有效性,即DBS促醒的可能作用机制是,DBS通过上调前额叶皮质区Orexins受体OX1R的表达水平,进而提高TBI后昏迷大鼠的意识状态水平。

