外周血T 淋巴细胞亚群与初诊老年多发性骨髓瘤患者预后的关系研究
杨国溜 黄建新
癌症的治疗旨在杀除所有恶性细胞。除了通过常规疗法使肿瘤细胞的体积最小化以外,活化的T 细胞的细胞毒性能力对于根除肿瘤和治愈癌症至关重要。T细胞衰竭或衰老的特征是多种抑制分子水平升高,效应细胞因子产生受损,增殖能力丧失,细胞毒性受损以及包括T-bet 在内的关键转录因子用途改变[1-3]。慢性抗原暴露后会发生T 细胞衰竭,从而无法控制肿瘤扩散。在衰竭阶段过度表达的分子和途径的调控可逆转这种功能障碍状态并增强免疫反应[4,5]。衰老的T细胞是缺乏CD28 并获得CD57 和调节受体表达的晚期分化的记忆。表达CD45RA 而不是CD45RO,都处于细胞周期停滞期,并增强了炎症细胞因子的分泌[6]。研究最多的可作为淋巴细胞活化负调节剂的抑制分子是CD279(PD-1)和CTLA-4(CD152)。天然杀伤细胞受体2B4(CD244),糖蛋白CD160,TIM3,Lag3 和许多其他物质也已显示出对T 细胞活性调节的重要作用[7]。阻断免疫检查点分子在实体癌症的治疗中取得了可喜的成果。然而,针对这些分子在血液系统恶性肿瘤中的研究相对较少[8-10]。最近,关于骨髓瘤患者的程序性死亡受体1(PD-1)表达等免疫检查点的数据已经发表。此外,在体外研究了PD-1 阻断抗体重新激活患病T 细胞的潜力,并证明了该分子是免疫疗法的有前途的候选药物[11]。然而,在体内,这些PD-1 抑制剂似乎仅在骨髓瘤患者中与免疫调节药物联用。多发性骨髓瘤是血液癌症,其特征是恶性浆细胞在骨髓内积累。尽管通过引入新的免疫调节剂和蛋白酶体抑制剂在治疗上取得了进展,但该癌症仍在很大程度上无法治愈。通过观察同种异体干细胞移植或输注供体淋巴细胞后疾病缓解的情况,强调了多发性骨髓瘤的免疫原性。更深入地描述骨髓瘤免疫系统的肿瘤驱动缺陷将有助于新型免疫治疗策略的发展。
1 资料与方法
在本院骨外科的髋关节置换术中,从年龄匹配的健康供体中采集同一个体股骨近端的外周血样本和骨髓抽吸物(12 例),T 细胞亚群的分布相当。对健康受试者进行了病毒感染和骨髓异常筛查,未接受免疫调节药物或未患有已知会影响免疫系统的疾病,包括自身免疫性疾病或癌症。外周血单核细胞(PBMC)和骨髓单核细胞(BMMC)通过密度梯度离心犯法进行分离,并采取流式细胞术分析,冷冻保存以用于以后的功能分析。冻T 细胞的回收率高于85%。使用荧光标记的CD3 抗体(UCHT1),CD4 抗体(RPA-T4),CD8(RPA-T8),CD28 抗体(CD28.2)通过多色染色在无红细胞样品(血液样品和骨髓穿刺液)中进行表面抗原染色,CD45(2D1),CD45RA(HI100),CD57(NK-1),CD62L(DREG-56),CD152/CTLA-4(BNI3),CD160(BY55),CD244/2B4(2-69),CD279/PD1(MI-H4)。为了对细胞内蛋白质染色,分别用抗CD3(2 μg/ ml)和抗CD28(5 μg/ml)刺激PBMC 和BMMC 6 或24 h。在培养的最后4 h 内,将10 mg/ml 的布雷菲德菌素A 添加到细胞培养物中。使用CytoFix/CytoPerm 试剂盒进行细胞内染色。所有抗细胞因子的抗体(IL-2,IFNγ,B27),T-bet(O4-46)和CD107a(H4A3)。流式细胞仪在BD FACS CantoⅡ流式细胞仪上进行,随后使用FACS DIVA Software 7.0 进行分析。对7-AAD 染色的单个活细胞进行门控后进行分析。
2 结果
通过多色流式细胞术评估了骨髓瘤患者和健康供体的骨髓和外周血T 细胞上抑制分子的表达,基本资料见表1。
分析另外两个抑制性分子的表达,这些分子被认为在T 细胞调节中起作用,即CD160 和2B4。CD160与BTLA 竞争与疱疹病毒进入介体(HVEM)的结合,并且已被证明对TCR 介导的信号传导具有负调节作用。2B4 在T 细胞上的交联会降低增殖,并且2B4 的表达在衰竭的T 细胞上会上调。分析显示,CD160 和2B4在骨髓瘤患者的骨髓T 细胞上均显着上调,表明局部免疫抑制的程度甚至可能比以前的研究估计的还要高。见表2。
T 细胞上PD-1 的表达被认为是骨髓瘤疾病的新型治疗靶点。通常在效应记忆T 细胞上均有高水平的PD-1 表达。同时分析了不同T 细胞亚群上的PD-1 水平。在健康者和患者的外周血和骨髓腔室之间,CD4+子集的百分比没有明显变化,而CD8+子集的分布却发生了显着变化。在骨髓瘤骨髓中的CD8+T 细胞库中发现了效应T 细胞(CD45RA+CD62L-)的大量积累,并且效应记忆T 细胞(CD45RA-CD62L-)的减少甚至更加明显。见表3。由于衰老导致T 细胞增加的趋势,且发现在骨髓瘤患者中它会进一步增强。此外,所有T 细胞亚群中PD-1 的表达均显着增加。

表1 所有研究对象基本资料[n,M(P0,P100)]
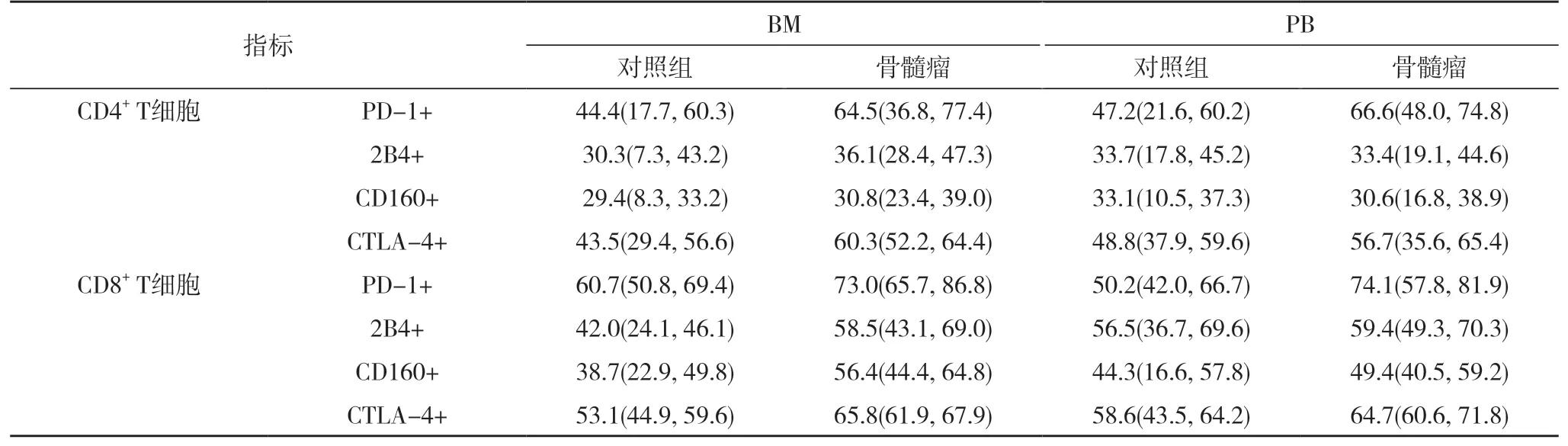
表2 各分子的T 细胞百分比[M(P0,P100),%]
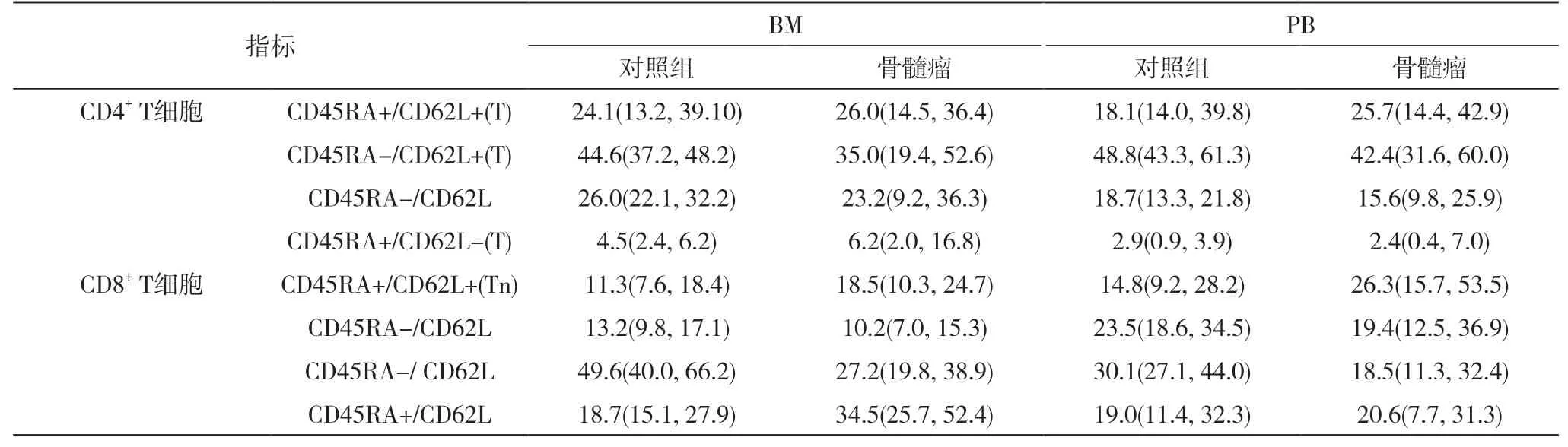
表3 骨髓瘤患者和健康者的骨髓抽吸物和PB 中的T 细胞亚群分布[M(P25,P75),%]
3 讨论
CD3+CD4+和CD3+CD8+T 细胞在骨髓瘤患者的PB 和BM 中均表现出PD-1 的增强表达,这与最近发布的数据一致[12]。此外还证实CTLA-4 的表达增强,并且发现仅局限于骨髓瘤患者的骨髓T 细胞,通常存在的抑制受体的数量越高,T 细胞的消耗越严重。
在本文中,研究了多发性骨髓瘤中T 细胞缺陷的性质,并将我们的发现与年龄匹配的健康供体样品进行了比较。迄今为止尚未对骨髓瘤患者和健康者的BM和PB 样本进行过如此彻底的研究。对检查点抑制剂分子PD-1,CTLA-4,CD160 和2B4 表达的系统和局部变化的研究表明,所有测试的标志物均显着上调,尤其是在骨髓中。免疫检查点分子的表达和连接可下调T细胞反应,从而维持自身耐受性。使用单克隆抗体(即抗PD-1)破坏受体与配体的相互作用已经在几种实体瘤的治疗中显示出了显着的效果,并且在包括骨髓瘤在内的血液系统癌症领域也正在迅速发展。一个主要的障碍是对肿瘤的微抑制作用,它限制了免疫细胞抵抗癌症的作用。再加上骨髓瘤细胞表达PD-L1 的发现,甚至可以通过基质细胞接触来进一步上调PD-L1,PD-1 途径已被证明可在部分患者中促进这种疾病的侵袭性[13]。尽管体外结果强烈支持PD-1 抑制是有效的治疗方法,但与其他B 细胞恶性肿瘤相比,这些药物迄今为止仍无法在体内诱导骨髓瘤的主要反应[14]。在这里,肿瘤微环境成为重要的额外靶标,正在进行的将PD-1 抑制剂与免疫调节剂结合的研究似乎更加成功。来那度胺已被证明可在骨髓瘤微环境中诱导免疫激活变化,并下调PD-L1 表达[15]。然而,由于PD-L1表达本身在骨髓瘤中变化很大,其他检查点抑制剂可能成为同样重要的靶标。在5T33 鼠骨髓瘤模型中的研究已经显示来那度胺与其他免疫检查点(如CTLA-4,LAG-3,TIM-3 及其组合)的阻滞作用相结合。本研究表明,即使在含免疫调节剂(IMiD)的疗法后,CTLA-4、2B4 和CD160 的表达仍然很高,因此可能构成其他新的靶标。CTLA-4 与免疫刺激受体CD28 竞争CD80/CD86蛋白的结合。因此,CTLA-4 途径的肿瘤参与可能会抑制微环境中的免疫反应,从而导致不适当的T 细胞共刺激。
综上所述,与周围T 细胞相比,骨髓瘤患者骨髓中的外周血T 淋巴细胞受损更为严重,预后也较差。

