一例新型冠状病毒肺炎患者抗凝药物治疗策略
邵 丹,毕铁琳
0 引言
新型冠状病毒肺炎(Corona virus disease 2019,COVID-19)是一种由2019新型冠状病毒(2019-nCoV)导致的肺部疾病,可累及包括肝脏、肾脏、胃肠等在内的多个脏器,据目前临床资料显示,在一线的临床实践中,COVID-19患者中有近20%出现凝血功能异常,重型和危重型患者几乎均存在凝血功能紊乱[1-2]。笔者结合1例新型冠状病毒感染合并糖尿病病例的凝血功能情况及抗凝药物治疗策略,进行分析讨论,旨在为临床医生和药师提供理论支持。
1 病例资料
患者,男,65岁,因咳嗽、咳痰伴发热4d于2020年2月8日入院。入院4 d前出现咳嗽、咳痰伴发热,体温37.7 ℃,自行口服复方烷胺片(具体剂量不详)对症治疗,症状未见好转,于当地医院隔离观察,当地疾控中心2019新型冠状病毒咽拭子核酸检测阳性,经省疾控中心复核亦为阳性,由当地医院予以抗病毒、抗炎等治疗后效果不佳,为求进一步治疗转入我院。既往2型糖尿病;发病前5~10 d与2019新型冠状病毒肺炎确诊患者有接触史。入院查体:T 36.7 ℃,P 60次/min,R 18次/min,BP 155/90 mm Hg,一般状态尚可,呼吸困难,皮肤、黏膜无黄染及发绀,神志清楚,神经系统查体未见阳性体征。动脉血气分析提示pH 7.45,PCO234 mmHg,PO259 mmHg,HCO3-23.6 mmol/L,BE 0.4 mmol/L,Lac 2.8 mmol/L。自带2019新型冠状病毒核酸检测报告(2020-02-06)ORF lab基因阳性,M基因阳性。自带胸部CT(2020-02-07)检查提示双肺各叶可见大片状磨玻璃影,胸膜下为主,伴部分间质性改变,其内可见含气支气管影。入院诊断:新型冠状病毒(危重型),Ⅰ型呼吸衰竭,2型糖尿病。
入院后,给予无创呼吸机正压辅助通气,药物治疗方面,给予阿比多尔分散片、洛匹那韦/利托那韦片、重组人干扰素α2b注射液、中药方剂抗病毒治疗,给予莫西沙星片抗感染治疗,给予糖皮质激素注射用甲泼尼龙琥珀酸钠抗炎治疗,给予低分子肝素钠注射液抗凝;给予注射用奥美拉唑钠预防应激性溃疡;给予复方甘草酸苷注射液、注射用还原型谷胱甘肽改善肝功能;给予乙酰半胱氨酸片止咳化痰;给予谷赖胰岛素注射液及甘精胰岛素注射液控制血糖。患者住院期间主要治疗药物见表1。
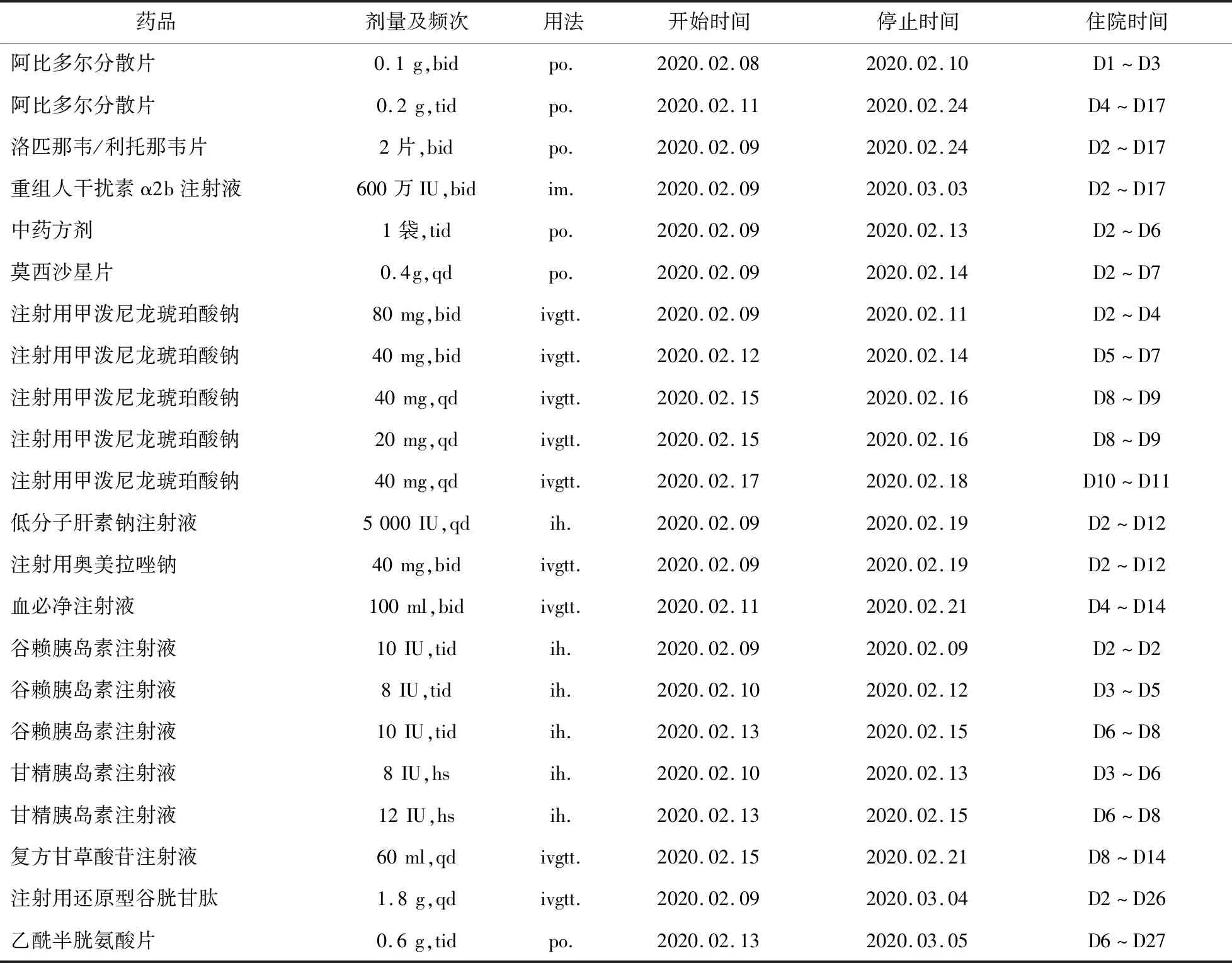
表1 住院期间主要治疗药物
2 讨论
2.1 凝血功能的变化 本例患者(2月9日)D-二聚体明显升高(4 230 ng/ml),凝血酶原时间(PT)高于正常值范围(14.2 s),且有新型冠状病毒肺炎合并2型糖尿病的基础疾病。根据国际血栓与止血委员会(International society of thrombosis and haemostasis,ISTH)显性弥漫性血管内凝血(DIC)标准[3],该患者评分为3分,为疑似DIC。通过已有文献报道,认为2019-nCoV感染重症患者存在凝血功能障碍的实验室和临床表现,且 D-二聚体升高与患者不良预后密切相关。约71%的死亡案例在病程中满足DIC诊断标准,而生存患者中仅0.6%满足DIC诊断标准。关注重症患者凝血指标,或可通过早期干预来降低病死率,但目前发生机制尚不明确,较为明确的是,2019-nCoV 通过复杂的病理生理过程引起血液高凝状态,并且在凝血全过程中 2019-nCoV 均有促凝作用[4]。研究其发生机制,发现2019-nCoV与急性呼吸综合征冠状病毒(SARS-CoV)、中东呼吸综合征冠状病毒(MERS-CoV)同为冠状病毒,且其基因组序列与 SARS-CoV 相似度极高[5]。研究表明,SARS-CoV和MERS-CoV患者会出现IL-1β、IL-6、IL-8[6]和TNF-α[7]等多种炎症因子水平升高。2019-nCoV感染可能出现多种炎症因子水平的明显升高,甚至暴发炎症因子风暴,而炎症因子通过促进凝血系统中组织因子的合成,激活凝血系统,打破机体的纤溶-凝血平衡,出现凝血功能亢进,使机体处于高凝状态,进而可能引发一系列血栓事件。为预防此种情况的发生,抑制炎症因子风暴和预防性抗凝同样重要。根据指南[8],可使用糖皮质激素抑制炎症因子风暴,但需要注意的是,糖皮质激素会抑制免疫功能,使机体预后不佳,而且使用糖皮质激素本身可能诱发高凝状态。因此,本病例中,糖皮质激素(甲泼尼龙)的使用根据炎症指标及临床症状的改变逐渐调整,待炎症指标稳定后,给予逐步停药的处理是合理的。
2.2 抗凝药物与抗病毒药物的相互作用 常用的抗凝药物包括肝素类、维生素K拮抗剂及直接口服抗凝药类,对于本案例中患者来说,根据其预防性抗凝需求,可以使用低分子肝素或维生素K拮抗剂及直接口服抗凝药,而维生素K拮抗剂和直接口服抗凝药多经肝药酶代谢,如华法林经CYP2C19、CYP3A4等多基因位点代谢,利伐沙班经CYP3A4代谢。而2019-nCOV患者的用药方案中,抗病毒药物不可或缺,包括洛匹那韦/利托那韦、达芦那韦/考比司他、阿比多尔、瑞德西韦等药物,其中洛匹那韦/利托那韦、达芦那韦/考比司他均为肝药酶 CYP3A 的抑制剂,阿比多尔、瑞德西韦尚无与抗凝药物之间存在相互作用的报道[9]。研究显示,利伐沙班、阿哌沙班与洛匹那韦/利托那韦、达芦那韦/考比司他存在较强的相互作用,合用时会导致利伐沙班、阿哌沙班的暴露增加,进而出血风险增加,如利伐沙班暴露量最多可能增加至153%;华法林与达芦那韦/考比司他存在弱相互作用,合用会增加出血风险,而与洛匹那韦/利托那韦合用时,华法林的暴露减少,可能会发生抗凝不足的情况[10-11]。但达比加群酯不通过细胞色素P450系统代谢,对人细胞色素P450酶无体外作用,故预期不会与经P450酶代谢的药物间发生相互作用,但达比加群酯是外流转运体P-pg的底物,而洛匹那韦/利托那韦、达芦那韦/考比司他均属于蛋白酶抑制剂,会影响P-pg水平,同样可能会使达比加群的暴露增加,增加出血风险。因此,与蛋白酶抑制剂洛匹那韦/利托那韦、达芦那韦/考比司他不存在相互作用的抗凝药物为低分子肝素,而抗病毒药物阿比多尔、瑞德西韦亦可以尝试选用。本案例中,从药物相互作用方面分析,给予抗病毒药物阿比多尔分散片(0.1 g,bid,po)、洛匹那韦/利托那韦片(2片,bid,po),同时选用低分子肝素钠注射液用于预防性抗凝是适宜的。
2.3 抗凝用药方案分析评价 本案例中,患者入院后肝功能检查发现,丙氨酸氨基转移酶(ALT) 129.0 IU/L,天冬氨酸氨基转移酶(AST) 105.0 IU/L,γ-谷氨酰转肽酶(GGT) 428 IU/L,谷氨酸脱氢酶23.4 U/L,均高于正常值2~8倍,总胆红素(TBIL) 32.5 μmol/L,白蛋白(ALB) 37.1 g/L,提示肝功能异常,凝血酶原时间(PT)14.2 s,未发现腹水、肝性脑病等症状,Child-Pugh评分为3分,为Child-Pugh A类,轻度肝功能不全。达比加群酯胶囊的说明书显示,肝酶增高>2 ULN(正常值上限)的患者不推荐使用,并且该患者使用了质子泵抑制剂奥美拉唑,而相关指南显示,达比加群酯与质子泵抑制剂之间存在相互作用,二者联合使用会使达比加群酯的暴露量减少12%~30%[11],故不宜选择达比加群酯用于抗凝。而低分子肝素、利伐沙班对于轻度肝功能不全患者无需调整剂量,且均不存在与质子泵抑制剂的相互作用。故结合患者肝功能、联合用药等情况,给予低分子肝素的抗凝用药方案是合理的。
2019-nCoV感染者是一类新型的患者群体,可能会出现凝血系统病症,发生严重的血栓事件。既往缺少大量的文献资料对该类患者群体的凝血功能变化给予临床治疗指导,这就需要研究者根据已经收治的病例中所体现的临床症状、累及的脏器损伤以及实验室指标变化等方面,积累经验,比如在入院初期关注凝血常规、评估DIC可能,及时给予对症治疗;用药方面,需要考虑2019-nCoV感染者可能诱发的肝功能异常、治疗药物间可能的相互作用等情况,给予恰当的抗凝用药方案,对于临床结局有所助益。

