奥氮平单药或联合用药治疗后甲状腺激素水平的变化
张嘉萱,杨双双,邓顺顺,邱玛丽
0 引言
奥氮平是一种非典型(第2代)抗精神病药物,主要作用于多巴胺和血清素受体;通过阻断中脑边缘通路的多巴胺D2受体,可以治疗精神分裂症患者的阳性症状,包括幻觉、妄想、思想和行为紊乱等。早有研究证实,阻断多巴胺受体会引起血清促甲状腺激素释放激素(Thyroid-stimulating hormone,TSH)的释放增加[1]。而TSH又会影响三碘甲状腺原氨酸(Triiodothyronine,T3)和四碘甲状腺原氨酸(Thyroxine,T4)的合成和分泌[2]。因此,奥氮平可能会影响血清甲状腺激素水平。目前,国内外已有的研究仅限于奥氮平单药治疗[3-6]。但在临床中,有时会出现单一用药治疗效果不佳的情况。这时需要采用联合用药,即更换成另一种非典型抗精神病药物或者与另一种非典型抗精神病药物同时应用。本研究旨在探讨奥氮平单药或联合用药治疗后甲状腺激素水平的变化,并比较两种治疗方案之间的差异。
1 对象与方法
1.1 研究方法 回顾2011年11月至2019年12月在我院住院的精神疾病患者病历。对比治疗前后,患者体内血清甲状腺激素水平的差异。本研究获得我院伦理委员会的批准。由于本研究是回顾性的、非干扰性的,因此豁免签署知情同意书。
1.2 入排标准
1.2.1 入组标准 ①18~65岁;②入院前6个月没有用过长效抗精神病药物,并且前3个月没有用过任何非长效抗精神病药物,或者已知的会影响甲状腺功能的药物,如含碘的药物、抗甲状腺药物、左甲状腺素、锂盐;③入院后24 h内接受奥氮平单药或者联合用药治疗,并持续接受治疗,且每种抗精神病药物的疗程均超过14 d。
1.2.2 排除标准 ①血清TSH的基线水平不在正常参考范围(0.49~4.91 mIU/L)内;②肝肾功能受损;③随访期间服用了除非典型抗精神病药物以外的其他抗精神病药物,或者已知的会影响甲状腺功能的药物;④孕期或者哺乳期妇女。疗程不超过7 d的药物不被纳入统计范围。
1.3 研究对象分组 单药组:仅服用奥氮平1种抗精神病药物的患者。多药联合组:同时或前后服用奥氮平及其他非典型抗精神病药物的患者。
1.4 血清甲状腺激素水平检测 清晨抽取空腹静脉血,离心后取上清,使用美国Beckman公司的ACCESS 2化学发光仪检测血清甲状腺激素水平。
1.5 平均日剂量的计算 所服用的奥氮平总剂量除以总的服用天数得到奥氮平的平均日剂量。合并用药根据世界卫生组织推荐的限定日剂量(Defined daily dose,DDD)[7],将其他非典型抗精神病药物的平均日剂量转换成奥氮平等量。
1.6 统计分析 分别用例(%)和M (Q1,Q3)表示定性资料及定量资料。组间定量资料的差异用Mann-Whitney U检验比较;组间定性资料的差异用卡方检验或者Fisher’s精确检验比较。各组内服药前后甲状腺激素水平的差异用Wilcoxon符号秩检验比较。甲状腺激素水平的变化值与药物剂量和疗程之间的相关性用Spearman秩相关分析。设定显著性水平为α=0.05。所有统计分析均通过IBM SPSS 20.0软件实现。
2 结果
2.1 研究对象的人口学特征和临床资料 共纳入44例研究对象。其中,24例接受奥氮平单药治疗,被归为单药组;20例接受奥氮平与其他非典型抗精神病药物先后或者同时治疗,被归为联合用药组。联合用药组中,合并用药情况:利培酮9例(45.0%),氨磺必利4例(20.0%),氯氮平4例(20.0%),喹硫平3例(15.0%),阿立哌唑2例(10.0%),帕利哌酮1例(5.0%),齐拉西酮1例(5.0%)。两组一般资料比较差异无统计学意义(P>0.05),见表1。
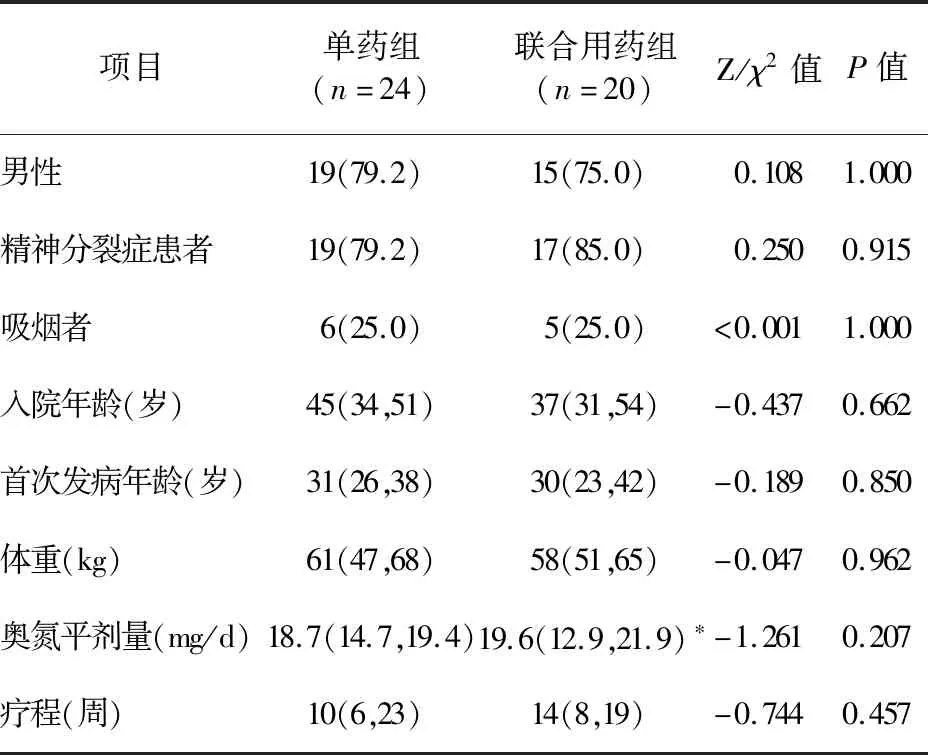
表1 研究对象的人口学特征和临床资料[例(%)]
2.2 甲状腺激素水平的变化 治疗前、后两组血清甲状腺激素水平比较见表2。
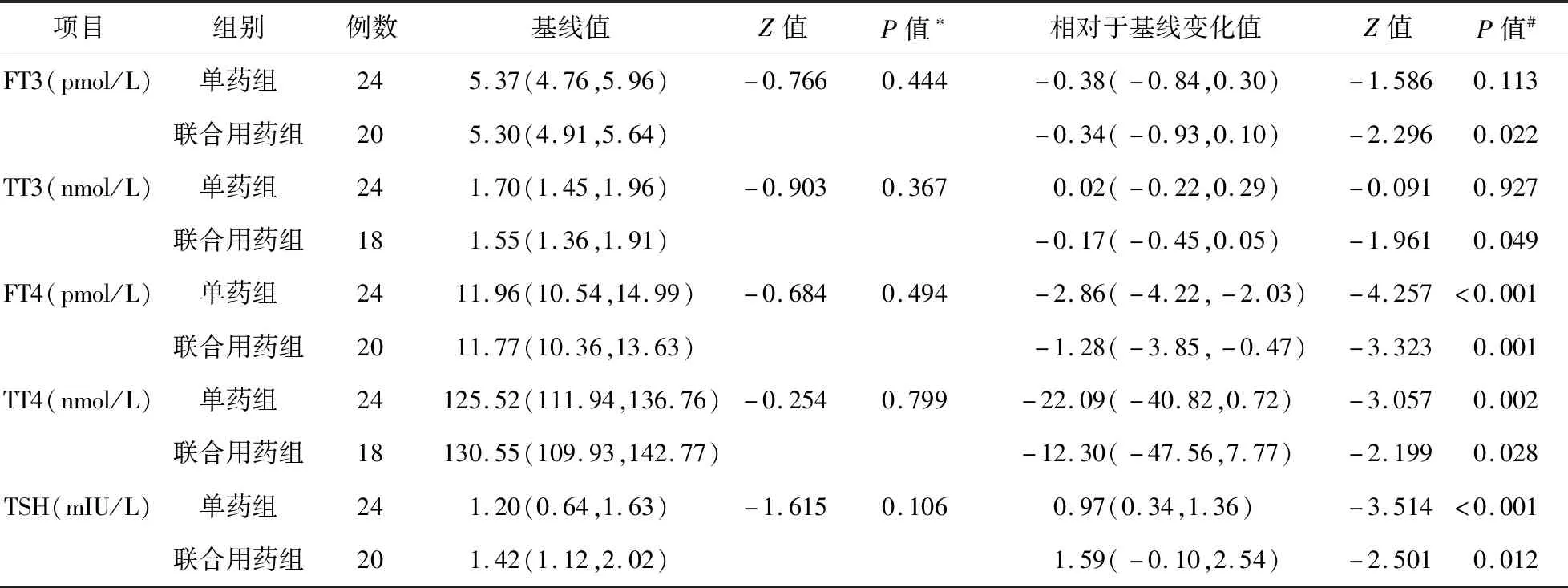
表2 奥氮平单药或联合用药治疗后精神疾病患者甲状腺激素水平的变化
2.3 药物疗程或平均日剂量与血清甲状腺激素变化值之间的相关性 Spearman秩相关结果提示:两组中均未发现药物疗程或平均日剂量与甲状腺激素水平变化值之间存在相关性(P>0.05)。
2.4 治疗后甲状腺功能异常发生率的比较 两组甲状腺功能异常率的比较见表3。治疗后,单药组中出现1例(4.2%)亚临床甲状腺功能减退。多药联合组中的4例(20.0%)亚临床甲状腺功能减退患者中,2例合用氨磺必利,另2例分别合用利培酮和喹硫平;2例(10.0%)亚临床甲状腺功能亢进患者分别合用氨磺必利和利培酮。
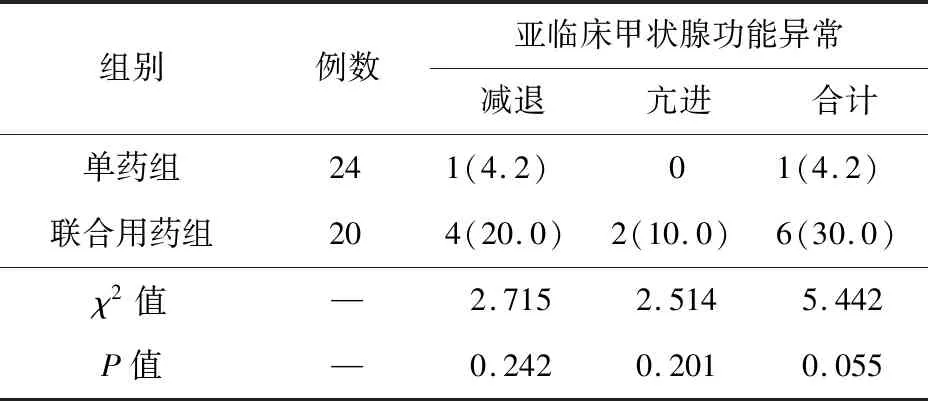
表3 奥氮平单药或联合用药治疗后甲状腺功能异常率的比较
3 讨论
以往关于奥氮平治疗后甲状腺激素水平变化的研究仅针对奥氮平单一用药的情况,并且所报道的研究结果不一致。国内王敬巍等[3]发现,奥氮平单药治疗后,FT4、TT4、TT3血清水平降低,TSH血清水平升高,而FT3血清水平与治疗前相比差异无统计学意义。不同的是,张淑芬等[4]报道,奥氮平单药治疗后,TSH的血清水平与治疗前相比差异无统计学意义。国外只有2篇文献报道了针对儿童和青少年患者开展的类似研究。其中一项是Baeza等[5]报道,奥氮平单药治疗后的第3个月,患者的TSH血清水平升高,FT4血清水平降低;第6个月仅观察到TSH水平升高。另一项是Fraguas等[6]发现,奥氮平单药治疗6个月后,FT4和TSH的血清水平与治疗前相比差异均无统计学意义(P>0.05)。
本研究结果显示,奥氮平单药或者多药联合治疗后,FT4、TT4血清水平降低,TSH血清水平升高。与单药治疗不同的是,联合用药后,FT3和TT3血清水平亦降低(P<0.05)。两组血清TSH水平升高这一结果与本研究的理论基础一致:奥氮平及其他非典型抗精神药物可拮抗多巴胺受体,导致TSH释放增加。但是TSH水平升高并不伴随着T3、T4水平升高。相反,T3、T4水平降低,因此更可能是由于T3、T4水平降低后,通过负反馈调节增加了TSH的分泌。
本研究显示,奥氮平单药治疗后,亚临床甲状腺功能减退的发生率为4.2%;多药联合治疗后,亚临床甲状腺功能减退的发生率高达20.0%,这与用药后血清甲状腺激素水平的变化趋势一致,即TSH血清水平升高,FT3、FT4、TT3和TT4的血清水平降低。多药联合组中,还出现10%的亚临床甲状腺功能亢进,这与血清甲状腺激素水平的变化趋势相悖。出现这一现象的原因有待进一步研究。精神科常用药物中,目前只有锂盐已被证实会导致甲状腺激素减退[8-9]。Lambert等[10]开展了一项真实世界研究,比较了9种常见治疗双相情感障碍的药物单药治疗后,4年内发生甲状腺功能减退的平均风险率,发现锂盐为8.78%,奥氮平为6.43%,后者与本研究的结果(4.2%)接近。
本研究是回顾性研究,患者的服药疗程和剂量不同可能对结果造成影响。但是,通过Spearman秩相关分析后,未发现药物疗程或者平均日剂量与甲状腺激素变化值存在相关性,因此,可以排除药物的疗程和剂量不同对研究结果有影响的可能性。本研究最大的不足在于样本量过小,这是由于严格的入排标准导致的。精神病患者常需要坚持服药才能控制住病情,而本研究的入组标准要求患者入院前6个月内未使用过长效抗精神病药物,并且前3个月内未使用过非长效抗精神病药物以及已知的对甲状腺功能有影响的药物。这2条入组标准筛选掉了大部分的患者。制定此标准的原因:①甲状腺功能的恢复需要一定的时间,②有些长效抗精神病药物的半衰期可长达3个月。基于样本量小的原因,本研究结果更适合于被当作奥氮平单药或联合用药治疗后血清甲状腺激素水平变化的初步研究结果,还需要大样本的研究提供更可靠的证据。
本研究仅探讨了奥氮平单药治疗与多药联合治疗后甲状腺激素水平的变化情况有差异这一现象,而引起这一现象的原因可能是由于所联合的其他非典型抗精神病药物与奥氮平之间的药理作用的差异造成的,具体原因还有待研究。
目前,关于奥氮平的研究大多数都是针对其对代谢的影响上,如体重增加、血脂异常、血糖升高和肥胖,这些在儿童、青少年和成年患者身上均会发生[11-13]。在使用抗精神病药物的患者中,体重增加与血清FT4水平较低有关[14-15]。在所有的抗精神病药物中,奥氮平最容易引起代谢综合征及体重增加;在所有的非典型抗精神病药物中,奥氮平最容易引起胆固醇和血糖水平升高[16]。亚临床甲状腺功能减退症在BMI值大于29的肥胖人群中非常普遍[17]。在2型糖尿病患者中,TSH血清水平与总胆固醇、低密度脂蛋白胆固醇和三酰甘油的水平呈正相关,与高密度脂蛋白胆固醇的水平呈负相关[18]。基于以上结论,可以推测奥氮平引起血清甲状腺激素水平变化与奥氮平引起代谢综合征之间可能存在一定的关联,相关的机制有待进一步研究。
综上所述,本研究发现,奥氮平治疗后,患者血清甲状腺激素水平会改变,尤其在奥氮平联合其他非典型抗精神病药物治疗后,患者容易出现亚临床甲状腺功能减退。因此,在用奥氮平治疗精神疾病患者时,特别是在奥氮平与其他非典型抗精神病药物联合用药治疗的情况下,应关注甲状腺激素水平的变化,避免甲状腺激素水平异常引起其他的疾病。

