CVVH联合HP治疗重症急性胰腺炎并发多器官功能障碍综合征的临床效果
王丽晖,吴广礼,黄旭东,杨新军,赵 维,陈云爽,张 超
急性胰腺炎(acute pancreatitis, AP)是内科常见的急危重症之一,多由胆源性、高脂性及酒精性等原因引起胰腺组织自身消化所致的胰腺水肿、坏死[1]。重症急性胰腺炎(severe acute pancreatitis, SAP)容易并发多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),其发病率为8%~20%,但病死率高达40%[2]。临床对SAP并发MODS的发病机制及治疗研究仍是近年来的热点。随着连续性肾脏替代治疗(continuous renal replacement therapy, CRRT)在临床重症治疗中的应用,逐渐成为治疗SAP并发MODS的主要疗法[3]。为进一步探讨不同CRRT模式对SAP并发MODS的治疗效果,本研究应用单纯连续性静脉-静脉血液滤过(continuous veno-venous hemofiltration, CVVH)联合血液灌流(hemoperfusion, HP)治疗SAP并发MODS,现报告如下。
1 资料与方法
1.1一般资料 选取2010年1月—2019年12月我院治疗的SAP并发MODS患者63例。纳入标准:符合SAP并发MODS相关诊断标准[4-5],有AP的临床表现,如上腹疼痛,腹胀;均经CT检查证实为AP;血淀粉酶(AMS)水平上升≥3倍者。MODS的诊断标准:①急性肺损伤:急性起病、氧合指数<40 kPa、正位X线胸片显示双肺均有斑片状阴影;②休克:平均动脉压<65 mmHg;③急性肝功能障碍:急性肝细胞坏死功能严重障碍,包括乏力、黄疸、凝血功能障碍等;④急性肾损伤:突然出现少尿无尿,尿量<0.5 ml/(kg·h),持续6 h以上,或肾小球滤过率测定≤40 ml/min。患者或家属签署知情同意书。本研究经我院医学伦理委员会批准。排除标准:合并其他对炎性因子有明显影响的疾病;妊娠期或哺乳期女性;精神疾病者;发病前存在慢性肾小球疾病、慢性肾功能不全、慢性心功能不全、慢性呼吸系统疾病等。其中男41例,女22例;年龄27~75(47.3±5.6)岁;胆源性28例,高脂性23例,酒精性12例。在征得患者本人同意的情况下,根据治疗方法不同分为A组20例、B组22例、C组21例。3组性别、年龄、病因、发病时间、急性生理及慢性健康状况评分系统Ⅱ(APACHEⅡ)评分,以及发病时器官受损情况比较差异均无统计学意义(P>0.05),具有可比性。见表1和表2。

表1 3组SAP并发MODS患者发病时一般资料情况比较

表2 3组SAP并发MODS患者发病时器官受损情况[例(%)]
1.2治疗方法
1.2.1A组:给予常规内科综合治疗,重症监护,禁食水,胃肠减压,肠内营养,抑制胰液分泌,抗感染治疗,维持水电解质和酸碱平衡。此外,胆源性胰腺炎患者则尽可能24 h内进行内镜下治疗。对于合并急性呼吸衰竭的患者,若上述治疗未取得明显的效果,则应加人工辅助通气治疗。
1.2.2B组:在A组基础上行CVVH治疗,采用Seldinger技术经股静脉建立临时性双腔中心静脉导管建立血液净化通路,使用Baxter Aquarius床旁血滤机,AV 600型(Fresenius)聚砜膜血滤器,膜面积1.4 m2。置换液总量每次50~60 L,置换液流量2000~3000 ml/h,以前稀释方式输入,血流量150~200 ml/min。根据患者的病情调整超滤量。每次持续20~24 h。治疗时间最长72 h,治疗24 h后需更换血滤器。根据病情决定治疗次数。采用低分子肝素抗凝,对于有消化道出血或出血风险较大患者,则采用枸橼酸抗凝。
1.2.3C组:在A组基础上行CVVH联合HP治疗,CVVH的治疗方案同B组,治疗开始时加用HA330一次性树脂灌流器(珠海健帆),血流的速度应控制在150~200 ml/min,治疗2 h后,撤掉灌流器,继续行CVVH治疗。
1.3观察指标及检测方法 测定3组治疗前及治疗5 d后的APACHEⅡ评分,血生化指标包括尿素氮(BUN)、肌酐(Scr)、胆固醇(TC)、甘油三酯(TG)、AMS等,炎性因子包括肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、IL-1β、超敏C反应蛋白(hs-CRP)水平的变化。3组在相应时间点取空腹静脉血,BUN、Scr、TC、TG和AMS采用贝克曼AU5800全自动生化分析仪检测。hs-CRP以乳胶比浊法检测,试剂盒购自重庆博士泰生物科技有限公司。TNF-α、IL-6、IL-1β采用酶联免疫吸附测定法检测,试剂盒购自江苏江莱生物科技有限公司。所有操作步骤均严格按照试剂盒说明书进行。
1.4临床疗效判定标准[6]①显著缓解:治疗5 d后,体征或症状缓解>1个等级,且经实验室检查显示AMS水平显著下降或恢复正常;②减轻:治疗5 d后,体征或症状减轻1个等级,AMS水平有所控制;③无效:治疗5 d后,未达到上述标准。总有效率=(显著缓解+减轻)/总例数×100%。

2 结果
2.1临床疗效比较 B组和C组的临床总有效率明显高于A组,差异有统计学意义(P<0.05)。C组临床总有效率与B组比较差异无统计学意义(P>0.05)。见表3。

表3 3组SAP并发MODS患者临床疗效比较[例(%)]
2.2生化指标及APACHEⅡ评分比较 治疗前,3组BUN、Scr、TC、TG、AMS及APACHEⅡ评分比较差异均无统计学意义(P>0.05)。治疗后,B组和C组BUN、Scr、TC、TG、AMS及APACHEⅡ评分较治疗前和A组明显下降,且C组下降幅度较B组更明显,差异有统计学意义(P<0.05)。见表4。
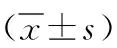
表4 3组SAP并发MODS患者治疗前后临床生化指标及APACHEⅡ评分比较
2.3炎性因子水平比较 治疗前,3组TNF-α、IL-6、IL-1β及hs-CRP水平比较差异均无统计学意义(P>0.05)。治疗后,B组和C组TNF-α、IL-6、IL-1β及hs-CRP水平较治疗前和A组明显下降,而C组上述指标下降较B组更明显,差异有统计学意义(P<0.05)。见表5。
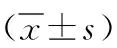
表5 3组SAP并发MODS患者治疗前后炎性因子水平比较
3 讨论
SAP起病急、病情进展快,并发MODS后,病死率高[6]。本研究资料也表明,SAP并发MODS后,出现急性肺损伤31.7%、急性肾损伤54.0%、肝功能障碍61.9%、休克30.2%、消化道出血57.1%、凝血异常68.3%,器官损伤严重。SAP并发MODS的发病机制主要与炎性因子的参与有关。有研究表明,在SAP并发MODS中,炎性因子大量释放,引起过度的炎症反应,导致的胰腺炎症、坏死[7]。胰腺组织内单核-巨噬细胞系统激活后释放促炎细胞因子,启动炎症风暴,其中TNF-α,IL-1是早期启动炎症反应的起始因子[8-9]。本研究结果表明,3组在发病初期TNF-α、IL-1β、IL-6和hs-CRP明显增高,提示这些炎性因子在SAP并发MODS中发挥了一定作用,参与了其发病及发展过程。早期检测血浆中TNF-α水平,有助于预测SAP发生,提醒临床医师尽早进行器官保护。IL-1β在SAP中呈高表达状态,有助于早期评估机体脏器功能损伤程度。而hs-CRP与SAP病情程度呈正相关,有助于早期预测感染性胰腺坏死发生可能性[10]。所以尽快清除炎性因子成为治疗SAP并发MODS治疗的关键。
CVVH是一种持续肾脏替代疗法,近年来,更多地应用重症医学救治中。CVVH通过对流原理清除过多的炎性因子,减轻或消除机体的炎症风暴[11],保护各个脏器功能。本研究结果表明,治疗5 d后,B组血BUN、Scr、TC、TG、AMS及APACHEⅡ评分较A组明显下降,同时炎性因子及hs-CRP水平较A组明显下降。提示CVVH可以明显改善SAP并发MODS患者的临床表现,防止器官衰竭,可能与其清除炎性因子有关。另外高容量CVVH[置换液50~70 ml/(kg·h)]可以通过改善单核-巨噬细胞的功能,降低炎性因子产生,从根本上发挥清除炎性因子的作用[12]。所以,临床上全面掌握指征,尽早行CVVH治疗,能有效提高SAP并发MODS患者的临床缓解率。
HP治疗在炎性因子的清除方面也有独特的作用。有研究在CVVH的基础上,加用血液灌流器,利用表面积丰富的灌流器树脂及活性炭成分,有效吸附炎症介质,从而减轻其对脏器造成的损伤[13-15]。本研究选择的HA330型树脂灌流器,对含有亲脂疏水基团等环状结构的中大分子物质吸附能力极强,可相对特异性选择吸附TNF-α、IL-6和IL-1β等炎性因子,且吸附容量大、速率快。CVVH联合HP治疗可先用HP吸附血脂和炎性因子,在一定程度上降低血液黏滞度,减少血滤器凝血和管路凝血的发生率[16],然后再应用CVVH进一步清除炎性因子,二者的序贯治疗能有效地吸附清除脂类和炎性因子,降低由此造成的各脏器损伤,从而改善患者的预后[17]。本研究结果显示,虽然单纯CVVH治疗和CVVH联合HP治疗的总有效率比较差异无统计学意义,但CVVH联合HP治疗患者的血脂、肾功能、AMS和APACHEⅡ评分显著低于单纯CVVH治疗。提示CVVH联合HP治疗在降低血脂、保护肾脏和胰腺功能方面优于单纯CVVH治疗。同时CVVH联合HP治疗的炎性因子水平明显较单纯CVVH治疗降低,提示CVVH联合HP治疗在清除炎性因子方面较单纯CVVH治疗有一定优势。
综上所述,CVVH联合HP治疗能迅速改善SAP并发MODS患者的临床症状和预后,减轻机体的炎症反应,有较高临床应用价值。

