一种改进的小脑颗粒神经元原代培养方法及其性质鉴定
陈海云
(广东药科大学药学院药理系,广州 广东 510006)
小脑颗粒神经元(cerebellar granule neurons,CGNs)因具有高度组织化的结构和极少量的神经元亚型的特征,在揭示控制神经元存活、迁移和分化的信号通路及递质信息传递方面具有重要价值,已成为分子生物学和细胞生物学研究神经发育与功能的重要手段[1, 2]。此外,由于CGNs在哺乳动物中枢神经系统里具有含量高、均一性好,以及体外培养方法简单可靠等特点,已被广泛用于评估候选神经保护剂的多种神经损伤剂诱导的体外模型实验中[3, 4]。然而,通过文献检索发现[5-7],目前国内外报导的原代CGNs培养方法尽管很多,但大多还是采用胰酶(trypsin)消化脑组织,结果使得获取的CGNs存活率相对较低;更为突出的是通过该方法得到的细胞生长环境中充斥着较多细胞碎片等杂质,使得培养板底部背景模糊、视野不清晰,极大的干扰后续免疫荧光拍照等实验的顺利进行。因此,本研究通过在原有CGNs培养方法基础上[1],将Trypsin替换为将Tryple Express消化液并采用前后两次离心方法,发现改进后的CGNs提取方法细胞生长状态良好、突触发育完善,并具有较高存活率及纯度(97%);此外,使用改进后方法获取的细胞背景更干净、含有细胞碎片等杂质更少。改进后的新生SD大鼠原代CGNs培养稳定可靠,可以为神经系统疾病的研究提供参考。
1 材料与方法
1.1 材料SPF级SD乳鼠(出生后7~8 d)[合格证号:SCXK(粤)2018-0002,广东省医学实验动物中心];basal modified Eagle’s medium(BME培养基,美国Gibco公司,21010046)、L-glutamine(200 mmol·L-1,美国Gibco公司,25030081)、1×TrypLE Express Enzyme(美国Gibco公司,1604021)、胎牛血清(FBS,美国Gibco公司,10100147);脱氧核糖核酸酶Ⅰ(DNaseⅠ,美国Sigma-Aldrich公司,DN25),阿糖胞苷(Ara-C,美国Sigma-Aldrich公司,BP383)、多聚赖氨酸(Poly-L-lysine,PLL,美国Sigma-Aldrich公司,P7890)、Glucose(美国Sigma-Aldrich,GB270)、MTT(美国Sigma-Aldrich,M2128)、Sodium bicarbonate(美国Sigma-Aldrich公司,S5761);HBSS缓冲液、PBS缓冲液、HEPES(美国Corning Cellgro公司);抗βⅢ微管蛋白多克隆抗体(β-Ⅲ-tubulin,英国Abcam公司,ab18207)、异硫氰酸荧光素标记的羊抗兔IgG(fluorescein isothiocyanate,FITC,美国Sigma-Aldrich公司,F0257)、DAPI(碧云天生物,C1002);常规解剖器械一套、解剖镜、荧光显微镜等。
1.2 方法
1.2.1细胞培养板的包被 采用蒸馏水将L-多聚赖氨酸配制成1 g·L-1的储液,经0.22 μm的滤膜过滤除菌后,用灭菌蒸馏水稀释成终浓度为40 mg·L-1待用。加入培养板中,以覆盖培养板底部为准,37 ℃培养箱内放置4~6 h或4 ℃包被过夜,因PLL对神经元有一定的毒性作用,故应用灭菌去离子水或HBSS冲洗2次,在通风橱中风干后用锡纸包好,置于4 ℃冰箱待用。
1.2.2培养操作液的配制 溶液1(Dissection Solution):NaCl(124 mmol·L-1),KCl(5.37 mol·L-1),NaH2PO4(1 mmol·L-1),D-glucose(14.5 mmol·L-1),HEPES(25.0 mmol·L-1),MgSO4(2.5 mmol·L-1),BSA(3 g·L-1)用10 N NaOH调节pH至7.4后。加入0.08 g·L-1的DNase,3%的FBS及5.7 mmol·L-1的MgSO4。
溶液2: 1×TrypLE Express消化液。溶液3:在溶液1中加入0.0258 g·L-1的DNase,1%的FBS及3.5 mmol·L-1的MgSO4。溶液4:在溶液1中加入终浓度为0.1 mmol·L-1的CaCl2及5.0 mmol·L-1的MgSO4。BME完全培养液:BME基础培养基+10% FBS+25 mmol·L-1KCl+ 2 mmol·L-1glutamax。
1.2.3小脑颗粒神经元的提取及原代培养方法 培养方法1(Method 1):取7~8 d的SD乳鼠(雌雄不分),将分离出来的小脑组织置于适量溶液1中。在解剖显微镜下用尖头解剖镊剔除软脑膜和外周毛细血管,同时除去小脑两侧的绒球。然后用眼科剪将小脑组织剪成0.5 mm3左右的细小颗粒,装入15 mL离心管中,然后加入预热好的5 mL 0.05%的Trypsin(含有5% DNaseⅠ)中,轻轻摇匀,37 ℃水浴锅中消化15 min,每隔5 min轻柔摇晃一下,然后加入等体积的BME完全培养基终止胰蛋白酶的消化作用。并用经火焰抛光的无菌玻璃管反复轻柔吹打使之变成均匀单一的细胞混悬液,经40 μm筛网过滤,1 500 r·min-1离心3 min,弃掉上清后加入BME完全培养基,经台盼蓝计数后以1.0×106~1.5×106个/mL的密度接种于事先经PLL包被好的培养板中,20~24 h加入阿糖胞苷(10 μmol·L-1)以抑制非神经细胞的生长。
培养方法2(Method 2):取7~8 d的SD乳鼠(雌雄不分),将分离出来的小脑组织置于适量溶液1中。在解剖显微镜下用尖头解剖镊剔除软脑膜和外周毛细血管,同时除去小脑两侧的绒球。然后用眼科剪将小脑组织剪成0.5 mm3左右的细小颗粒,装入15 mL离心管中,1 500 r·min-1离心3 min,弃掉上清,加入6 mL预热好的溶液2,轻轻摇匀,37 ℃水浴锅中消化15 min,每隔5 min轻轻摇晃一下。待消化完成后加入3 mL溶液3终止消化,1 500 r·min-1离心3 min,弃上清,加入2 mL溶液3和3 mL溶液4,用经火焰抛光的无菌玻璃管反复轻柔吹打使之变成均匀单一的细胞混浊液,静置后收集上清,用40 μm细胞过滤器过滤,滤液经1 500 r·min-1离心3 min。弃上清,加入适量BME培养基轻轻来回反复吹打制成细胞混悬液,经台盼蓝计数后以1.0×106~1.5×106个/mL的密度接种于事先经PLL包被好的的培养板中。20~24 h后,加入阿糖胞苷(10 μmol·L-1)以抑制非神经细胞的生长。细胞培养过程中不换液,从培养d 4起,每隔3 d加入D-葡萄糖(5 mmol·L-1)以补充细胞生长过程中消耗的能量物质及蒸发的水分。CGNs培养到d 8后,用β-Ⅲ-tubulin染色进行免疫荧光实验对CGNs进行形态观察及纯度鉴定。
1.2.4细胞存活率计数 将上述两种方法提取的原代CGNs,分别经台盼蓝染色后,在显微镜下计数台盼蓝染色的阳性细胞数和总的细胞数。并参照以下公式分别计算两种方法提取的CGNs的细胞存活率。
细胞存活率/% =阴性染色细胞数(拒染细胞数)/总细胞数×100%。

Fig 1 Two different methods of isolating CGNs from SD rats
1.2.5CGNs的形态学观察 CGNs接种后,分别于d 1、3、5、8借助显微镜(400×)观察CGNs的生长状态及突触发育等情况。
1.2.6 CGNs的免疫组织化学鉴定取出接种在细胞爬片上的培养至d 8的分化成熟的原代CGNs,吸掉上清后加入预冷的HBSS洗3次,4%多聚甲醛室温固定10 ~15 min,弃上清,PBS洗2次后加入0.1% TritonX-100处理10 ~15 min,PBS洗3次后,加入10%马血清(以PBS或者HBSS稀释)室温封闭1 h,吸去封闭液,直接加入一抗anti-neuron specific β-Ⅲ-tubulin antibody-neuronal marker(1 ∶ 400)室温孵育2 h,PBS洗3次,每次5 min,然后先后加入荧光素标记的二抗Anti-rabbit IgG-FITC(1 ∶ 100)和4′,6-二脒基-2-苯基吲哚(DAPI, 5 mg·L-1),室温避光孵育45 min,PBS洗涤干净后,进行封片处理并于荧光显微镜下进行拍照。取40×物镜下随机抽取5个视野内统计全部细胞及阳性细胞的数目。
神经元细胞纯度/%=阳性细胞数/全部细胞数×100%
1.2.7星形胶质细胞的形态观察 取出培养至d 8的分化成熟的原代小脑颗粒神经细胞,吸掉上清后加入预冷的0.01 mmol·L-1PBS洗3次,4%多聚甲醛室温固定15 min,PBS洗2次后加入0.1% TritonX-100室温孵育10~15 min,PBS洗3次,每次5 min,加入10%马血清(以1×PBS稀释)封闭1 h,吸去封闭液,加入一抗GFAP(1 ∶ 400)室温孵育2 h,PBS洗3次,每次5 min,然后加入荧光素标记的二抗Anti-rabbit IgG-FITC(1 ∶ 100)室温避光孵育45 min,PBS洗涤后,在每块载玻片上滴入适量抗荧光猝灭试剂封片,将细胞爬片密封,自然晾干,奥林巴斯倒置荧光显微镜下拍照。

2 结果
2.1 CGNs的细胞存活率采用方法2提取的原代CGNs,经台盼蓝染色后计数细胞的存活率,结果显示细胞的存活率高达95%左右(n=5);而采取方法1提取方法获得的原代CGS的存活率才达64.7%。
2.2 CGNs提取方法改进前后收获的单细胞数量比较在分离组织总量基本一致的情况下,相比原方法(方法1),改进后的方法(方法2)采用Tryple Express消化液能够明显减少受损的神经元,从而使CGNs单细胞数量明显增加。
2.3 CGNs神经元生长形态变化CGNs接种1~2 h后,大多数神经元就已经贴壁较好,细胞呈现圆形,非常均匀地分散在培养板中;接种24 h后,大部分神经元胞体变大,并长出细胞突起;同时极小部分神经元形状发生改变,逐渐变成梭形、锥形或颗粒状不等(Fig 3A)。待到d 3,神经元突起继续变长甚至弯曲,彼此连接形成大而复杂的神经网络(Fig 3B)。当神经元继续培养至d 5时,神经元胞体立体感明显增强,胞体有聚集的倾向,并且神经元上的突起继续变粗变长,彼此重叠交织,形成更加复杂的神经网络(Fig 3C)。直至d 7~10 ,神经元胞体进一步增大,相比d 5,胞体更加丰满透亮,立体感也是明显增强,突起进一步增粗、延长,神经网络纵横交错;并且胞体间彼此靠近聚拢趋势加重,出现部分神经元聚集成团现象(Fig 3D)。原方法较为突出的一个缺点主要表现为细胞接种板底部背景较为模糊,含较多碎片杂质所致;而使用改进方法接种的神经元培养板底部背景较为清晰干净,杂质较少(Fig 3E、3F)。

Fig 2 The relative cell numbers obtained with two methods**P<0.01 vs Method 1.

Fig 3 Morphology of CGNs in different culture time(×400)
2.4 CGNs的纯度鉴定CGNs培养至d 8进行免疫细胞荧光实验,染色结果显示:CGNs阳性细胞呈绿色,胞体饱满,突触交错密集,突起走形清楚,形态良好,核大清晰(Fig 4)。用DAPI对细胞核进行染色以确定CGNs的总细胞数目,计算阳性胞占总细胞数目的百分率,经统计学分析其纯度为(97.8±0.7)%。结果显示,改进后体外培养的CGNs纯度较高。
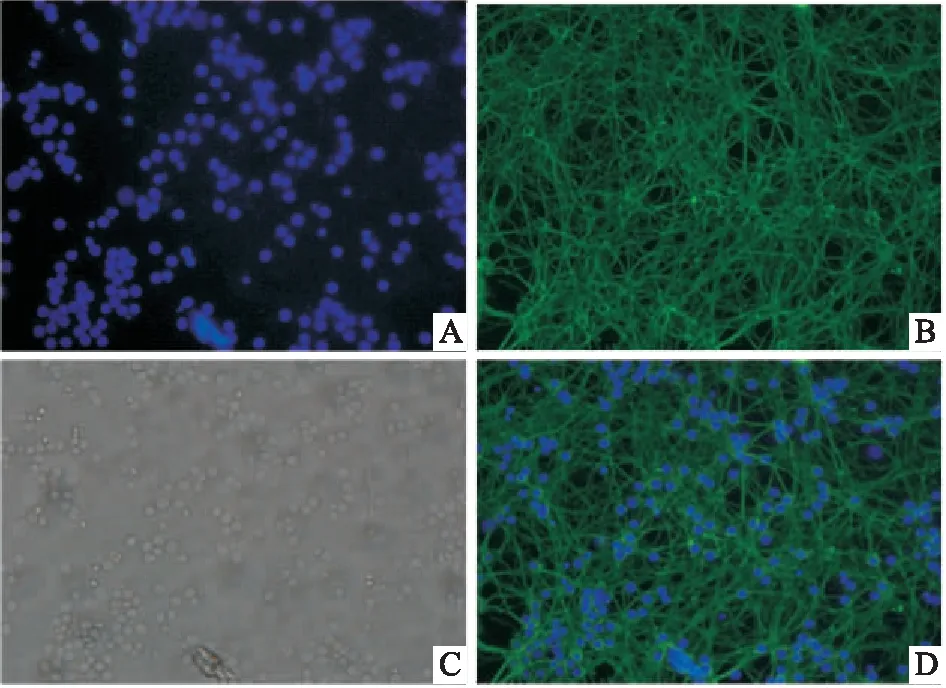
Fig 4 Immunofluorescence staining of CGNs on day 8(400×)
3 讨论
CGNs是小脑内含量最为丰富的中间神经元,在小脑内超过90%的神经元为CGNs,在神经退行性疾病和神经保护方面,CGNs已经成为研究神经保护的众多原代细胞中的重要工具之一[8-9]。本实验采取一种全新的原代CGNs的提取培养方法,通过在原有培养方法基础上对细胞分离及神经元维持等相应步骤进行了适当改进,特别是在对分离的组织进行消化前增加一次离心以便去除部分碎片,以及采用性质更温和的Tryple Express消化液代替传统方法中的Trypsin,极大地减少了消化过程中引起的细胞损伤。通过上述两处提取方法的改变后获得的原代CGNs单细胞总数明显增多;此外通过对生长细胞的性质、纯度、形态及突触发育状况进行了鉴定评估发现,改进后的提取方法能够获得碎片更少、接种板底部背景更清晰、纯度较高,且神经元形态及突触发育良好的原代CGNs细胞,为神经系统疾病的研究提供了较为理想的实验模型。
通过对国内外文献调研发现,很少有文献报道在提取原代CGNs过程中会在消化前进行一次离心操作。而改进后的原代CGNs提取方法通过在加入Tryple Express消化液前对搜集的CGNs组织进行一次离心,其目的就是为了去除在前面剥离、剪碎CGNs组织过程中产生的细胞碎片、脑膜及渗入进来的血细胞等杂质,从而获得较高纯度的CGNs组织进行消化。上述离心步骤的处理也是后续实验获得较高纯度的单个CGNs的一个重要原因。
目前,国内外大多文献报导的原代CGNs提取方法主要采用为含EDTA的0.05% Trypsin对分离出来的脑组织进行消化[5-7]。但是参照这些使用Trypsin消化方法得到的CGNs细胞检测发现细胞存活力相对较低,从而导致获得的细胞量相对较少(Fig 2);此外,通过该方法获得的细胞含有较多碎片而使得培养板底部背景较为迷糊(Fig 3E),这对后续实验的顺利开展会造成一定影响特别是一些需要拍照的免疫组化及免疫荧光相关实验等。Trypsin作为一种动物源性的消化酶,由于生产批次不同,其稳定性很难得到有效控制;并且Trypsin活性需要用其特异性抑制剂才能灭活,这些都会对原代CGNs提取操作过程中的组织消化产生影响,进而导致细胞受损甚至死亡。经过改进后,本实验采Tryple Express替代酶进行消化分离。Tryple Express是一种无动物源性的重组酶,主要依赖赖氨酸和精氨酸的C-末端侧切割肽键,其动力学性质和裂解特异性均与Trypsin类似,是胰蛋白酶的直接替代品。但是由于Tryple Express的纯度比Trypsin高,可以减少Trypsin提取物中的其他酶引起的细胞损伤,可直接替代实验步骤中含EDTA的0.05% Trypsin消化液[10]。采用改进的原代CGNs提取方法,借助Tryple Express消化液对获得CGNs组织进行消化发现:一方面可以明显减少死细胞裂解释放的DNA所导致的组织缠绕;另一方面增大消化液与CGNs组织的接触面积,从而极大地提高了消化效率,最终获得的活细胞数量得到很大程度的提高。
本论文通过对原有原代CGNs的提取培养方法进行改进,特别是在消化前增加一次离心及改用性质更加温和的Tryple Express消化液对获得的CGNs组织进行消化,不仅极大的去除了细胞碎片、脑膜及血细胞等杂质,还显著地降低了传统方法中Trypsin对神经细胞的损伤,从而获得了高纯度、高收率、高存活率的CGNs神经元。