冰片配伍黄芪甲苷和三七总皂苷对脑缺血/再灌注损伤后神经血管单元的保护作用
欧阳波,杨筱倩,丁 煌,刘晓丹,黄小平,邓常清
(湖南中医药大学分子病理实验室,中西医结合心脑疾病防治湖南省重点实验室,细胞生物学与分子技术湖南省高校重点实验室,湖南 长沙 410208)
缺血性脑卒中是严重威胁人类生命健康的疾病。以往的神经保护药物都以保护神经元为核心,忽略了神经元、胶质细胞与微血管之间的相互关系[1],临床疗效与预期结果相差甚远。近年来研究表明[2],所有的脑细胞及基质成分都参与了脑组织缺血损伤过程,并非只有神经元或血管参与病理反应。因此,美国国家神经疾病和中风学会提出以神经元、微血管及神经胶质细胞为主要成分的神经血管单元(neurovascular unit,NVU)的概念[3],强调在脑卒中治疗中,通过对 NVU 各成分保护,以减轻脑组织损伤。
中医认为缺血性中风的主要病机是气虚血瘀,益气活血法为其基本治则。黄芪具有补气之功,三七具有活血之效,二者配伍具有益气活血的功效,为治疗心脑血管疾病的常用药对。其中黄芪甲苷(astragaloside Ⅳ,AST Ⅳ)和三七总皂苷(panax notoginseng saponins,PNS)分别为黄芪和三七心脑血管效应的主要药效组分[4]。以往我们研究表明,AST Ⅳ 和 PNS 配伍具有多环节、多靶点抗缺血性脑损伤的作用[5],但AST Ⅳ 和 PNS 分子量较大、脂溶性低,难以透过血脑屏障(blood brain barrier,BBB)。而冰片具有“引药上行”的作用,可促进药物透过BBB。我们将冰片配伍AST Ⅳ 和 PNS,可促进AST Ⅳ 和 PNS 的药物成分在缺血/再灌注侧大脑皮层富集[6]。推测冰片配伍AST Ⅳ 和 PNS 可能对 NVU 的各组分具有保护作用。本文从 NVU 保护探讨冰片配伍AST Ⅳ 和 PNS 对大鼠脑缺血/再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)后 NVU 的保护作用。
1 材料与方法
1.1 动物SPF 级 SD 大鼠,♂,体质量(220~250) g,由湖南斯莱克景达实验动物有限公司提供,动物生产合格证号为 No 43004700037715。饲养于湖南中医药大学动物实验中心(场地许可证号: SKY(湘)2013-0005)。实验前适应性喂养(5~7)d,给药前禁食 12 h,自由饮水。动物的使用符合科技部《关于善待实验动物的指导性意见》相关规定。
1.2 主要药物冰片(左旋龙脑,主要成分为 1,7-三甲基-二环庚-2-醇,含量 86%,购自湖北俊辉有限公司,批号 20170815);AST Ⅳ(纯度 ≥ 98%,批号 MUST-17022804)、PNS(纯度 ≥ 98%,批号 MUST-17060601)均购自成都曼思特生物科技有限公司,用时以 0.5% 羧甲基纤维素钠配成混悬液;依达拉奉注射液(3-甲基-1-苯基-2-吡唑啉-5 酮)购自南京先声东元制药有限公司生产,批号 80-090104,规格10 mg/支(5 mL),用时以生理盐水配成 0.4 g·L-1溶液备用。
1.3 主要试剂兔抗大鼠神经元特异性核蛋白(neuron specific nuclear,NeuN)多克隆抗体(批号A0951)、兔抗大鼠 Laminin(LN)多克隆抗体(批号A9872)、兔抗大鼠胶质纤维酸性蛋白(glialfibrillary acidic protein,GFAP)单克隆抗体(批号A0237)、兔抗大鼠 β-actin 多克隆抗体(批号AC026)均购自美国ABclonal 公司;兔抗大鼠基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)多克隆抗体(批号 ab38898)、兔抗大鼠水通道蛋白4(aquaporin 4,AQP-4)多克隆抗体(批号 ab46182)均购自英国Abcam 公司;HRP 标记的山羊抗兔二抗(美国Proteintech 公司,批号 SA00001-2)。ECL 化学发光液(北京鼎国昌盛生物科技有限公司,批号 GE2301)、蛋白 Marker(美国 Thermo-fisher,批号 515683)、BCA 蛋白定量试剂盒(北京中杉金桥生物技术有限公司,批号 K176810E)、通用型二步法试剂盒(北京中杉金桥生物技术有限公司,批号 PV-9000)、2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium hloride,TTC)(美国 Sigma 公司,批号 C10654018)。
1.4 仪器BX51 光学显微镜(日本 Olympus),RM2235 石蜡切片机(德国 Leica),Chemi-DoC XRS+化学发光成像分析仪(美国 Bio-Rad),ELX800 多功能酶标仪(美国 biotek),041BR132283 电泳/转膜装置(美国 Bio-Rad)。
2 方法
2.1 动物分组与给药根据以往研究[7],将动物随机分为假手术组、模型组、冰片(7.5 mg·kg-1)组、AST Ⅳ(10 mg·kg-1)组、PNS(25 mg·kg-1)组、AST Ⅳ+PNS(AST Ⅳ 10 mg·kg-1+PNS 25 mg·kg-1)组、低剂量(冰片 7.5 mg·kg-1+AST Ⅳ 10 mg·kg-1+PNS 25 mg·kg-1)组、高剂量(冰片 15 mg·kg-1+AST Ⅳ 20 mg·kg-1+PNS 50 mg·kg-1)组、依达拉奉(4 mg·kg-1)组。各组于造模前 3 d灌胃给药,每日 2 次,同时腹腔注射等量生理盐水。依达拉奉组腹腔注射给药,同时灌胃等量 0.5% 羧甲基纤维素钠,每日2次。假手术组与模型组以 0.5% 羧甲基纤维素钠 10 mL·kg-1剂量灌胃给药,同时腹腔注射等量生理盐水,每日2次。末次给药后2 h造模。缺血2 h后进行再灌注,再灌注期间同前给药,再灌注22 h 进行检测。
2.2 右侧大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)法制备CIRI 模型 按以往方法[6]制作线栓法 MCAO 局灶性脑缺血模型,阻断2 h后,拔出线栓进行再灌注22 h。假手术组不做插线处理,其他操作同模型组。各组纳入 Bederson 评分[8]为 1~3 分的大鼠,剔除评分为 0 分或 4 分的大鼠。
2.3 检测指标
2.3.1神经功能缺损评分 采用盲法对各组进行 Garcia评分[9],从大鼠自主运动、体态对称性、前肢伸展功能、网屏实验、身体双侧触觉、双侧胡须反射等 6 个方面评定神经功能损伤程度,功能正常时得分最高(18 分),功能损伤最严重者得分最低(3 分)。
2.3.2脑梗死体积测定 麻醉,断头取脑,去除小脑和脑干,-20 ℃ 冷冻 30 min 后将脑组织制成厚度为 2 mm 的冠状切片。将脑片置于 4% TTC 液中 37 ℃ 避光孵育 30 min, 然后以 4% 多聚甲醛固定 24 h 后拍照。用 Image J 图像分析软件计算脑梗死区(苍白区)面积,将各脑片梗死面积与厚度的乘积累加,获得梗死体积。计算梗死体积百分率:梗死体积百分率/%=梗死区体积/正常侧大脑半球体积 ×100 %。
2.3.3免疫组织化学法检测GFAP、NeuN、LN 蛋白表达 脑组织置 4% 多聚甲醛固定48 h,石蜡包埋,自视交叉后行冠状切片,层厚5 μm。常规脱蜡、脱水;置枸橼酸钠缓冲液中微波抗原修复20 min,冷却至室温,PBS漂洗3次,每次5 min,山羊血清封闭 30 min;再分别加兔抗大鼠 GFAP 抗体(1 ∶ 400)、兔抗大鼠 NeuN 抗体(1 ∶ 400)、兔抗大鼠 LN 抗体(1 ∶ 400),4 ℃ 孵育过夜;PBS 漂洗,滴加 HRP 标记的二抗,37 ℃ 孵育 1 h, PBS 漂洗, DAB 显色,苏木精复染,自来水冲洗,梯度乙醇脱水,二甲苯透明,树脂封片。光学显微镜下观察缺血侧海马CA1区,GFAP 阳性染色可见棕黄或棕褐色免疫反应产物沉积于星形胶质细胞胞质,NeuN 阳性染色可见棕黄或棕褐色免疫反应产物沉积于神经元胞质、突起,LN 阳性染色可见棕黄或棕褐色免疫反应产物沉积于血管内皮基底膜。每只大鼠随机取 3 个不重叠高倍视野(× 400)拍照,用 Image J 图像分析系统分别计数 GFAP、NeuN、LN 阳性表达的平均光密度(Mean density, MD),代表目的蛋白的相对表达量。
2.3.4Western blot 检测AQP-4、MMP9蛋白的表达 取患侧视交叉后 2~6 mm 脑组 50 mg,提取总蛋白,BCA 法测定总蛋白量。每个样本取 80 μg 蛋白,100 ℃水浴 10 min 变性,SDS-PAGE 电泳90 min,200 mA 转膜2 h,5% 脱脂牛奶封闭1 h,分别加入兔抗大鼠 MMP-9 抗体(1 ∶ 1 000)、兔抗大鼠AQP-4 抗体(1 ∶ 1 000),兔抗大鼠 β-actin 抗体(1 ∶ 8 000) 4 ℃ 孵育过夜,TBST 洗膜3次;再分别加山羊抗兔二抗(1 ∶ 5 000),37 ℃ 孵育 1 h,TBST 洗膜3次后加 ECL 化学发光剂显影。用 Image Lab 图像分析软件测定目的条带的积分光密度值(integral optical density, IOD),以目的条带的 IOD 与 β-actin 条带 IOD 的比值作为该目的蛋白相对表达量。
3 结果
3.1 冰片配伍AST Ⅳ和PNS对神经功能的影响假手术组大鼠神经功能正常,行为学评分为 16~18 分。与假手术组比较,模型组大鼠表现自主运动减少、身体扭曲、左前爪不能完全伸展、左前爪脱网、触觉减弱、胡须反射减少等神经功能障碍症状,神经功能评分明显低于假手术组(P<0.01);与模型组比较,PNS 组、AST Ⅳ+PNS 组及低剂量组、高剂量组、依达拉奉组神经功能评分明显升高(P<0.05 和P<0.01);与AST Ⅳ+PNS 组比较,低剂量组、高剂量组和依达拉奉组神经功能评分明显升高(P<0.05 和P<0.01)(Tab 1)。
Tab 1 The Garcia J H neurological function scores of each group n=5)
3.2 冰片配伍AST Ⅳ和PNS对脑梗死体积的影响TTC 染色显示,假手术组无苍白梗死区。与假手术组比较,模型组梗死体积明显增加(P<0.01);与模型组比较,冰片组、AST Ⅳ 组、PNS 组、AST Ⅳ+PNS 组、低剂量组、高剂量组、依达拉奉组脑梗死体积明显减少(P<0.01);与AST Ⅳ+PNS 组比较,低剂量组、高剂量组、依达拉奉组脑梗死体积明显降低(P<0.05)(Fig 1)。

Fig 1 Volume of cerebral infarction
3.3 冰片配伍AST Ⅳ和PNS对脑组织GFAP、NeuN、LN 表达的影响 与假手术组比较,模型组 GFAP 表达明显增加(P<0.01);与模型组比较,PNS 组、AST Ⅳ+PNS 组、低剂量组、高剂量组、依达拉奉组 GFAP 表达均明显减少(P<0.05和P<0.01);与AST Ⅳ+PNS 组比较,低剂量组、高剂量组、依达拉奉组 GFAP 表达明显减少(P<0.01);低剂量组、高剂量组 GFAP 表达组间差异无统计学意义(P>0.05)(Fig 2)。
与假手术组比较,模型组 NeuN 表达明显减少(P<0.01);与模型组比较,冰片组、AST Ⅳ 组、PNS 组、AST Ⅳ+PNS 组、低剂量组、高剂量组、依达拉奉
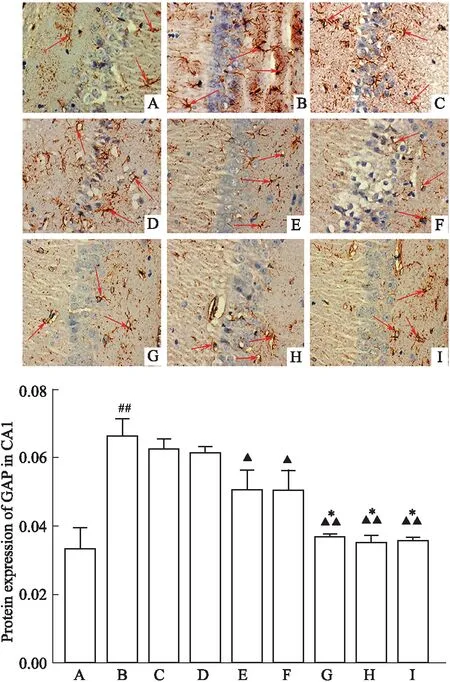
Fig 2 Expression of GFAP
组 NeuN 表达明显增加(P<0.01);与AST Ⅳ+PNS 组比较,低剂量组、高剂量组、依达拉奉组 NeuN 表达明显增加(P<0.01);低剂量组、高剂量组 NeuN 表达组间差异无统计学意义(P>0.05)(Fig 3)。
与假手术组比较,模型组 LN 表达明显减少(P<0.01);与模型组比较,冰片组、AST Ⅳ 组、PNS 组、AST Ⅳ+PNS 组、低剂量组、高剂量组、依达拉奉组 LN 表达明显增加(P<0.05,P<0.01);与AST Ⅳ+PNS 组比较,高剂量组、依达拉奉组 LN 表达明显增加(P<0.01);低剂量组、高剂量组 LN 表达组间差异无统计学意义(P>0.05)(Fig 4)。
3.4 冰片配伍AST Ⅳ 和 PNS 对脑组织AQP-4、MMP9 表达的影响与假手术组比较,模型组AQP-4 表达明显增加(P<0.05);与模型组比较,低剂量组、高剂量组AQP-4 表达明显降低(P<0.05);与AST Ⅳ+PNS 组比较,高剂量组AQP-4 表达明显降低(P<0.05);低剂量组、高剂量组AQP-4 表达组间差异无统计学意义(P>0.05)。

Fig 3 Expression of NeuN in each group n=5)(× 400, bar=20 μm)
与假手术组比较,模型组MMP-9表达明显增加(P<0.01);与模型组比较,高剂量组MMP-9 表达明显降低(P<0.05);与AST Ⅳ+PNS 组比较,低剂量组、高剂量组MMP-9表达明显降低(P<0.05);低剂量组、高剂量组 MMP-9 表达组间差异无统计学意义(P>0.05)(Fig 5)。
4 讨论
CIRI 是一个多因素、多细胞介导的病理损伤过程,兴奋毒性、细胞内 Ca2+超载、自由基损伤、炎症反应等可导致神经元和血管内皮受损,BBB 通透性增加,同时小胶质细胞和星形胶质细胞激活,释放大量细胞因子及炎症介质,引起神经元、血管内皮细胞和胶质细胞损伤,从而加重脑损伤[10]。NVU 是中枢神经系统的结构和功能单元,由神经元、胶质细胞、内皮细胞等组成。NVU 作为一个整体结构,对维持脑结构及功能的正常具有重要作用。目前认为,单一的神经元保护药物对缺血性脑损伤保护作用有限,因此,从 NVU 各成分的保护是缺血性脑卒中的重要治疗策略[11]。
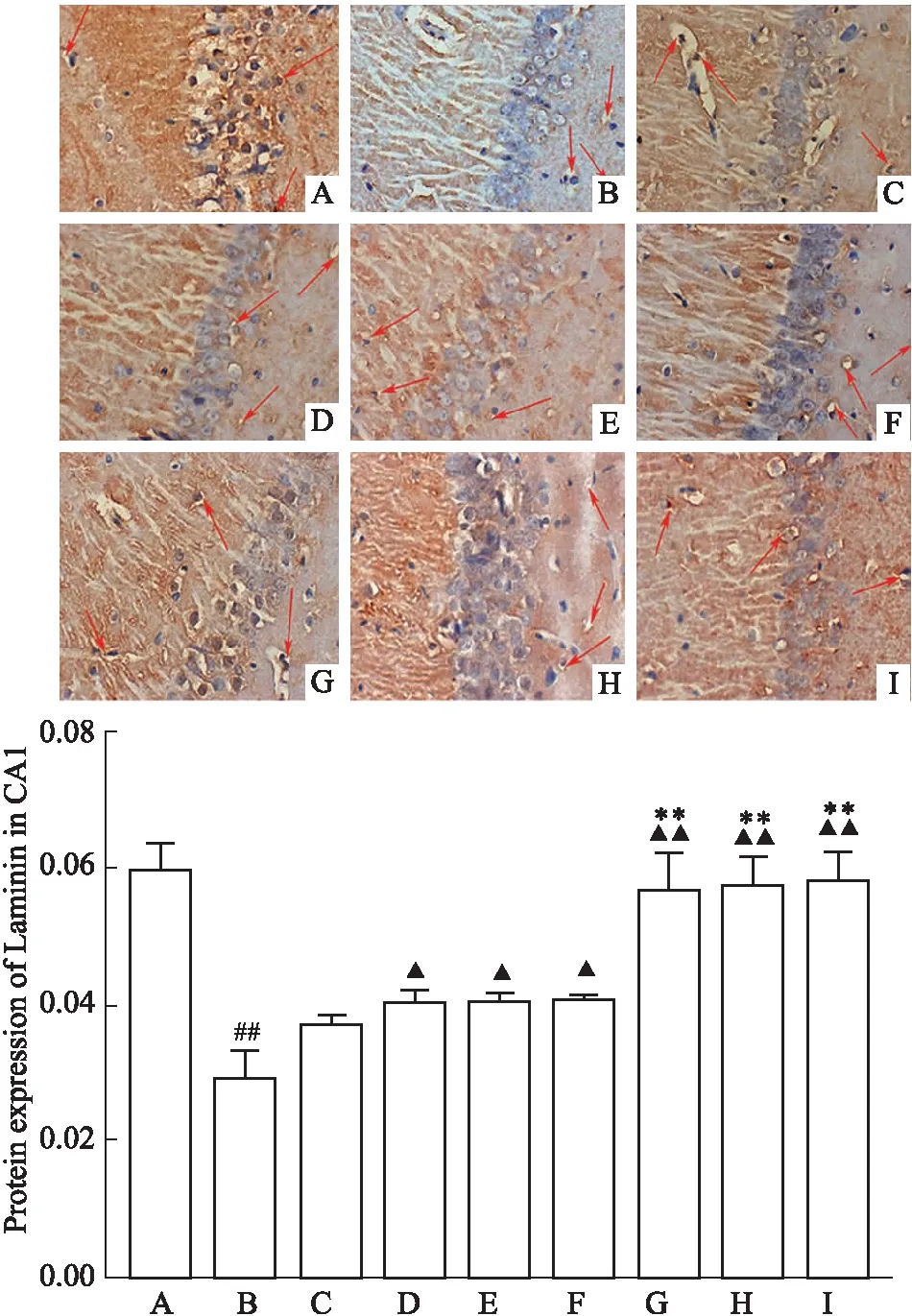
Fig 4 Expression of Laminin in each group n=5)(× 400, bar=20μm)
神经元是 NVU 的基本单位和核心成分,NeuN 是成熟神经元细胞核的特异标记物,其表达降低可反映成熟神经元的损伤[1]。星形胶质细胞是中枢神经系统中数量最多的胶质细胞,不仅参与 NVU 的组成,还为神经元提供结构和营养支持。脑缺血时星形胶质细胞激活呈“双刃剑”作用,早期分泌神经营养因子,延迟神经元死亡;晚期释放炎症因子和神经毒性分子,引起神经元继发性损伤[1]。GFAP是星形胶质细胞特异性分子标志,反映星形胶质细胞的活化[12]。微血管内皮细胞是微血管的基本结构,对维持血管壁结构与功能完整性十分重要。脑缺血后,炎症介质可损害脑毛细血管基底膜,破坏血管的完整性,引起BBB通透性增加,导致脑水肿。LN主要存在于微血管基底膜中,检测LN可反映微血管结构完整性[1]。因此,NeuN、GFAP及LN能够较好地反映NVU的主要成分(神经元、星形胶质细胞和微血管)在CIRⅠ后的病理损伤。本研究表明,AST Ⅳ和PNS配伍可改善脑缺血/再灌注后神经功能障碍,缩小脑梗死体积,减轻脑水肿,具有抗缺血性脑损伤的作用。冰片配伍AST Ⅳ和PNS后其作用增强,呈现增效作用。对NVU主要成分的分析表明,AST Ⅳ和PNS配伍可抑制脑缺血/再灌注后GFAP表达,促进NeuN和LN表达,冰片配伍AST Ⅳ和PNS后作用增强。提示AST Ⅳ和PNS可抑制脑缺血/再灌注后脑组织星形胶质细胞过度活化,抑制缺血导致的神经元和血管内皮细胞损伤,对脑缺血后NVU具有保护作用。
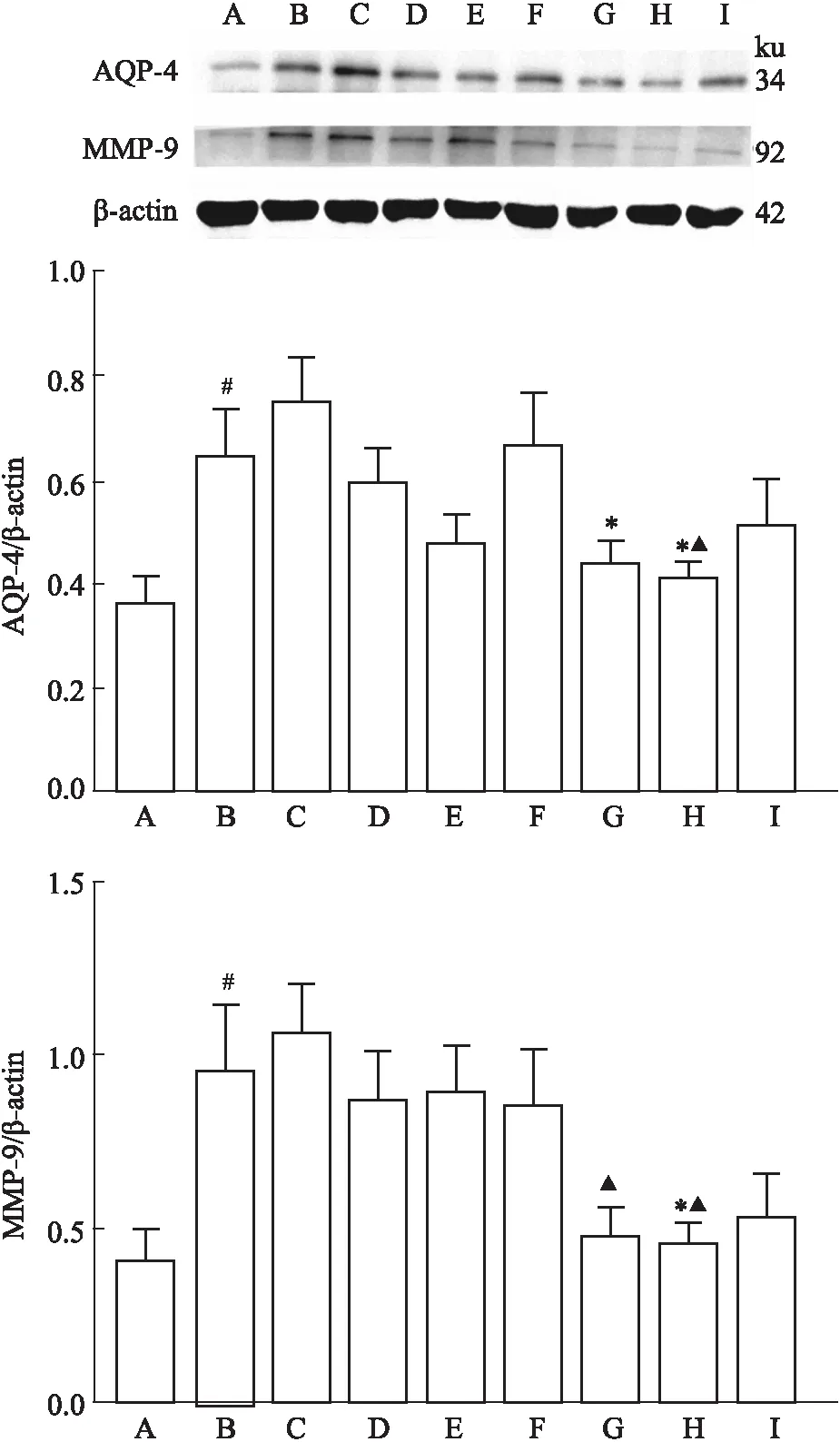
Fig 5 Expression of AQP-4 and MMP-9 protein in brain tissues of each group n=5)
CIRI后缺血缺氧可以引起脑组织水肿。脑水肿可分为细胞源性脑水肿和血管源性脑水肿,前者是星形胶质细胞水肿引起的,后者是BBB功能障碍导致的。AQP-4主要表达在星形胶质细胞,其表达增加可介导水分子进入星形胶质细胞,引起胶质细胞水肿[14],AQP-4表达增加可以反映星形胶质细胞的活化。MMP-9是基质金属蛋白酶家族的主要成员之一,其在脑血管基底膜的降解中起重要作用。在正常脑组织内,MMP-9只有低水平的表达;CIRI后,在缺氧、炎性反应等因素的促发下,MMP-9激活,降解脑血管基底膜的LN、纤维联接蛋白、Ⅳ型胶质蛋白等成分,改变BBB通透性,从而引起血管源性脑水肿[15]。因此,MMP-9的水平可以反映微血管的损伤情况。本研究表明,冰片配伍AST Ⅳ和PNS后可抑制AQP-4和MMP-9表达。表明冰片配伍AST Ⅳ和PNS在保护NVU的同时,可能通过下调AQP-4的表达,抑制水分子流入星形胶质细胞,减轻细胞源性脑水肿的形成。并且冰片配伍AST Ⅳ和PNS可抑制MMP-9表达,可能减轻脑微血管基底膜损伤,保护BBB,抑制血管源性脑水肿的形成。
总之,冰片与AST Ⅳ、PNS配伍后,具有抑制星形胶质细胞过度活化、减轻神经元和微血管基底膜的损伤、减轻脑水肿的作用,具有比AST Ⅳ配伍PNS更好的NVU保护作用。但冰片与AST Ⅳ、PNS配伍保护NVU的具体作用机制有待进一步阐明。