置入式胰肠吻合对减少腹腔镜胰十二指肠切除术后胰瘘发生的临床价值分析:附69例报告
石程剑,朱峰,王敏,田锐,张航,秦仁义
(华中科技大学同济医学院附属同济医院 胆胰外科,湖北 武汉 430030)
胰十二指肠切除术(pancreaticoduodenectomy,PD)是治疗胰头颈部肿瘤和壶腹周围癌的主要手术方式,也是最有挑战性的腹部外科手术[1-2]。近来随着手术技术和术后管理经验的提升,PD术后并发症发生率和病死率都得到明显改善,但术后并发症发生率仍然在32%至52%之间,其中胰瘘是一种严重的并发症[3-5]。胰瘘可导致大多数并发症,包括腹腔积液、腹腔脓肿、出血,也是导致死亡的主要原因[6-8]。消化道重建中的胰肠吻合与术后出血、胰瘘等严重并发症密切相关,也是目前被重点关注和不断改进的节点[9]。腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)于1994年首次被报道[10],许多研究[11-15]表明,与开放性PD相比,LPD可能具有较短的住院时间、较低的估计失血量和较高的长期总体生存率。与开腹PD手术相似,LPD术中胰肠吻合术是3种肠吻合术中最具挑战性的一种。目前众多的胰肠吻合方式中,胰腺导管对空肠黏膜吻合是国际上广泛认可的胰腺吻合方式[16],然而LPD下行胰腺导管对空肠黏膜吻合技术难度大,尤其是直径小于3mm的细小胰管,术后胰瘘风险仍然高。作者团队经过多年的探索,建立了一种更为符合腹腔镜下操作的胰肠吻合方式—置入式胰肠吻合法(imbedding pancreaticojejunostomy)。本文通过回顾性分析2018年在本中心完成的69例置入式胰肠吻合的LPD临床资料,探讨这种吻合方式对减少LPD术后胰瘘发生的价值。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2018年12月在我院胆胰外科中心行LPD手术治疗的69例患者的临床资料,其中男45例,女24例;年龄从35~73岁,平均年龄为64岁;25例行经皮肝穿刺胆道引流术(PTCD)减黄后手术。
1.2 手术方式
LPD 手术过程:患者取仰卧位,采用静脉和吸入复合麻醉;采用5 孔法置入Trocar,建立人工气腹,气腹压维持11~13 mmHg(1 mmHg= 0.133 kPa);探查腹腔及盆腔明确无远处转移,超声刀打开胃结肠韧带探查肿瘤可切除后,遂行全腹腔镜下根治性PD术,消化道重建顺序均采用Child法,胰肠吻合采用置入式胰肠吻合;最后分别于胰肠吻合口旁和胆肠吻合口后方留置引流管各1根。
置入式胰肠吻合具体步骤:适当游离胰腺残端3~5 mm,胰腺断面充分止血,然后于胰管内置入带有侧孔的硅胶导管作为胰管支撑。胰肠吻合口从后往前缝合4层,其中后壁和前壁各两层。先缝合后壁:先于胰腺上缘距离胰腺残端0.5~1.0 cm处用4-0 Prolene线将胰腺全层与空肠浆肌层行水平褥式缝合(图1A),暂不打结;同法行胰腺中部和下缘褥式缝合,缝合针数由胰腺断端直径大小决定,一般为2~4针,即可完成后壁第1层的缝合;接着用电凝钩于胰管对应的空肠壁处全层切开空肠,切口与胰管直径相当,然后4-0 Prolene线从胰腺前方贯穿胰腺至后壁,接着贯穿缝空肠后壁全层,再从胰腺后壁贯穿胰腺至前壁,一般缝合2~4针,完成后壁第2层缝合(图1B)。缝合前壁:缝合胰腺残端前壁及空肠切口前壁全层,方法同后壁第2层,但缝线于胰腺残端仅穿前半层,完成吻合口前壁的第一层缝合(图1C);然后缝合胰腺残端前壁及空肠前浆肌层(图1D),完成整个吻合口的缝合。如吻合口上下缘存在缝隙,可将空肠前壁浆膜层与胰腺前壁被膜加缝线间断缝合强化吻合口前壁。
1.3 术后观察指标和主要并发症的诊断标准
术后观察指标包括胰瘘、胆汁漏、出血、腹腔感染、手术时间和平均住院时间;并发症的诊断标准:(1) 胰瘘:采用国际胰腺外科研究小组(ISGPS)2016年的标准[17],胰瘘为手术后3 d,引流液淀粉酶含量大于血清淀粉酶正常值上限的 3倍,且于临床治疗预后相关,分为3级(生化瘘、B级和C级瘘)。生化漏不再作为胰瘘的分级的一级,而被认为是一个胰瘘前状态,因此仅对B、C级进行评估。B级诊断标准为:持续引流3周以上;出现临床相关胰瘘治疗措施改变;使用经皮或内镜穿刺引流;采取针对出血的血管造影介入治疗;发生除器官衰竭外的感染征象。一旦由于胰瘘感染等原因而发生单个或者多个器官功能障碍,胰瘘分级调整为C级。(2) 胆汁漏标准:腹腔引流管术后连续3 d有胆汁引流出或者单次引流胆汁量≥100 mL/d;未置腹腔引流者,术后出现腹膜刺激征,腹穿抽出胆汁或者再次手术发现腹腔内有胆汁聚积。(3) 出血:腹腔引流管引流出鲜红色血性液体或者呕血及血便,血红蛋白浓度持续下降并低于80 g/L或者24 h内降低超过20 g/L,需要最少2个单位红细胞补充失血量。(4) 腹腔感染:有感染的临床症状且腹腔引流管引流出有脓性引流液,或者影响学检查发现有脓肿形成并经腹腔穿刺引流出脓性液体者。
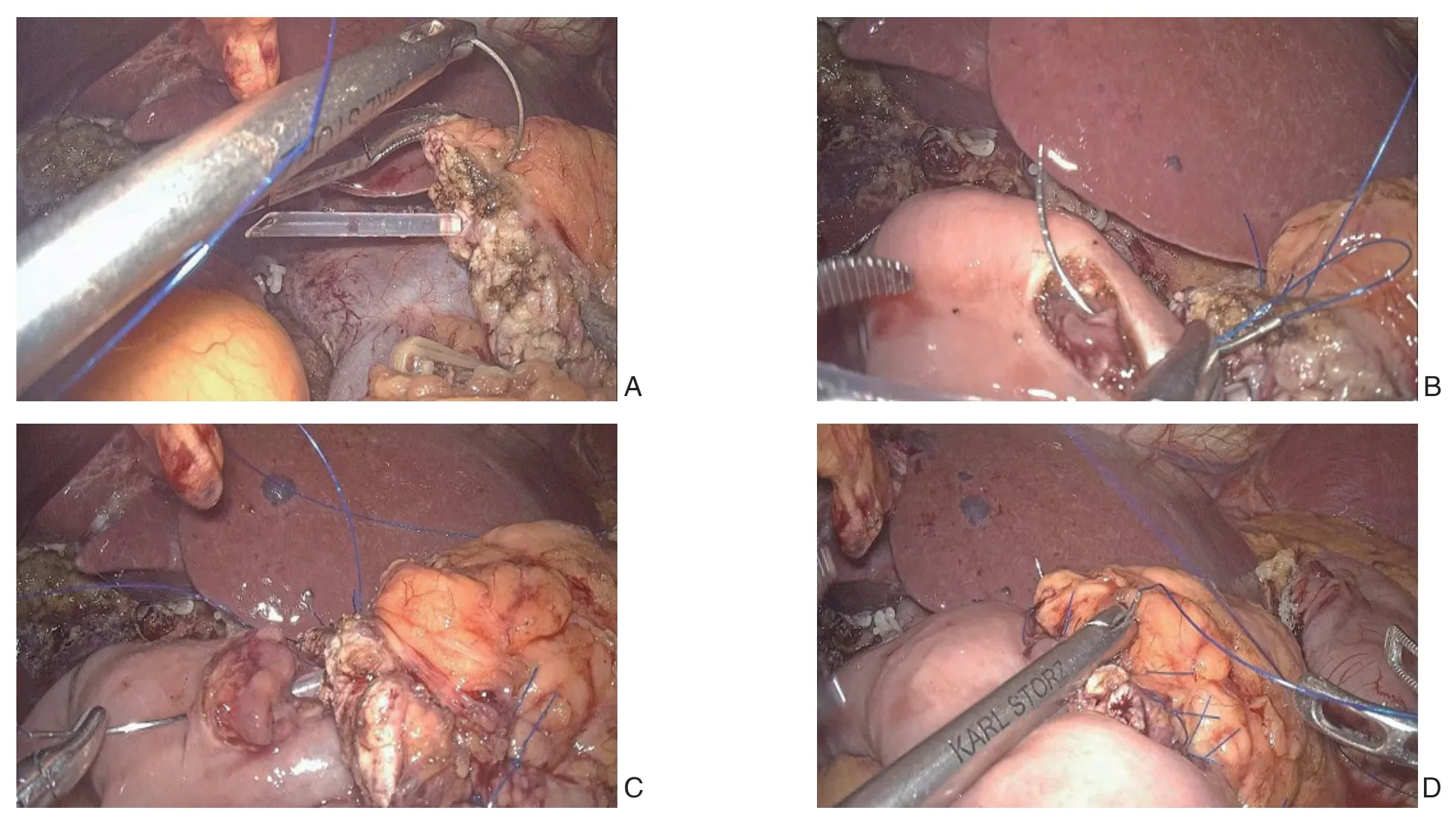
图1 置入式胰肠吻合法 A:Prolene 线于胰腺上缘贯穿缝合;B:缝线贯穿空肠后壁全层;C:缝合胰腺残端前壁及空肠切口前壁;D:缝合胰腺残端前壁及空肠前浆肌层Figure1 Imbedding pancreaticojejunostomy A: Prolene suture running through the upper edge of pancreas; B: Suture running through the whole layer of posterior wall of the jejunum; C: Suturing the anterior wall of the pancreatic stump and the incision of the jejunum; D: Suturing the anterior wall of the pancreatic stump and the anterior seromuscular layer of the jejunum
1.4 数据处理
计量资料用均数±标准差(x±s)表示,计数资料用例数或百分比表示。
2 结 果
2.1 患者手术相关指标
69例患者均顺利施行了L PD 术,4例联合门静脉/肠系膜上静脉切除和(或)修补;手术时间为(264.5±27.2)min,其中胰肠吻合时间为(25.7±7.2)min;术中出血(85.5±19.5)mL。
2.2 患者术后情况
术后发生胰瘘2例(2.9%),其中B 级瘘 1例,C级瘘1例。术后胆汁漏1例(1.5%),经加强营养及抑制消化液分泌等非手术治疗后愈合;术后腹腔出血2例,发生率为2.9%(2/69), 1例经过静脉输入止血药、输血治疗后获得止血效果,1例经过静脉输入止血药、输血及介入治疗后获得止血效果。1例出现腹腔感染,发生率为 1.4%(1/69),为腹腔形成脓肿,和胰瘘相关,通过调整腹腔引流管和腹腔穿刺置管引流后痊愈。术后平均住院时间为(15.7±1.3)d。
2.3 患者术后病理结果
最终病理诊断胰腺癌23例,胰腺浆液性囊腺瘤6例,胰腺实性假乳头状瘤3例,胰腺导管内乳头状黏液肿瘤1例,十二指肠乳头癌21例,壶腹癌7例,胆总管末端癌8例。
3 讨 论
胰腺由于特殊的解剖位置和复杂的解剖结构,使胰腺手术成为腹部外科中最难的手术之一,包括手术操作的难度和术后并发症的发生率[18-19]。近年来,随着微创技术的发展,胰腺的微创治疗突飞猛进[20-22]。然而,无论是传统的开腹手术还是腹腔镜微创手术,术后胰瘘仍然是胰腺手术最严重的并发症之一[23-24],而胰瘘可继发腹腔感染和腹腔大血管腐蚀大出血,成为胰腺术后患者死亡的重要原因之一[25-26]。胰腺残端的吻合被认为是手术中最困难的阶段,对术后愈合至关重要[27-28]。此步骤中的技术失败会导致术后胰瘘,在最严重的C级瘘病例中病死率可达近26%[25],因此改进手术技巧和改良胰腺吻合方式是降低术后胰瘘发生率的重要途径之一。
近年来,国内外胰腺外科医生在胰腺吻合方式和技术上进行多种改进。Kusnierz等[29]提出将肠壁3 cm套入管腔,使肠壁形成双层袖带,然后使用两个U形缝合线(从肠外部开始)将胰残端拉入套囊,形成胰腺空肠的端端吻合,2~3 cm的肠浆膜与胰腺被膜形成粘连后可预防胰瘘,术后B~C级瘘降至3.8%;Cai等[30]报道的Bing式吻合法,特点是完成第二层缝合之后再拧紧第一层的缝合线,这种方法均匀地收紧了胰残端和空肠壁,没有留下死腔,术后B~C级瘘降至3.8%。笔者基于本中心长期的经验积累,探索并建立了一种新的胰肠吻合方式—置入式胰肠吻合法。此方法中,胰腺断面被包埋于浆肌层,避免了胰腺断端暴露在小肠液中,有效阻止了消化液对脆弱残端的消化破坏,减少出血的机会。此外,近断面的胰腺被充分贯穿缝扎,有效封闭了胰腺断面的胰液渗漏,减少胰液在胰腺和空肠浆肌层接触面的聚集,避免对吻合口的腐蚀。本研究结果显示,本组中B~C级瘘为3%。从前期结果来看,此术式耗时短、步骤简单,非常适合在微创操作下完成,对降低术后胰瘘的效果不亚于其他的吻合方式,是安全、有效的胰肠吻合方法。
置入式胰肠吻合简单易行,术中需注意以下关键技术:(1) 确保胰液通过引流管进入空肠;胰液引流管需与胰管大小匹配,使其紧贴胰管内壁,引流管塞入胰管后,即可见胰液通过引流管侧孔进入引流管而流出;(2) 确保缝合胰腺组织时避开胰液引流管;(3) 胰管与空肠的靠拢主要依赖胰腺断端与空肠浆肌层的连续或间断缝合,避免缝合时胰腺组织切割,应用4-0 Prolene线尽可能多缝胰腺组织。
本研究初步结果显示,置入式胰肠吻合法术对预防术后胰瘘效果不亚于其他的吻合方式,具有良好的安全性与有效性,且操作简单、易行,适合在LPD中推广应用。本研究纳入样本相对较小,在后续的研究中,将继续积累扩大样本量,进一步探讨这种吻合方法对预防胰腺术后胰瘘发生的价值。

