自体骨髓移植治疗失代偿期肝硬化的临床观察
刘保池,郎林,李垒,司炎辉,李爱军,徐庆,夏磊,张辉
(1.上海市公共卫生临床中心 普外科,上海 201508;2.上海新虹桥国际医学中心 和诺医疗外科,上海200240;3.海军军医大学附属东方肝胆外科医院 特需科,上海 200433;4.上海交通大学附属仁济医院普外科,上海 200120;5.同济大学附属东方医院 普外科,上海 200120)
对失代偿期肝硬化常规药物治疗没有明显疗效,肝移植是治疗失代偿期肝硬化的有效方法。由于肝源紧张和费用昂贵,以及需要终生服用免疫抑制药物,仅有少数患者选用肝移植。自体骨髓干细胞有分化为多种细胞的潜能,可以转化成肝细胞或者是分泌某些细胞因子促进损伤肝细胞的修复而改善肝功能。我们对失代偿期肝硬化患者采用经网膜右静脉插管埋置输液港建立通道,经输液港输注自体骨髓通过网膜右静脉进入肝脏门静脉,可以明显改善肝硬化,并且比较了埋置输液港时做脾切除和不做脾切除的临床效果,现报道如下。
1 资料和方法
1.1 一般资料
2016年1月到2019年12月在复旦大学附属上海市公共卫生临床中心、同济大学附属上海东方医院、海军军医大学附属上海东方肝胆外科医院、上海交通大学附属仁济医院、上海新虹桥国际医学中心开展多中心研究,纳入标准为:临床诊断失代偿期肝硬化,18~75岁,男女不限。排除肝硬化合并肝癌,糖尿病,肝肾综合症等合并症。符合入组条件的患者137例,其中男84例,女53例,年龄26~74岁。CT检查均提示肝脏明显缩小,肝硬化,形态不规则,脾脏肿大。B超检查有少量到大量腹腔积液;凝血酶原时间均超过正常值3 s以上。
1.2 病例分组及治疗方法
根据治疗方法不同分为3组,30例采用常规治疗,包括抗病毒治疗和保肝利尿等治疗,52例采用常规治疗+门静脉自体骨髓输注治疗,55例采用常规治疗+脾切除+门静脉自体骨髓输注治疗。各组患者治疗前的肝功能和血常规等各项指标没有统计学差异(P>0.05),有可比性。各组患者都签署知情同意。该研究通过医院伦理委员会批准。
常规手术准备之外,手术前后继续应用抗病毒药物,根据患者情况补充白蛋白、凝血酶原复合物及保肝利尿等治疗。
55例脾切除患者在全麻下手术,探查见肝脏明显结节性肝硬化,脾肿大。腹水500~7500 mL。脾切除后,将输液港导管经网膜右静脉插入,输液港穿刺窗埋置在上腹部皮下。术中从髂前上脊穿刺抽取骨髓40 mL,然后经皮穿刺埋置在上腹部皮下的输液港穿刺窗,将自体骨髓缓慢推注进入门静脉,最后用肝素盐水5 mL注入输液港防止凝血。
52例在全麻或者局部麻醉下手术,上腹部小切口长约4 cm,找到胃网膜右静脉插管埋置输液港,术中经输液港输注自体骨髓40 mL。术后1个月和3个月分别再次经输液港输注自体骨髓40 mL,以后根据肝功能改善情况再次输注,方法同前。
1.3 统计学分析
采用SPSS 20.0统计学软件进行分析。计数资料用率表示,组间比较采用χ2检验,计量资料采用(±s)表示,组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
30例进行常规治疗,治疗后2例死于消化道出血。
52例常规治疗+门静脉自体骨髓输注,手术后2例消化道出血,7 d内死于肝衰竭;其余50例肝功能多项指标逐渐好转。
55例常规治疗+脾切除+门静脉自体骨髓输注,手术后3例脾切除创面渗血,术后3 d内死于肝衰竭;其余52例肝功能多项指标逐渐好转。
常规治疗、常规治疗+门静脉自体骨髓输注、常规治疗+脾切除+门静脉自体骨髓输注三组在3个月内的病死率分别为6.6%、3.8%、5.4%,无统计学差异(χ2=0.355,P=0.845)。
各组治疗前后有关肝功能和血常规的变化结果见表1至7。
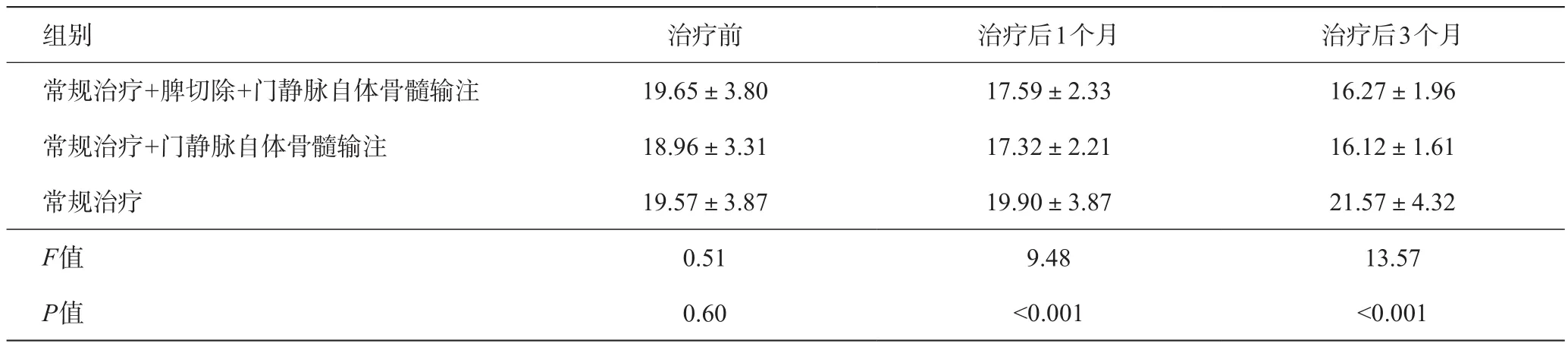
表1 各组治疗前后凝血酶原时间变化(s)
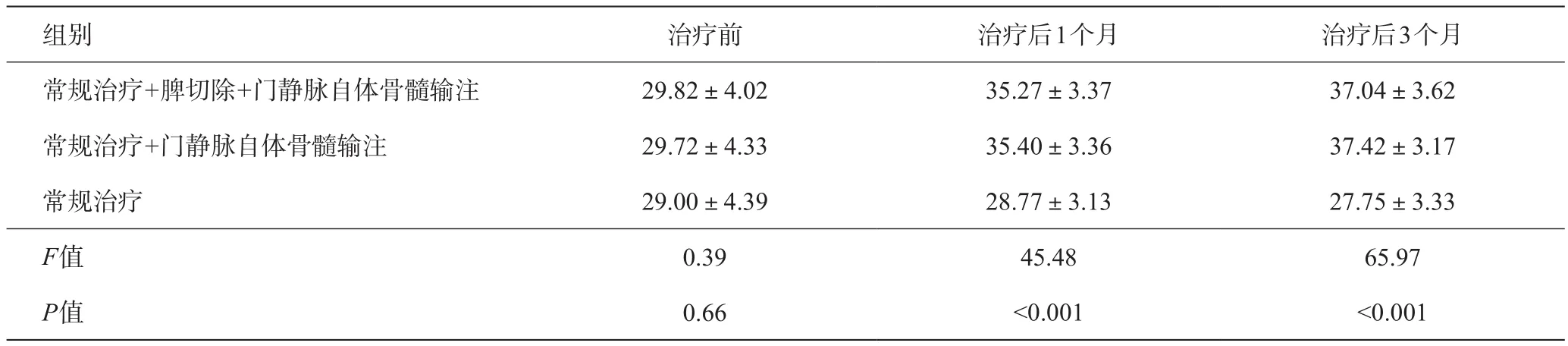
表2 各组治疗前后白蛋白变化(g/L)
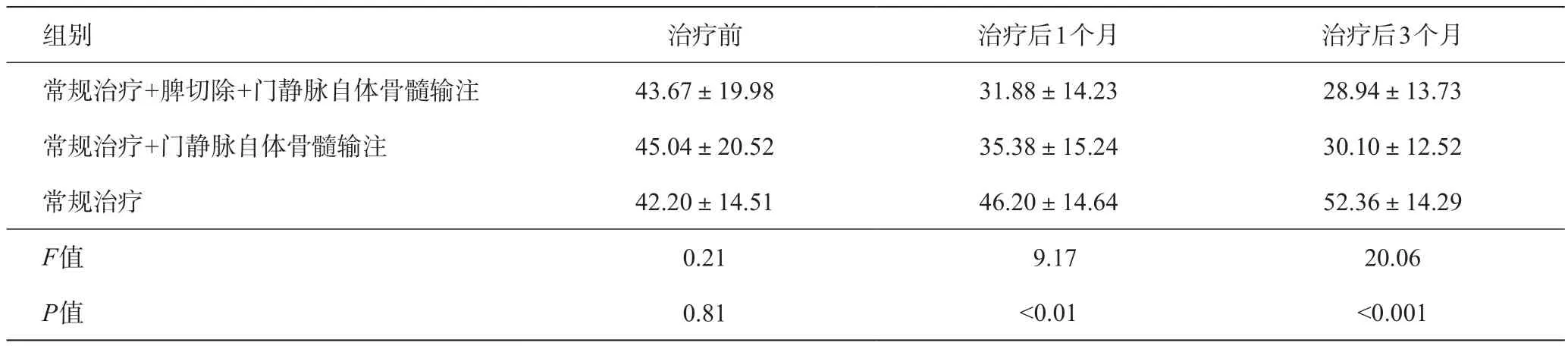
表3 各组治疗前后总胆红素变化(μmol/L)
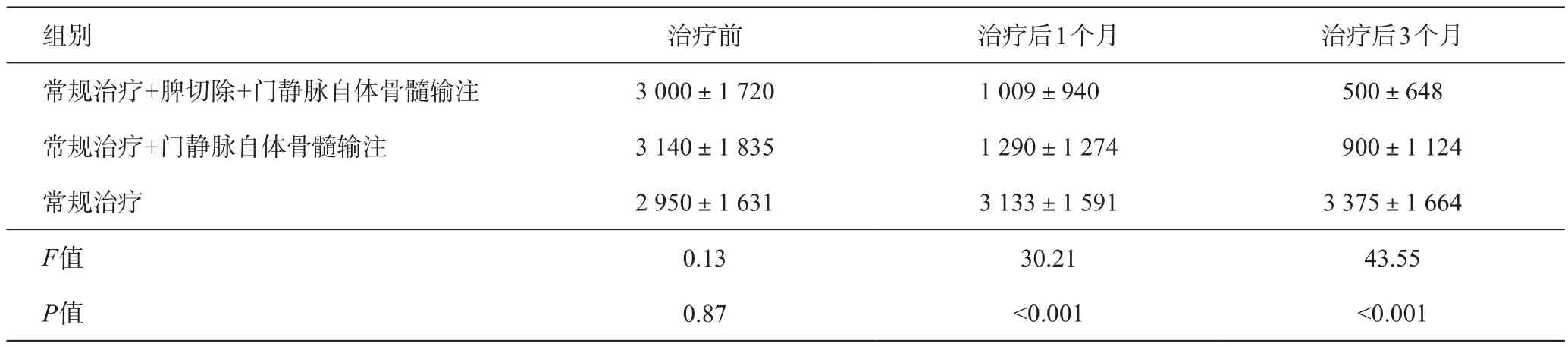
表4 各组治疗前后腹水变化(mL)
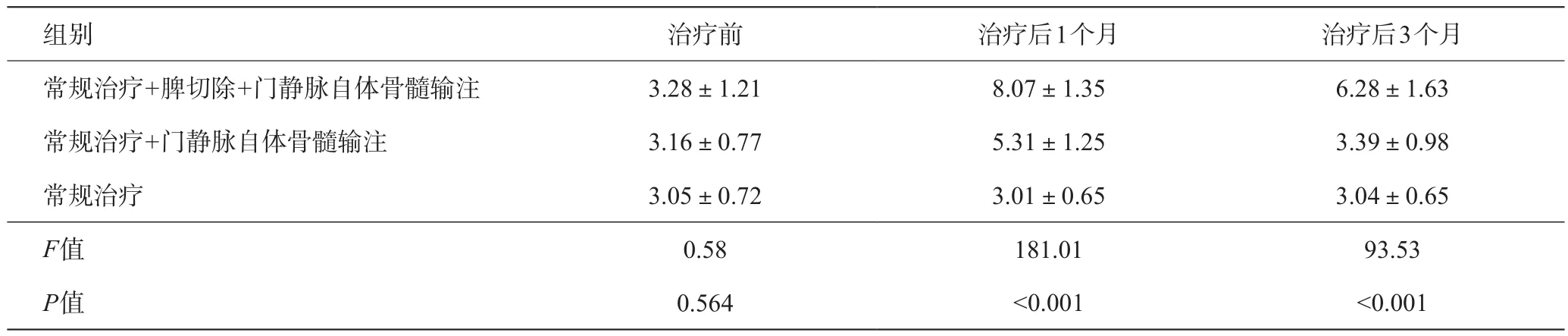
表5 各组治疗前后白细胞变化(×109/L)
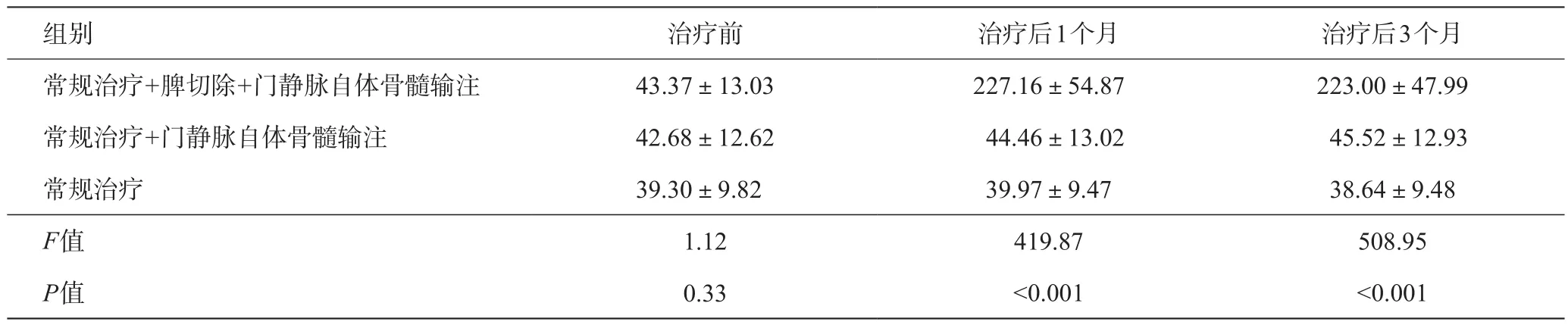
表6 各组治疗前后血小板变化(×109/L)
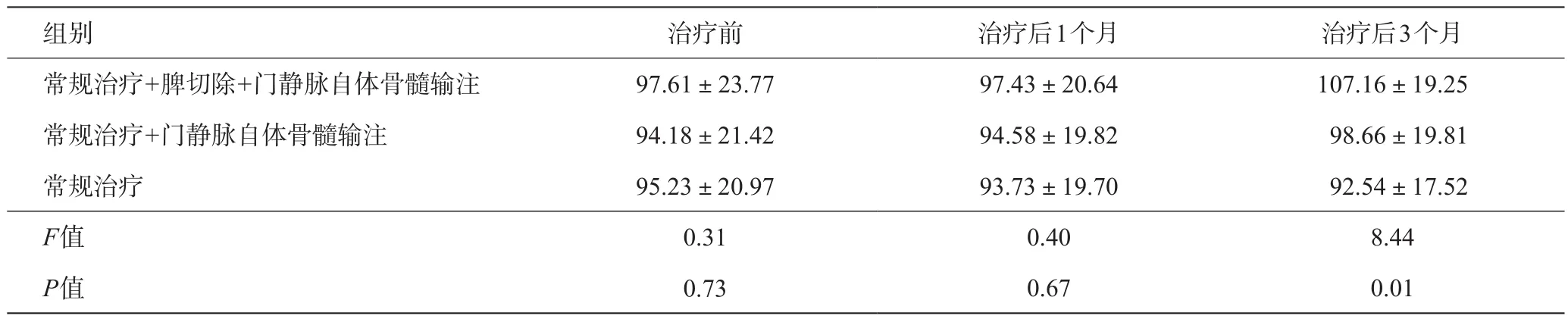
表7 各组治疗前后血红蛋白变化(g/L)
3 讨论
对失代偿期肝硬化目前没有特别有效的药物治疗方法。阻断对肝细胞进一步损坏是对病毒性肝炎肝硬化的基本治疗。用核苷类药物如恩替卡韦、替诺福韦等抗乙肝病毒药物治疗可以控制乙型肝炎病毒的大量复制,但是不能清除乙肝病毒,需要长期抗病毒治疗[1]。丙肝肝硬化用抗病毒药物6个月基本可以清除丙肝病毒。保护肝细胞的常用药物有谷胱甘肽、肝宁、益肝灵(水飞蓟素片)、肌苷等。补充维生素C、E及B族维生素等可改善肝细胞代谢,防止脂肪性变和保护肝细胞,针对低蛋白血症和腹水一般是输注白蛋白和利尿等治疗,或者做TIPSS降低门静脉高压[2-3]。但是这些治疗不能解决肝硬化的根本问题,患者会逐渐发展为肝衰竭。
肝移植是治疗失代偿期肝硬化的有效方法。但是由于肝源紧张、费用昂贵和需要终生应用免疫抑制药物带来的副作用。很多患者不能或者不愿意做肝移植。骨髓干细胞作为一种具有横向分化能力的多能干细胞,近年来大量研究表明在合适的培养条件下其在体内外均可以向肝细胞分化。2000年,日本学者使用大鼠骨髓干细胞,加入不同浓度的HGF(肝细胞生长因子)进行体外诱导培养之后,发现了骨髓干细胞可以分化为肝样细胞[4]。骨髓干细胞移植成为治疗肝硬化的一种有效方法。
肝硬化一般都伴有脾功能亢进,脾切除可以解除脾功能亢进,但是不能改善肝硬化。笔者2009年在上海市公共卫生临床中心进行脾脏切除手术加自体骨髓经门静脉输注治疗艾滋病合并失代偿期肝硬化患者取得良好疗效[5-7]。本研究将这种方法应用到没有艾滋病病毒感染的乙肝失代偿期肝硬化患者,将患者分为常规治疗、常规治疗+门静脉自体骨髓输注、常规治疗+脾切除+门静脉自体骨髓输注三组,目的是比较自体骨髓门静脉输注与常规治疗是否有明显差异,也比较脾切除与不做脾切除对治疗的影响。
常规治疗组经过3个月治疗肝功能没有明显改善。但常规治疗+门静脉自体骨髓输注、常规治疗+脾切除+门静脉自体骨髓输注这两组治疗之后,血清白蛋白、凝血酶原时间、血清总胆红素、腹水这些指标明显好转,与有关报道相同,提示自体骨髓门静脉输注可以明显改善肝功能[8-12]。
对于肝功能Child C级的肝硬化患者,做脾切除有很高的风险。围手术期输注白蛋白、血小板、凝血酶原复合物、利尿等治疗。手术时先分离出脾动脉结扎可以减少脾切除时出血,关键是经网膜右静脉插管输注自体骨髓后可以逐渐改善肝硬化才能降低手术风险。常规治疗+门静脉自体骨髓输注、常规治疗+脾切除+门静脉自体骨髓输注这两组治疗后肝功能都有明显改善,但不做脾切除组的脾功能亢进没有明显变化,脾切除组的周围血白细胞、血红蛋白、血小板都有明显增多。
常规治疗+脾切除+门静脉自体骨髓输注1周内3例因创面渗血肝衰竭死亡,常规治疗+门静脉自体骨髓输注1个月内2例因消化道出血引起肝衰竭死亡,常规治疗组2例因消化道出血死于肝衰竭。三组在3个月内的病死率没有统计学差异,但是自体骨髓经门静脉输注后肝功能逐渐好转,有可能长期存活。常规治疗组治疗前后肝功能没有明显变化,但一般生存期1~3年可能发展成肝衰竭。
综上所述,自体骨髓经门静脉输注可以明显促进失代偿期肝硬化的肝功能重建,脾切除加自体骨髓经门静脉输注可以解除脾功能亢进又促进失代偿期肝硬化的肝功能重建。但是脾切除术后创面渗血容易诱发肝衰竭,有较高手术风险。所以对肝功能Child C级的失代偿期肝硬化可以先作上腹部小切口经网膜右静脉插管输注自体骨髓,待肝功能好转后,如果仍然有明显脾功能亢进,再做脾切除可能降低手术风险。

