特发性门静脉高压症13例临床诊治分析
(解放军总医院第五医学中心 肝胆外科一中心,北京 100039)
特发性门静脉高压症(idiopathic portal hypertension,IPH)是一种发病原因未知,以脾脏肿大、门静脉高压、上消化道出血、贫血等为主要临床症状且无肝硬化、肝静脉阻塞及先天性肝纤维化的门静脉高压症[1-3]。IPH在日本及印度多发,在我国发病率虽然不高,但因其发病隐匿,且无直接诊断方法,容易造成误诊和漏诊[4-5]。如果及时得以诊断和治疗可以有效降低其给患者带来的伤害。目前针对IPH的治疗手段主要为脾切除加断流术,且安全有效[6]。我们近期对13例IPH患者的临床诊治资料进行回顾性分析,以提高对该病在诊断和治疗上的认识。
1 资料和方法
1.1 一般资料
自2010年1月至2019年12月,在解放军总医院第五医学中心肝胆外科治疗的IPH患者13例,其中女8例,男5例;年龄为21~63岁,平均41.3岁。临床表现为:呕血、黑便7例,脾肿大4例,上腹胀2例。查体均有中重度脾肿大,7例患者有不同程度贫血,所有患者均无黄疸、肝掌、蜘蛛痣、下肢浮肿等体征。询问病史,所有患者均否认病毒性肝炎、长期大量饮酒、血液系统疾病、血吸虫等病史。
1.2 实验室检查
术前血常规检查所有患者均有白细胞、血小板计数减少,8例血红蛋白低于正常。3例肝功能轻度异常,凝血酶原时间、活动度基本正常,肝功评级Child-Pugh均为A级。乙肝表面抗原、丙肝抗体、自身免疫抗体检测均阴性。
1.3 影像学检查及诊断
本组中有12例患者行彩色多普勒超声检查,显示肝脏弥漫性损害、脾肿大、门静脉内径增宽、流速减低,附脐静脉开放,其中4例发现有门静脉海绵样变,1例门静脉有附壁血栓,3例有少量腹水(见图1),有5例超声考虑IPH。13例行上腹部增强CT或MRI检查提示门静脉高压、脾肿大,有9例提示有肝硬化,1例门静脉有血栓,4例有门静脉海绵样变(见图2)。所有患者行胃镜检查发现不同程度的食管胃底静脉曲张,其中10例静脉呈重度曲张,3例呈中度曲张,红色征均阳性(见图3)。术前均诊断为门静脉高压症伴食管胃底静脉曲张、脾肿大、脾功能亢进,有9例误诊为肝硬化。
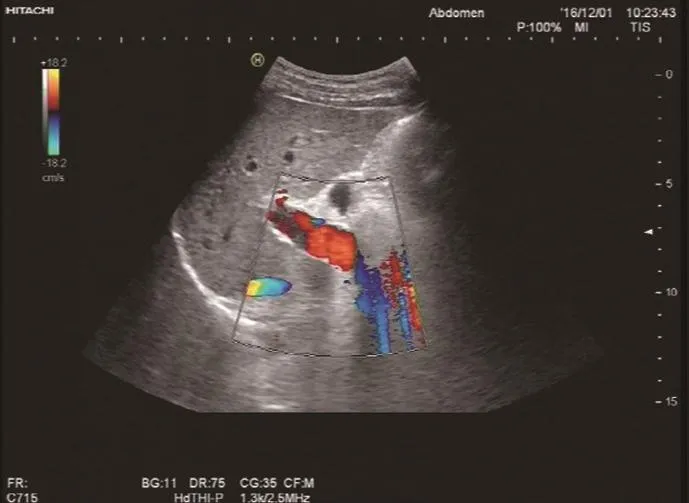
图1 多普勒超声示:门静脉扩张,门静脉高压伴侧支循环。
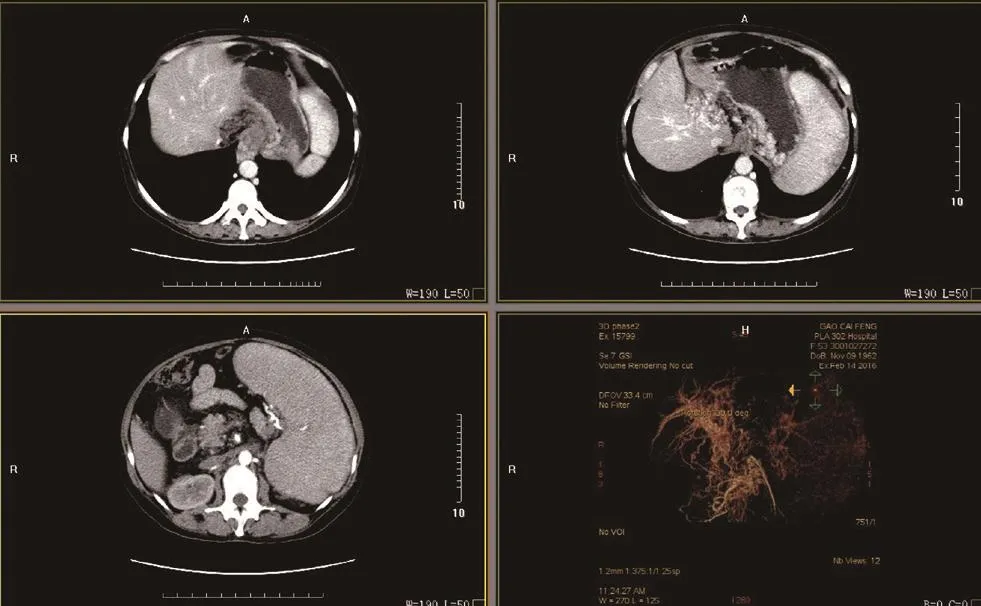
图2 CT:肝硬化,食管及胃底静脉曲张,门静脉海绵样变,巨脾。
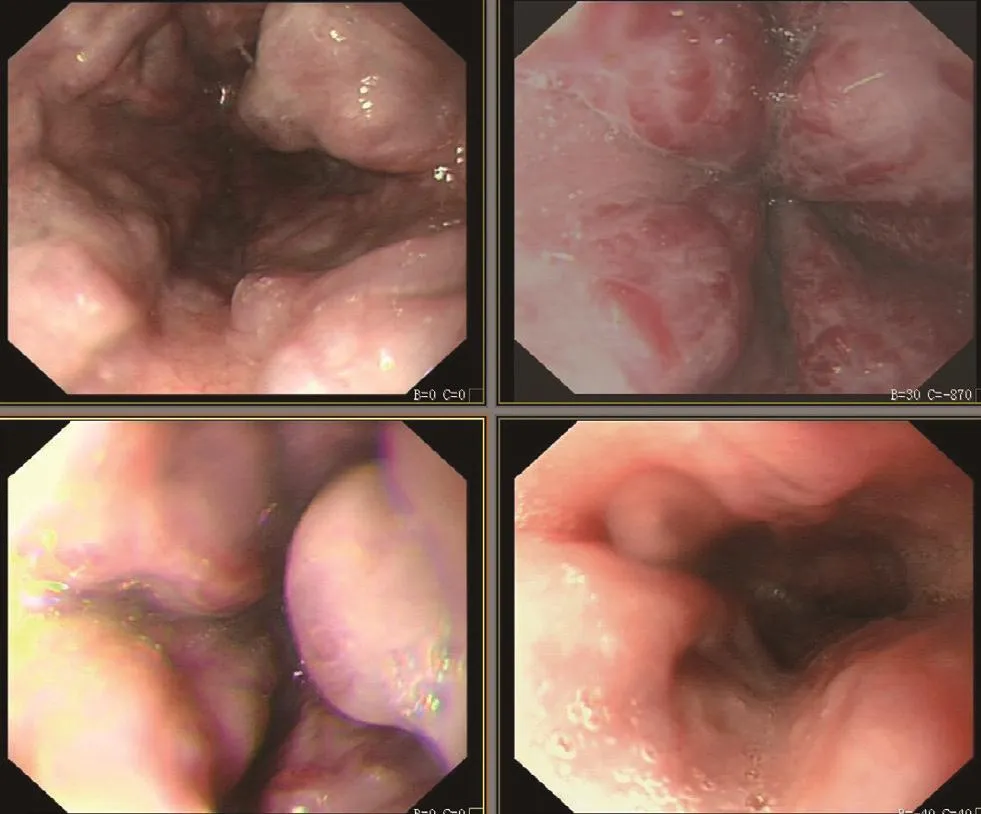
图3 胃镜:食管静脉重度曲张伴胃静脉曲张,红色征(+++)。
2 治疗及结果
2.1 治疗方法及术中所见
13例患者均行脾切除+断流术+肝组织活检术,其中5例行开腹脾切除术+贲门周围血管断离术,2例行腹腔镜下脾切除术+贲门周围血管断离术,4例行开腹脾切除术+贲门周围血管断离术+食管下段横断再吻合术(改良Sugiura手术),2例行手助腹腔镜改良Sugiura手术。术中测量自由门静脉压力,脾切断流前压力为37~43 cmH2O,术后降至23~27 cmH2O。术中13例患者均见肝脏质地柔软,表面光滑或轻度萎缩,均无肝硬化征象,门静脉明显增宽,4例可见门静脉结构紊乱伴有侧支循环,13例脾脏肿大明显,少部分患者伴有脾周粘连,脾静脉、胃短静脉、胃网膜静脉及肠系膜上静脉明显迂曲、扩张。
2.2 肝组织活检病理
13例患者均行肝组织活检病理检查排除其他类型门静脉高压症,结合其他鉴别诊断可提示特发性门静脉高压症IPH(图4),病理示无假小叶形成,肝小叶结构存在,肝索排列尚完整,伴有肝细胞变性水肿,部分肝窦扩张淤血,部分狭小;患者存在不同程度汇管区扩张,并伴有纤维组织增生,中央静脉及汇管区管腔内存在淤血,门静脉不同程度的扩张。按照Nakanuma提出的IPH分期系统:I期:整个肝脏无萎缩,切面见肝包膜下也无实质萎缩;II期:肝脏无萎缩,肝包膜下实质可见萎缩;III期:肝脏萎缩,肝包膜下实质也可见萎缩;IV期:门静脉内出现阻塞性血栓[7]。本组患者中II期9例,III期3例,IV期1例。脾脏标本病理检查均符合慢性淤血性脾肿大。
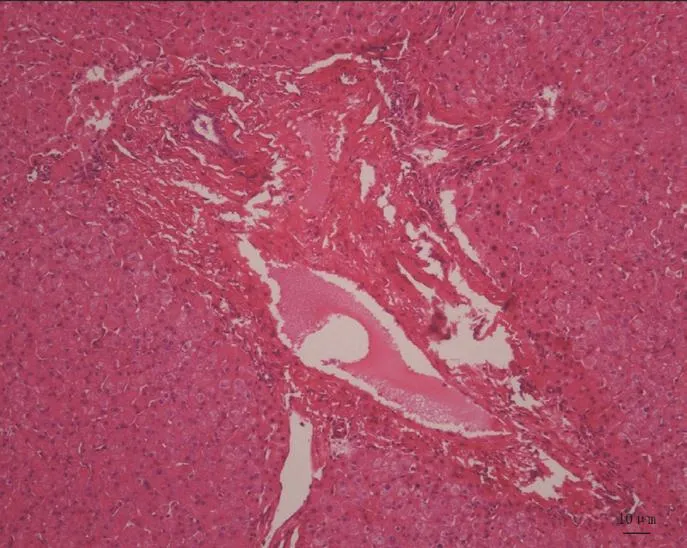
图4 肝组织活检病理:特发性门静脉高压(HE,×100)。
2.3 结果
13例患者均痊愈出院,无腹腔出血、腹腔感染、肝衰竭等并发症发生,无死亡病例,术后平均住院时间为9.8 d。术后对所有患者行每3~6个月一次随访,随访截止时间2020年2月,随访内容包括血常规、肝功能、腹部超声、CT或MRI,部分行胃镜检查。随访发现患者血常规及肝功能指标基本正常,胃镜检查者食管胃底静脉曲张程度较术前明显减轻,生活质量改善。本组1例患者行腹腔镜下脾切断流术后第4年出现黑便,行内镜下硬化剂治疗3次后未再发生上消化道出血。
3 讨论
特发性门静脉高压症(IPH)是一种罕见的疾病,其病因及发病机制目前尚不明确。有研究认为其病因可能与慢性感染,接触药物、毒素、金属中毒,肝循环障碍和静脉血栓形成,免疫性疾病,遗传性疾病等因素相关[1]。感染的病原体包括细菌、原虫、血吸虫、获得性免疫缺陷病毒等[8]。有些IPH发生与药物相关,尤其是与克罗恩病患者应用巯基嘌呤相关[9]。IPH临床特征是无肝硬化,实验室检测示白细胞减少、贫血、血小板减少,脾肿大,肝功能一般正常,最常见的临床表现是食管胃底静脉曲张破裂出血,伴或不伴少量腹水,通常在放射学上被误诊为肝硬化。而多普勒超声检查可提高IPH术前诊断率,蔡敏娴等[10]研究认为,肝内门静脉分支管壁增厚、管腔狭窄甚至闭塞的特征性改变及门静脉海绵样变性可提示IPH。本组患者中有12例行彩色多普勒超声检查,可以清晰地观察到门静脉及侧支循环的血流动力学状况,评估门静脉高压水平,其中有4例发现门静脉海绵样变,5例术前超声提示IPH。但多普勒超声和CT等影像学检查对于IPH的诊断价值尚不能确定,目前IPH的诊断主要依据排除性诊断,根据日本的IPH诊断标准,主要有几点:(1)不明原因的脾肿大、贫血、门静脉高压症,但除外肝硬化、先天性肝纤维化、血液系统疾病、肝胆系统寄生虫病、肝静脉及门静脉阻塞等;(2)一种以上血液成分减少;(3)肝功能正常或接近正常;(4)彩超、CT等检查提示门静脉及脾静脉扩张,血流量增加,脾脏肿大,肝脏表面光滑,质地均匀,未提示有肝硬化;(5)胃镜证实有食管胃底静脉曲张;(6)肝静脉插管检查显示肝静脉开放,静脉楔压正常或轻度升高,门静脉压>20 mmHg;(7)肝活检提示门静脉纤维化,但无肝硬化。总之,IPH诊断要点是门静脉高压并排除肝硬化和其他原因引起的非肝硬化性门静脉高压,而肝组织活检病理是诊断IPH的重要依据,病理改变包括小叶间静脉增厚、狭窄、闭塞、门区纤维化、肝细胞萎缩或凋亡[11-13]。本研究13例IPH患者均有门静脉高压症,均已排除肝硬化和其他原因引起的非肝硬化性门静脉高压,肝组织活检病理证实为特发性门静脉高压。
食管胃底静脉曲张破裂出血会严重威胁IPH患者生命安全,降低门静脉压力、防止上消化道出血是治疗IPH的关键。目前国内针对IPH的外科治疗方式与肝硬化门静脉高压症基本一致,多选择脾切除术+贲门周围血管断离术,疗效确切,该手术不仅降低了门静脉压力,解决脾功能亢进问题,明显减少了近期上消化道再出血风险,有效止血,还在不影响患者肝功能的情况下,延缓肝纤维化[14]。我们选择外科治疗的指征是:IPH患者,经胃镜检查证实中度至重度食管胃底静脉曲张,既往有过静脉曲张破裂出血史,肝功能属于Child A级或B级,无大量腹水、黄疸及肝昏迷者,或经非手术治疗无效且意愿行外科手术者。若患者反复上消化道出血,食管静脉曲张重,且一般营养状况良好,我们采用食管下段横断再吻合的改良Sugiura术,离断食管黏膜、黏膜下及肌层的分流血管,更有效降低出血发生率。而随着外科医师腔镜技术的进步及器械的发展,完全或手助腹腔镜脾切除加断流手术越来越成熟,与开腹相比,患者创伤小,恢复快,是一种安全、有效、微创的手术方式[6,15]。本组中有2例患者行完全腹腔镜下脾切除加断离术,2例行手助腹腔镜改良Sugiura手术,术中二级脾蒂分束结扎,LigaSure离断胃短血管,贲门周围血管离断采用Endo-GIA等器械,均无中转开腹、术中术后腹腔大出血等情况发生,患者术后恢复良好,平均住院时间明显低于开腹手术。而国外医师多采用门体静脉分流手术治疗IPH患者[16]。对于不能耐受外科手术、术后食管胃底静脉曲张再次破裂出血者,可采用内镜下硬化剂或套扎治疗,如果患者反复上消化道出血后期也可选择经颈静脉肝内门腔静脉分流术(TIPS)或肝移植治疗。
从这13例病例中我们发现,IPH多合并巨脾,术前脾功能亢进明显,门静脉压力高,门静脉、脾静脉血管迂曲扩张明显,侧支循环丰富,术中切除脾脏时先结扎脾动脉,再处理胃短血管,最后行原位二级脾蒂结扎离断的脾脏切除术,从而有效防止术中出血及术后腹腔出血。术后血小板往往短时间内明显升高,血液处于高凝状态,防止门静脉系统血栓形成或加重很关键,门静脉系统形成阻塞性血栓加重门静脉高压,影响手术效果。术后短期内再次发生食管静脉曲张破裂出血,我们的经验是若无腹腔出血术后24 h后应用低分子肝素钙抗凝治疗。根据血小板及血栓形成情况出院后继续口服阿司匹林肠溶片抗凝至少半年到1年,严重的门静脉系统血栓可应用华法林治疗,但注意定期监测凝血指标。
根据13例IPH患者随访记录发现,除1例患者术后第4年出现黑便,绝大多数患者均能正常生活且不存在并发症及后遗症问题,预后情况良好。相对于内科药物降低门静脉压力等对症治疗,外科脾切除加断流术能够有效治疗IPH,明显减轻患者上消化道出血风险,降低患者病死率,术后再出血率也低,对于防治IPH并发症具有更好的治疗效果。虽然IPH与肝硬化型门静脉高压症状基本相似,但因患者一般肝功能良好,无肝病基础,故其治疗效果比肝硬化型门静脉高压症更好。
综上所述,IPH的诊断主要为排除性诊断,肝组织活检病理是重要依据,多普勒超声对于IPH具有一定的诊断价值。相对于内科药物治疗,外科脾切除加断流术能够更有效治疗IPH,止血效果确切,而且相对于肝硬化型门静脉高压症,IPH患者的肝功能一般正常,且无肝硬化,治疗效果要好于肝硬化型门静脉高压症。在临床工作中我们要提高对该病诊断以及治疗上的认识水平。

