胎盘间叶发育不良伴足月活胎分娩1例报道
程丹玲,廖桂莲,李娟,刘兰云
(深圳市龙岗区妇幼保健院产科,深圳 518000)
胎盘间叶发育不良(Placental mesenchymal dysplasia,PMD)是一种罕见的胎盘病变,其特征是干绒毛囊性扩张和囊泡形成、胎盘肥大和血管异常等,常伴有胎儿生长发育受限(FGR)、死胎、Beckwith-Wiedemann综合征,以及一些染色体异常等,临床上需要与葡萄胎相鉴别。PMD由Moscoso等[1]于1991年首先发现,其发病率约为0.002%~0.02%[2-3]。本文对我院妇产科1例母胎预后良好的PMD病例进行报道并文献分析如下。
一、病例资料
患者,女,34岁,因“停经39+2周,阴道流水2 h余”于2020年2月10日入院待产。生育史:孕4产1,2014年顺产1男婴,体健,既往人工流产2次。LMP:2019年5月15日,EDC:2020年2月15日。停经40余天开始有恶心呕吐等早孕反应;早期唐氏筛查提示低风险;孕15+周B超提示胎盘增厚,有妊娠合并部分性葡萄胎可能,予以人绒毛膜促性腺激素(HCG)及甲胎蛋白(AFP)检测,两者均在正常范围,遂征求患者同意后,拟行羊水穿刺,查看胎儿染色体核型分析后,再决定是否继续妊娠;孕18周在我院行羊水穿刺,结果提示胎儿染色体未见明显异常;孕22周行彩超检查提示胎盘增厚,胎盘内可见蜂窝状回声,余未发现胎儿结构发育明显异常。孕期共产检17次,口服葡萄糖耐量试验(OGTT)、肝肾功能、乙肝两对半、丙肝、TORCH、血红蛋白电泳、葡萄糖-6-磷酸脱氢酶(G6PD)、人类免疫缺陷病毒(HIV)、梅毒血清学试验(RPR)等检查均无明显异常。因临床上对于PMD的预后很难预测,一些患者可能预后不良,而另一些患者母婴结局良好,故与患者及家属充分沟通告知病情后,孕妇坚持继续妊娠。孕期未行MRI检查,妊娠过程平顺,无妊娠期并发症发生,无早产和明显的胎儿生长受限(FGR)现象。于2020年2月10日(孕39+2周)晨5:30无明显诱因出现阴道流水,量少,色清,无腹痛,无阴道流血,自觉胎动正常入院;入院B超提示:孕晚期单活胎,头位,双顶径(BPD)9.3 cm,股骨长径(FL)7.1 cm,羊水最大深径(AFV)6.2 cm,腹围(AC)30.1 cm,胎盘2级,胎盘厚度8.2 cm,脐带绕颈2周可能,胎儿脐血流在正常范围,胎盘可视范围内与子宫壁分界清,距离宫颈内口5.9 cm范围内未见胎盘组织,胎盘内见蜂窝状回声。入院诊断:足月胎膜早破,PMD,妊娠合并完全性葡萄胎待排。入院后予以催产素引产,产程进展顺利,当天14∶17阴道分娩1女婴,出生时1 min、5 min Apgar评分均为10分,体重2 450 g,外观成熟,未见明显畸形,无Beckwith-Wiedemann综合征。检查胎盘重985 g,组织内可见散在水泡状胎块,约占胎盘面积的1/5,胎盘送病检。产时出血150 ml,产后复查彩超示宫腔内未见明显异常,产后3 d测血HCG 1 901 U/L;产后1周复查血HCG 15 U/L。胎盘病理回报,符合PMD,绒毛膜毛细血管瘤形成。
病理检查:胎盘娩出后送病理。大体表现:送检胎盘大小为20 cm×19 cm×15 cm,胎儿面见范围约10 cm×7 cm灰白稍质韧区,母体面见大小约9 cm×8 cm水泡区;另见灰红色质中结节,直径3.5 cm。胎盘切面见大小不等的水泡(图1)。镜下表现:干绒毛囊性扩张,胎盘肥大和血管异常增生,绒毛间质明显粘液样变,另见结节状绒毛,其内血管增生旺炽,内充满红细胞,绒毛膜毛细血管瘤形成,符合PMD表现(图2)。
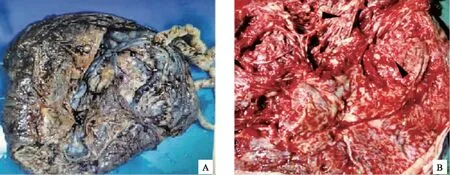
A:胎盘大小约20 cm×19 cm×15 cm;B:母体面可见水泡区图1 胎盘大体所见

蓝箭头示血管增生的干绒毛;黄箭头示绒毛间质明显粘液样变;红箭头示绒毛膜毛细血管瘤形成图2 胎盘病理检查镜下所见(HE染色 ×40)
二、讨论
本文报道的PMD案例,其母婴结局均良好。PMD早期没有特异的临床表现,其超声特征类似于葡萄胎合并妊娠,部分性葡萄胎和完全性葡萄胎均显示出类似PMD的超声特征。因此需要对这两类疾病加以区分:该患者妊娠早期不排除葡萄胎可能,就是因为超声诊断缺乏特异性。大多数PMD的HCG水平显示正常,临床上可以通过检测HCG水平来明确诊断。但有研究发现有38%的PMD中亦存在HCG升高现象[4]。因此如何明确这一部分PMD孕妇的诊断需要进一步梳理。完全性葡萄胎、部分性葡萄胎以及PMD在发生机制上存在差异,完全性葡萄胎合并妊娠属于双胎妊娠,一般认为是两个卵子受精,其中一个卵子的质量出现问题,发生空卵受精,胎儿及空卵受精卵均为二倍体,可以继续妊娠,胎儿的存活几率较大。有文献报道合并完全性葡萄胎的胎儿存活几率可达到24%,妊娠至28周后存活几率达到69%[5]。部分性葡萄胎属于单胎妊娠,胎儿多为三倍体,多于孕早期死亡或合并胎儿畸形[6]。而89%的PMD伴有正常胎儿核型,罕见13-三体综合征、克氏综合征等[7]。因此,可以通过孕期的产前诊断明确胎儿染色体分型,另外检测血HCG和AFP水平,参考孕早期的彩超检查结果来区分两类疾病,从而指导临床的进一步处理。在产后可以使用父系印记基因产物的抗体进行区分,如p57蛋白的抗体以及基质细胞中的雄激素/双亲嵌合体,p57蛋白的抗体在葡萄胎中表达阳性,而基质细胞中的雄激素/双亲嵌合体往往在PMD中有强的表达,可以辅助区分葡萄胎和PMD。另外还可以通过PMD胎盘病理特有的血管异常、胎儿血栓性血管病变、绒毛膜毛细血管病和绒毛膜血管瘤等来对完全性葡萄胎与PMD进行病理鉴别。当存在胎盘嵌合体时,胎儿细胞核型与胎盘核型可能不一致,出生后如能进一步检查胎盘的细胞核型,对于此类疾病的诊断和鉴别可能有更深入的意义,但遗憾的是我们没有及时留下样本,目前也鲜见到类似的报道。
另外有研究发现,PMD患者胎儿显示出女性婴儿的优势(男性∶女性=1∶3.6~8)[3-4,8-9]。且有研究表明调节细胞增殖和/或分化的血管内皮生长因子(VEGF)-D可能与PMD的发展有关[10],其机制可能可以解释女性婴儿的优势地位[11]。VEGF-D相关的血管生成在PMD发展中被认为与子痫前期、FGR和早产[4]有关,原因是绒毛干血管的血管畸形或血栓形成,容易导致预后不良[9]。Nayeri等[4]在2013进行的系统评价中发现,有约9%的PMD患者可以不出现产妇并发症及胎儿、新生儿并发症。合并PMD的病例中,绒毛膜血管血栓形成和脐带异常被认为是引起死胎的可能原因。Umazume等[12]研究发现,扩张的蔓状绒毛膜血管脆弱,其中部分血管壁破裂,导致出血和血肿形成,而这种出血最终导致胎儿猝死。这种胎盘绒毛膜血管血栓形成是否会影响到母体的凝血机制尚不清楚,本案例中因为胎儿预后良好,并没有影响到母体凝血功能,但对于有妊娠并发症和胎儿不良结局的PMD,是否存在一定的影响,目前少有研究,这也是我们今后需要关注的方面。此外,有研究发现 DNA甲基化相关的基因组印迹也与PMD的发病机制有关[13-14]。Watanabe等[15]研究报道,对DNA甲基化的敏感性可能存在性别相关的差异,也许这种差异在PMD的预后上可能出现不同的结果,但这种假设尚需要更深入的研究探讨。PMD还可以导致高血压、羊水过多以及妊娠期糖尿病及先兆子痫等[16],因此在临床上仍应给予足够的重视。
PMD在临床中较为罕见,临床医生对其比较陌生,在明确诊断时主要需与葡萄胎加以区分。诊断以病理检查为主,目前产前诊断缺乏特异性,孕期可通过超声对胎盘的囊性病变进行筛查,另外可通过母体中升高的AFP和HCG水平进行分析。临床诊断中考虑PMD时,建议对产妇进一步行羊水穿刺或脐血穿刺术检测,如为正常女性二倍体核型,及时完善各项产前检查可降低胎儿死亡率。而终止妊娠的时机和分娩方式的选择,还需综合评估孕妇及本次妊娠的情况,因为死胎和绒毛膜血管曲张破裂可能发生在妊娠期的任何时间。在没有Beckwith-Wiedemann综合征的PMD中,FGR和死胎发生率分别为50%和36%;死胎可以发生整个妊娠期间的任何时期(孕21周前死胎发生率为14.3%,孕22~27周发生率为23.8%,孕28~33周为33.3%,孕34周后为28.6%)[17]。
综上,PMD在妇产科较为罕见,对于疑诊PMD的妊娠妇女,可以通过超声、血液标志物以及更进一步的产前筛查优化与葡萄胎加以鉴别,尽早明确诊断,并制定个体化的诊疗计划;这些有赖于更多的临床数据汇总及未来在PMD发病机制上的深入研究,详细的组织学和遗传学分析可能有助于临床上的早期诊断和干预。

