α-二羰基化合物检测方法的研究进展
杨 阳,刘少静,焦淑玲,曾宝平,毋 卓,权科佳,何孝文
(西安医学院药学院 药物研究所,陕西 西安 710021)
α-二羰基化合物(α-dicarbonyl compounds,α-DCs),如甲基乙二醛(MGO)、乙二醛(GO)等(图1),是在体内和体外都能产生的化学和生物活性物质。在体内,α-DCs主要是由一些肠道细菌及人体细胞的代谢产生的,如细胞内的糖酵解、酮体的新陈代谢、苏氨酸的降解、磷酸丙糖的分裂等[1]。在体外,α-DCs主要存在于一些热加工(如焙烤或油炸等)食品或者长期储存的食品中。
α-DCs是一类具有高反应活性的糖化因子,是晚期糖化终产物(AGEs)最重要的前体物质。AGEs与相邻蛋白上的游离氨基以共价键结合的形式形成交联结构,稳定且不可逆, 导致蛋白质的沉积和淀粉样变性[2],这也是AGEs涉及多种疾病(糖尿病肾病、糖尿病心肌病、糖尿病动脉粥样硬化、阿茨海默症等)发病机制的重要原因[2-4]。医学检测发现,以上慢性疾病患者体液(血液、尿液、透析液等)内α-DCs的水平与正常人的相比明显偏高,这说明α-DCs在体液内浓度的升高很可能与这些慢性疾病的发生发展密切相关。因此,对食品中α-DCs进行检测可以指导糖尿病患者和正常人健康饮食,防止病情加重或降低患病几率;而对血清、唾液等生物样品中α-DCs进行检测可辅助诊断糖尿病及其并发症。作者在此对α-DCs的检测方法进行综述,并比较不同检测方法的适用范围和优缺点。

图1 常见α-DCs的结构式Fig.1 Structure formula of common α-DCs
1 高效液相色谱法(HPLC)
HPLC法分离效率高、选择性好、检测灵敏度高、对样品的适用范围广、不受分析对象挥发性和热稳定性的限制。测定α-DCs较为常用的检测器有荧光检测器、紫外检测器和质谱检测器。
1.1 高效液相色谱-荧光检测器联用(HPLC-FLD)
由于α-DCs本身无固有荧光,直接使用荧光检测法检测会比较困难,需要先对α-DCs进行衍生化。
苯甲醛及其衍生物适合作为α-DCs的荧光衍生化试剂。Kishikawa课题组[5]在乙酸铵(CH3COONH4)存在下,向α-DCs溶液中加入4-甲酯基苯甲醛(图2),改变待测物的检测特性,以增加其对检测器的响应,混合后,在100 ℃加热30 min后用荧光分光光度计对α-DCs进行检测,或者将混合物装入HPLC系统再进行定量分析。

图2 4-甲酯基苯甲醛与α-DCs的衍生化反应Fig.2 Derivatization reaction between 4-methoxycar-bonylbenzaldehyde with α-DCs
Palomino-Vasco课题组[6]以3,4-二氨基吡啶(3,4-DAP)为衍生化试剂,在90 ℃、pH值为2的条件下进行120 min的衍生化反应(图3),然后在优化色谱条件下,采用HPLC-FLD法在4 min内即可完成对葡萄酒中α-DCs的检测。
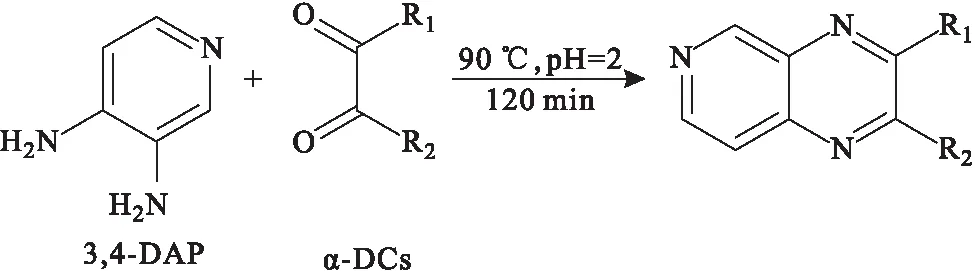
图3 3,4-DAP与α-DCs的衍生化反应Fig.3 Derivatization reaction between 3,4-DAP with α-DCs
Ogasawara等[7]以1,2-二氨基-4,5-亚甲基二氧苯(DMB)为衍生化试剂,在60 ℃下进行40 min的衍生化反应(图4),然后采用HPLC-FLD法对人血浆中的MGO进行检测。结果表明,健康受试者血浆中MGO浓度在0.024~0.258 μmol·L-1之间,日内和日间精密度的RSD值分别为2.55%和4.03%。
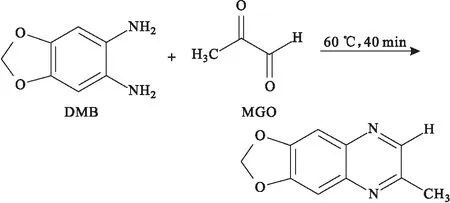
图4 DMB与MGO的衍生化反应Fig.4 Derivatization reaction between DMB with MGO
Wrobel课题组[8]以4-甲氧基邻苯二胺(4-MPD)为衍生化试剂、二乙基乙二醛(DEGO)为内标物,采用HPLC-FLD法测定尿液中GO、MGO和DA,GO、MGO、DA的检测限分别为0.46 μg·L-1、0.39 μg·L-1、0.28 μg·L-1,日内精密度的RSD值小于6%。
1.2 高效液相色谱-紫外检测器联用(HPLC-UV)
α-DCs是一类高度水溶且缺乏发色团的化合物,可以通过对α-DCs的衍生化,引入一些具有紫外吸收的基团,从而提高其可检测性和检测灵敏度[9]。邻苯二胺(OPDA)是一种较好的衍生化试剂,可与α-DCs形成喹喔啉类化合物(图5),而喹喔啉的结构具有稳定性好、紫外吸收灵敏等特点,可以通过HPLC-UV法进行检测[10]。如Taïbi等[11]在测定牛血清中的MGO时,先用OPDA将血清中的MGO衍生化为2-甲基喹喔啉,再以乙腈-0.2%乙酸水溶液为流动相进行梯度洗脱,采用RP-HPLC法进行检测。

图5 OPDA与α-DCs的衍生化反应Fig.5 Derivatization reaction between OPDA with α-DCs
由于OPDA在衍生化时需要加热或长时间孵育并且在酸性条件下进行,会影响样品中α-DCs的实际含量,从而使得检测结果不太准确。于是Wang等[12]在分析测定血浆中α-DCs时,以新合成的4-(2,3-二甲基-6-喹喔啉基)-1,2-苯二胺(DQB)为衍生化试剂(图6),在弱碱性条件下不加热进行衍生化。比较发现,DQB和OPDA的衍生化产物无明显差异,说明碱性条件对检测结果没有影响。在此基础上, Wang等[13]以 DQB为衍生化试剂,对Ⅱ型糖尿病患者唾液中的3-DG、GO、MGO、DA、戊烷-2,3-二酮(PD)进行了定量分析,发现5种α-DCs含量的RSD值为0.34%~4.64%,回收率为80.26%~100.63%。

图6 DQB与α-DCs的衍生化反应Fig.6 Derivatization reaction between DQB with α-DCs
1.3 高效液相色谱-质谱检测器联用(HPLC-MS)

图7 TRI、DDP分别与α-DCs的衍生化反应Fig.7 Derivatization reaction between TRI,DDP with α-DCs
高效液相色谱-串联质谱法(HPLC-MS/MS)在α-DCs的定量分析中也有广泛应用。Henning等[17]采用LC-MS/MS法检测血样中的15种α-DCs、2种α-酮羧酸,衍生化反应在氩气环境中进行,以避免氧气环境下产生新的α-DCs。Gensberger-Reigl等[18]采用UHPLC-DAD-MS/MS法对艾考糊精中的3,4-DDPS、3-DG、4-DG等α-DCs和5-羟甲基糠醛(5-HMF)进行检测。通常情况下,需先将样品中的5-HMF与葡萄糖的降解产物分开,再进行检测,Gensberger-Reigl等则使用OPDA将5-HMF衍生化为苯并咪唑衍生物进行平行分析,操作简便、分析快速、误差较小。陈荣祥等[19]采用HPLC-MS/MS法对木瓜饮料中GO、MGO、DA进行检测,3种化合物在0.012~0.900 mg·L-1范围内线性关系良好(R2>0.99),检测限分别为5.3 μg·L-1、3.1 μg·L-1、3.5 μg·L-1,平均加标回收率为86.26%~95.29%,RSD值为2.49%~7.31%。
2 气相色谱法(GC)
GC是以气体为流动相的色谱方法,主要用于分离分析易挥发的物质,具有效率高、灵敏度高、选择性高等优点。由于α-DCs属于中间体,反应活性高、不稳定,因此在用GC法检测时需要对其进行衍生化以提高其稳定性。最常用的衍生化试剂是OPDA。气相色谱联用氢火焰离子化检测器(FID)、电子捕获检测器(ECD)等是目前检测α-DCs的重要方法。
2.1 气相色谱-氢火焰离子化检测器(GC-FID)
FID是一种质量型检测器,一般只对含碳元素的化合物具有灵敏度高、响应快、噪音小等优点。Khuhawar等[20]以1,2-二氨基丙烷(DAP)为衍生化试剂来测定MGO和DA(图8),由于衍生化需在pH值为3的环境中进行,且反应运行时间太短(4.6 min),导致目标峰与杂质峰不能有效分离。王晨等[21]以OPDA为衍生化试剂,建立了同时在线检测MGO和GO的GC法,OPDA用量为二羰基化合物的67倍,衍生化时间为10 min,MGO和GO的定量限分别为0.06 mg·L-1和0.08 mg·L-1,检测限分别为0.02 mg·L-1和0.03 mg·L-1,方法灵敏度高。

MGO:R1=CH3,R2=H;DA:R1=CH3,R2=CH3
2.2 气相色谱-电子捕获检测器(GC-ECD)
ECD是一种浓度型检测器、离子化检测器,只对含有强电负性元素的化合物具有高选择性和高灵敏度。OSHA Method 1012[22]是以邻五氟苄基羟胺盐酸盐(PFBHA)为衍生化试剂(图9),通过硅胶管-GC-ECD来检测二乙酰基化合物,该方法以两个串联的专门干燥的硅胶管来收集DA,代替了NIOSH Method 2557法[23]中的Anasorb碳分子筛(CMS)吸附剂管和OSHA Method PV2118法[24]中的硅胶管,从而解决了使用单个硅胶管所遇到的迁移问题。
2.3 气相色谱-氮磷检测器(GC-NPD)
氮磷检测器(NPD)是一种质量检测器,对含氮、磷元素的化合物具有高灵敏度和高选择性。由于喹喔啉类化合物含氮元素,因此Jiang等[25]以2-甲基吡嗪(500 mg·L-1)-乙酸乙酯溶液为内标,以OPDA为衍生化试剂,通过固相萃取-GC-NPD来检测α-DCs,12种商业软饮料中的总α-DCs为5.75~50.72 μg·mL-1,DA的检测限为0.3 ng·mL-1,回收率为75.6%~106.3%。Stephanie等[26]使用OPDA处理过的硅胶管代替固相萃取进行样品前处理,DA的检测限为7 ng·mL-1,回收率达到95%以上,与Jiang等的方法相比灵敏度较低,但准确度高、稳定性好,且解决了NIOSH Method 2557法[24]中的湿度问题,可以检测其它方法难以检测的化合物。

图9 PFBHA与二乙酰基化合物的衍生化反应Fig.9 Derivatization reaction between PFBHA with diacetyl compounds
2.4 气相色谱-质谱联用(GC-MS)
GC-MS是目前发展最完善、应用最广泛的联用仪器,具有灵敏度高、检测范围广等优点。LeBouf等[27]用质谱仪代替FID,通过硅胶管-气相色谱-选择性离子监测(SIM)条件下的质谱联用来检测DA,与OSHA Method 1013/1016法相比,定量限降低6.2~6.6倍。Lim 等[28]以2,2,2-三氟乙基肼(TFEH)为衍生化试剂,采用顶空固相微萃取(HS-SPME)-GC-MS法对酒精饮料和发酵食品中GO和MGO进行检测,样品中只有挥发性化合物被固相微萃取(SPME)送到GC系统,而非挥发性干扰物质留在小瓶中,GC-MS的SIM可以获得低干扰峰,GO和MGO的检测限分别为0.001 1 μg·mL-1、0.000 7 μg·mL-1,定量限分别为0.003 6 μg·mL-1、0.002 1 μg·mL-1,RSD值均小于8%。
3 离子色谱法(IC)
IC使用装有离子交换树脂的分离柱进行分离,使用电导检测器(ELCD)进行检测,ELCD对含卤、硫、氮元素的化合物具有高选择性和高灵敏度。王永梅等[29]在碱性条件下使GO与过氧化氢反应生成草酸根(图10),然后使用IC法测定烟用纸张中GO的含量,检测限为5.0×10-5μg·mL-1,具有灵敏度高、重现性好、有机溶剂使用量少等优点。

图10 GO与过氧化氢反应生成草酸根Fig.10 GO reacts with hydrogen peroxide to form oxalate
4 紫外分光光度法
卫佳欢等[30]和刘卓钦等[31]采用紫外分光光度法测定生活用纸中GO的含量,以水为提取溶液,GO与2-亚肼基-2,3-二氢-3-甲基苯并噻唑盐(HMBT)在乙酸溶液中80 ℃下反应生成一种黄色化合物(图11),然后使用紫外分光光度计测定405 nm处吸光度。与其它方法相比,紫外分光光度法不需要繁琐的衍生化条件,而且操作简便,实用性强。
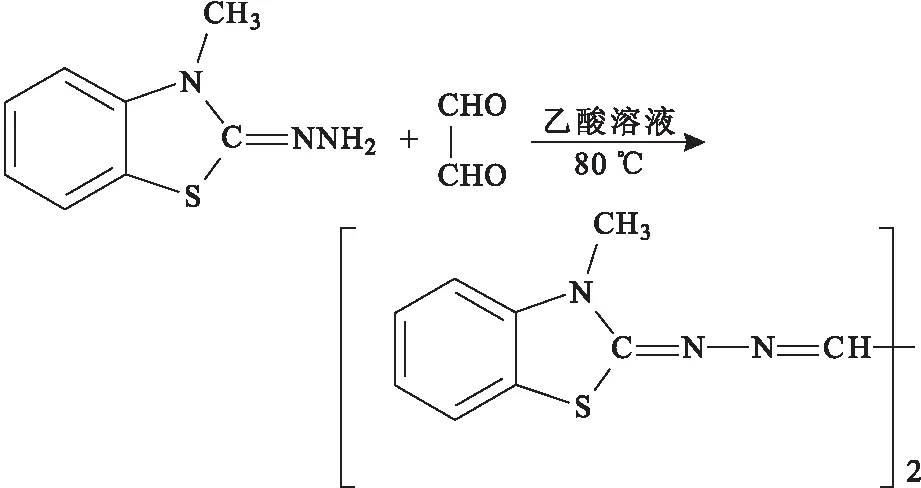
图11 GO与HMBT的反应Fig.11 GO reacts with HMBT
5 传感器检测法
传感器的工作原理是把化学能转变为电能,从而使检测方便、快速、有效地进行。多种传感器技术可应用于MGO的分析检测,包括荧光传感技术、电化学传感技术等。Wang等[32]开发了一种荧光传感器(甲基二氨基苯-bodipy,MBo),可以在生理条件下检测MGO。MBo利用了OPD对MGO的反应性,同时通过调节荧光团和芳基部分的电子特性来克服喹啉的缺电子性质。MBo对MGO的选择性优于其它生物学相关的二羰基类化合物,且对低浓度(50 nmol·L-1)的MGO也很敏感,适用于检测复杂环境中的MGO,包括活细胞环境。
Wu等[33]成功设计了一种基于羧化功能化多壁碳纳米管(MWCNTs-COOH)与羧甲基纤维素(CMC)和壳聚糖纳米圈(CSN)共功能化的纳米复合传感器,用于新西兰麦努卡蜂蜜中MGO的简单、低成本、高灵敏度的伏安识别和测定。CSN-CMC粘附在MWCNTs-COOH表面;纳米复合传感器表现出较大的电化学有效面积及优异的电催化活性,线性范围为5×10-8~8×10-4mol·L-1,检测限为9.6×10-9mol·L-1,在优化条件下具有良好的稳定性和选择性。
6 结语
α-DCs是AGEs的重要前体物质,而AGEs是糖尿病并发症的重要发病机制之一。对生物样本中α-DCs的检测有助于对糖尿病肾病、糖尿病心肌病、糖尿病动脉粥样硬化等糖尿病并发症的发病机制的研究,并对糖尿病的辅助诊断具有一定意义。对食物中α-DCs的检测能够指导糖尿病患者和正常人健康饮食,有效控制外源性α-DCs的摄入量。可见,α-DCs的检测在临床诊断、代谢、药物研究等方面具有重要作用。
α-DCs的检测方法中,应用最广泛的是HPLC和GC。色谱分析前,需要进行衍生化处理,OPDA是使用最广泛的衍生化试剂,4-MPD和DQB作为其衍生化产物也被用作衍生化试剂测定α-DCs;此外,其它邻二氨基化合物,如DAP、3,4-DAP、DDP也可用于α-DCs的柱前衍生化;羟胺、肼等含氨基化合物(2,2-三氟乙肼、邻五氟苄基羟胺盐酸盐等)也可作为衍生化试剂。传感器技术检测α-DCs可以避免或缩短复杂样品前处理及衍生化过程,排除样品中有色物质的干扰,较现有基于色谱学的检测方法更快、更省时,可用于测定复杂样品中的α-DCs,在临床和基础科学研究及实践中具有潜在的应用价值。

