致驴驹腹泻大肠杆菌的分离鉴定及药敏试验
冯培祥,杨 莉,庄桂玉,赵付伟,嵇传良,王延涛,姜桂苗
(1. 国家胶类中药工程技术研究中心 东阿阿胶股份有限公司,山东 聊城 252200;2. 青岛西海岸新区农业农村局,山东 青岛 266400)
腹泻是引起驴驹死亡的最常见原因之一,造成严重的经济损失[1-2]。据报道[3-4],在驴驹6月龄前,多达20%驴驹腹泻是由传染性病原引起的,引起驴驹腹泻病因复杂,涉及到传染源、饲养管理、营养及环境、生理条件等多方面因素。而引起驴腹泻病主要病原菌之一是大肠杆菌。大肠杆菌作为动物肠道共栖菌[5]和条件致病菌,在临床上,其引起幼畜腹泻,严重者可导致败血症的临床症状[6-7]。近年来,随着驴养殖数量增加,因腹泻问题导致幼驹发病率及死亡率不断升高,给养殖业生产造成的损失较大。2017年7月份,聊城某规模驴场暴发了驴驹腹泻病,其发病率约为31%,死亡率约为17%。笔者通过剖检、无菌采集死亡驴驹组织样品,实验室分离鉴定为大肠杆菌。通过药敏试验筛选敏感药物,为该病在临床上的选择用药提供了依据。
1 材料与方法
1.1 材料
1.1.1 样品采集 2018年7月份,剖检采集聊城某养驴场2头2月龄死于腹泻驴驹的肝、脾、肺、肠道等脏器,置于4 ℃ 保存,在6 h 内进行细菌接种培养。
1.1.2 主要试剂及培养基 PremixTaqTM、pMD19-T载体、DL-2 000 DNA Marker、TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0,均购自宝生物工程(大连)有限公司。麦康凯培养基、普通营养琼脂培养基、伊红美蓝培养基及MH培养基,均购自青岛海博生物技术有限公司。
1.1.3 药物 青霉素、丁胺卡那霉素、多西环素、氧氟沙星等14种药敏纸片,购自杭州微生物试剂有限公司。
1.1.4 主要设备 上海博讯恒温振荡培养箱(HPX-9272MBE)、Touch PCR基因扩增仪(960)、山东鑫科生物科技股份有限公司自动生化/药敏分析仪(XK型)、北京君意垂直电泳仪(JY300C)、上海安亭高速离心机(TGL-16G)、山东鑫科比浊仪(XK型)。
1.2 方法
1.2.1 病原的分离及特性培养 通过分区划线将驴驹肝、脾、肺及肠管病料分别接种普通琼脂、伊红美蓝、麦康凯3种平板培养基,37 ℃恒温培养箱内培养18 h 后观察菌落形态并进行革兰染色镜检。
为排查脏器是否存在病毒感染,参考文献[8]的方法,将上述脏器称重研磨,制成加入PBS的1∶5(W/V)悬液,将双抗(100×)加入,之后反复冻融 3~4次,将过滤的上清液接种至犊牛睾丸细胞,37 ℃ 培养2~3 d,细胞染色后于电镜下观察有无病变。
1.2.2 分离菌生化鉴定 参照山东鑫科生物科技股份有限公司细菌生化鉴定试剂盒(XK-24A-C)说明书进行操作,通过生化仪(XK型)进行鉴定并判读结果。
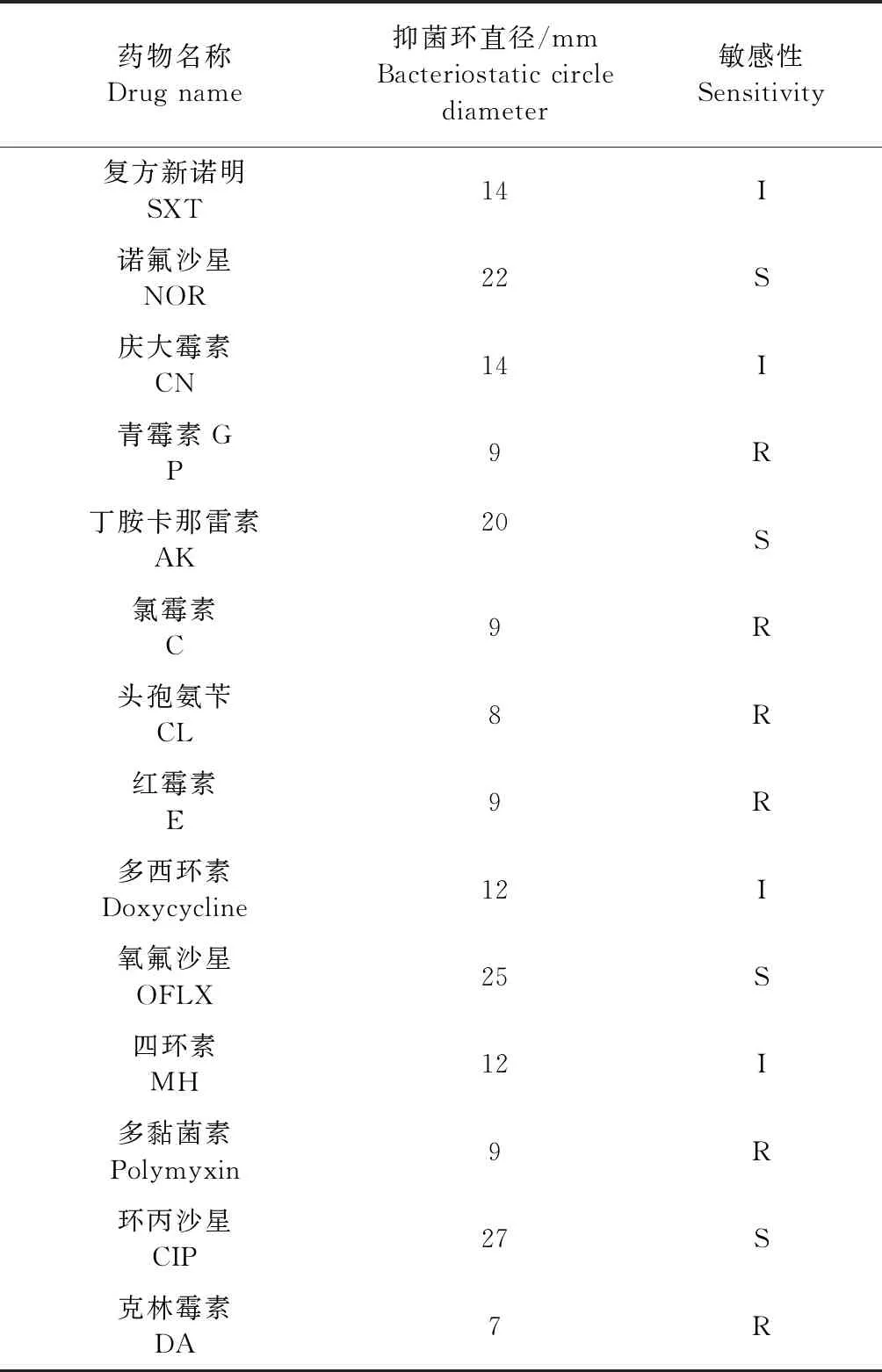
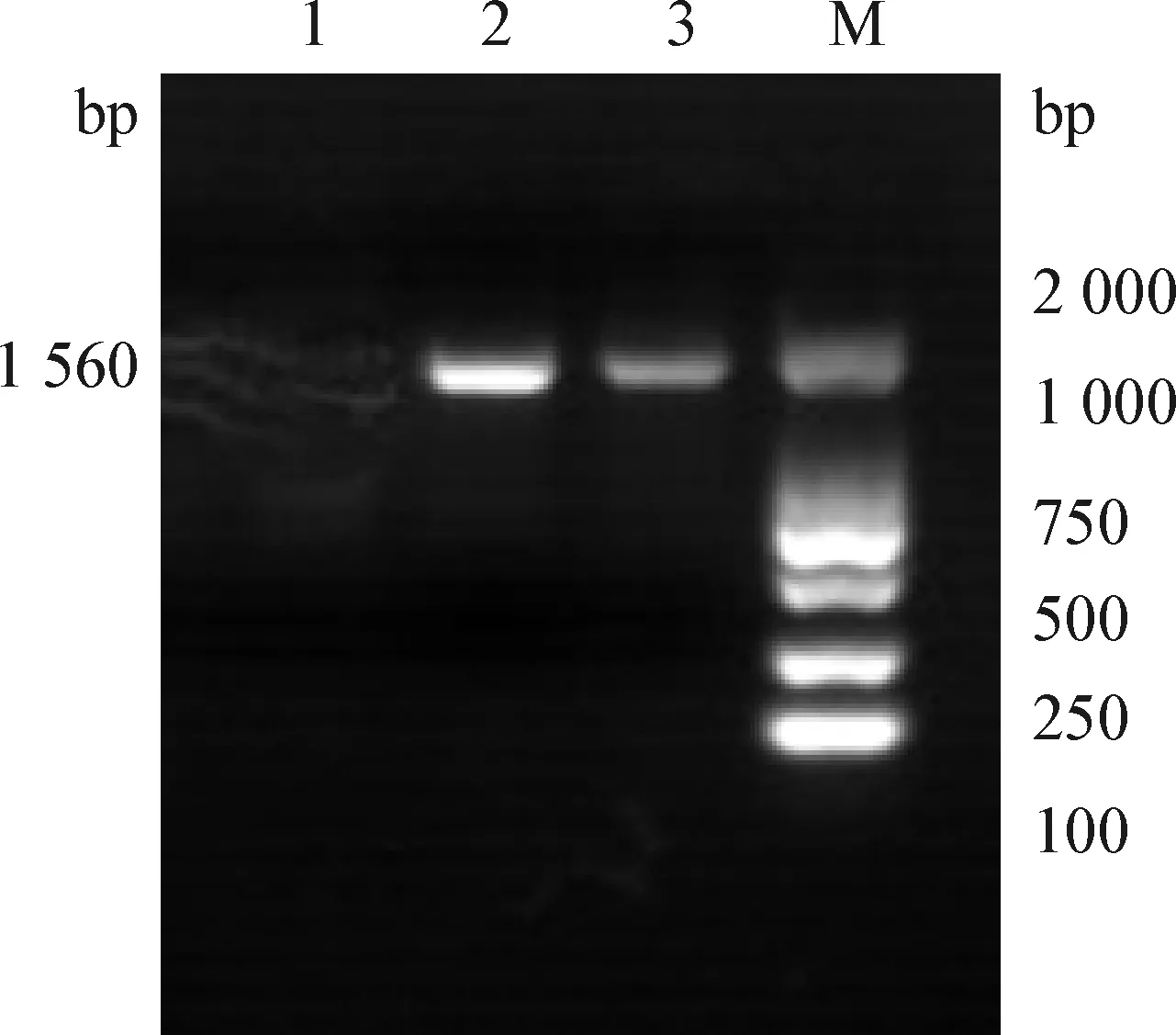
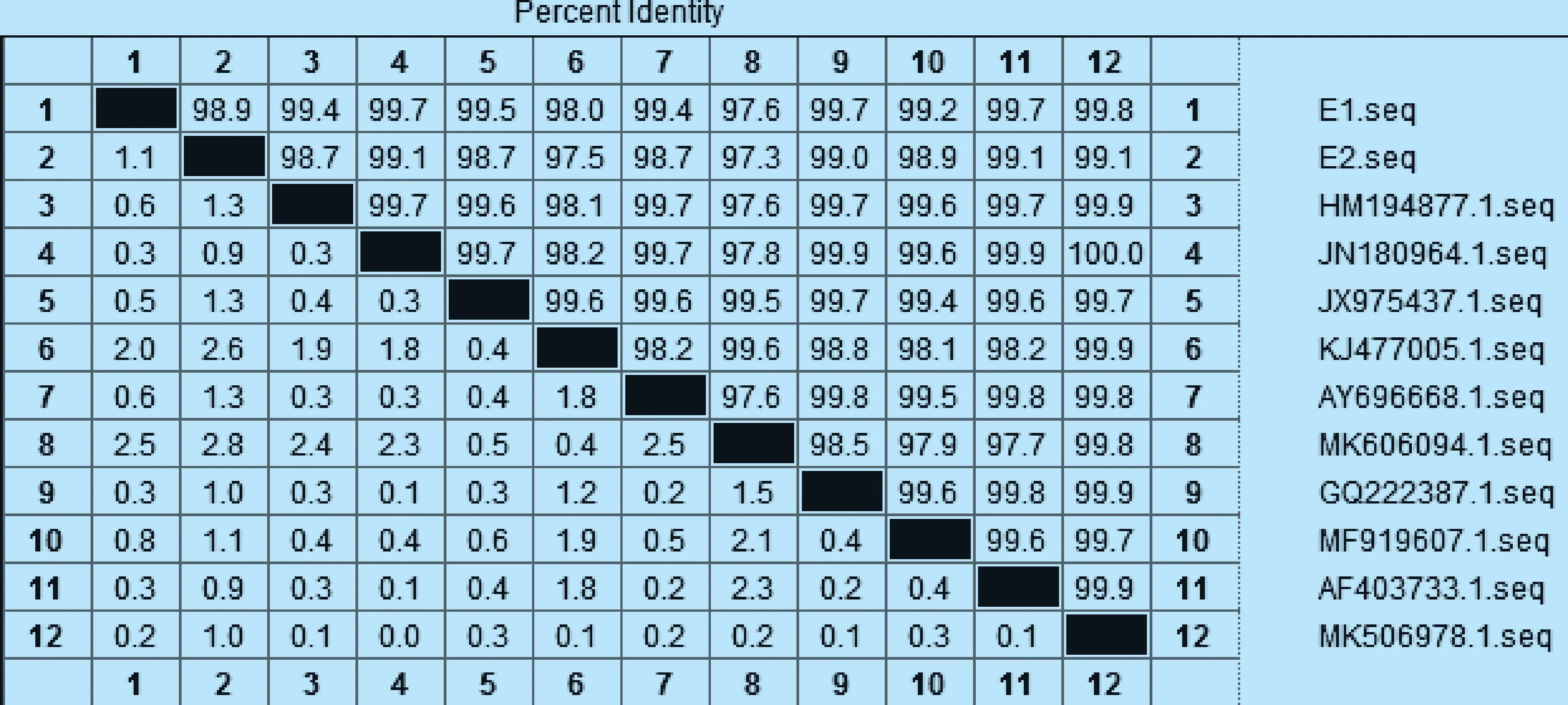
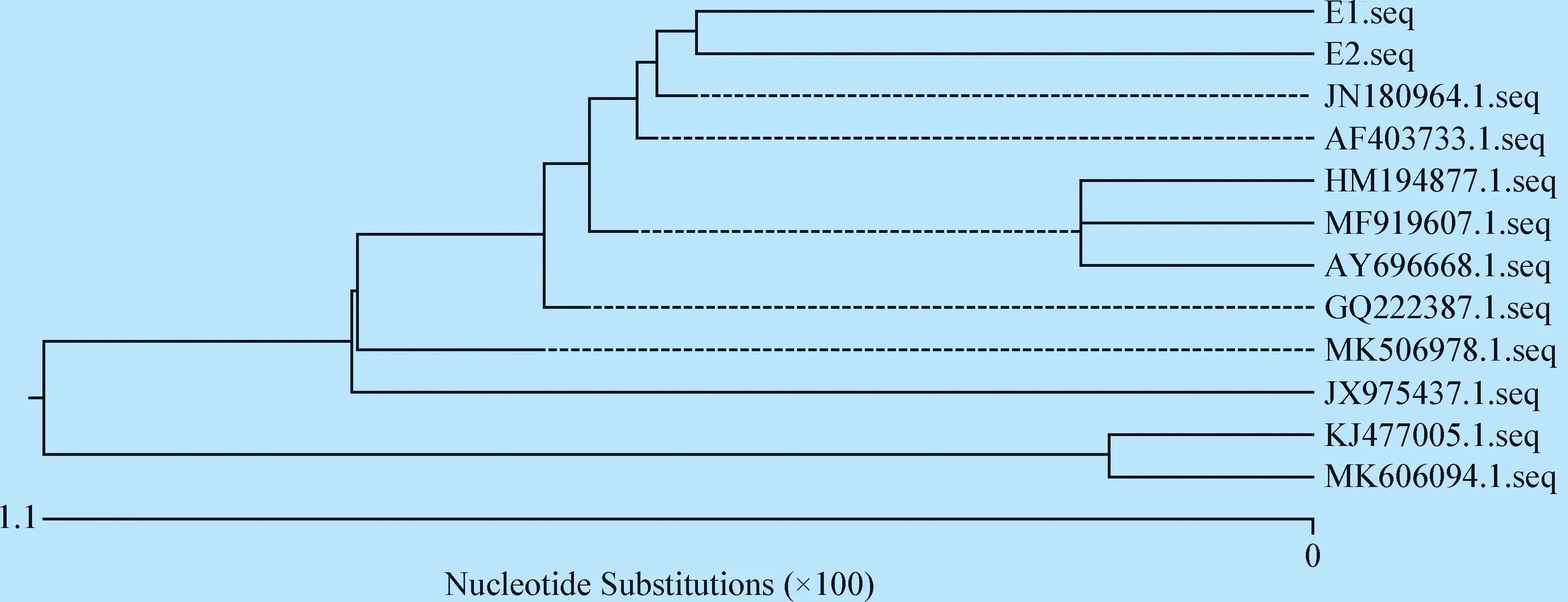
1.2.3 药敏试验 参照CLSL推荐的K-B纸片扩散法进行药敏试验[9],观察药敏纸片周围有无抑菌圈形成,测量其直径(d)大小。将2株分离菌药敏试验设置1个平行。参考罗玲等[10]报道方法进行结果判定:d>15 mm 为高度敏感;10.1 mm 1.2.4 16S rRNA基因序列测定与系统进化分析 采用苯酚-氯仿法提取2株分离菌DNA。参考钟世勋等[11]设计16S rRNA上游引物F:5′-GGTTACCTTGTTACGACTT-3′,下游引物R:5′-AGAGTTGATCCTGGCTCAG-3′进行PCR扩增。扩增阳性产物与pMD19-T连接,转化大肠杆菌感受态细胞,将重组阳性质粒命名为E1、E2,送生工生物工程(上海)股份有限公司测序。 将分离菌E1、E2的16S rRNA序列通过NCBI的Blast进行同源性比对,使用DNASTAR软件从GenBank 数据库中获得其他大肠杆菌16S rRNA 序列进行多序列匹配排列(Multiple Alignments),采用邻接法(Neighbor joining method)构建系统进化树。 2.1 分离菌培养特征及形态观察 从腹泻驴驹肺脏及肠管内分离到E1、E2两株细菌,其他脏器均未分离到细菌。2株分离菌在普通琼脂培养基上可见表面光滑、半透明的单菌落。其在麦康凯琼脂平板上形成圆形、边缘整齐的红色单个或多个菌落。在伊红美蓝培养基长出带金属光泽、深紫黑色的圆形菌落。2株分离菌革兰染色为阴性,镜检可见其为两端钝圆的短杆菌,散在排列。 处理脏器的悬液接种犊牛睾丸细胞后,无病变出现,通过镜检未见病毒颗粒。 2.2 分离菌的生化鉴定 分离菌E1、E2的生化反应结果一致,均符合大肠杆菌生化特性。 2.3 药敏试验 测量分离菌E1、E2的抑菌圈直径结果显示,2株分离菌的药物敏感性相似,取其平均值,结果见表1。 表1 2株分离株的药物敏感性(平均值)Table 1 Drug sensitivity of 2 isolates (Average) 2.4 16S rRNA基因序列测定与系统进化分析 扩增E1、E2 16S rRNA后,在1 500 bp处出现目的条带(图1)。将E1、E2的16S rRNA基因序列与GenBank数据库进行同源性比对,其结果与大肠肝菌的16S rRNA 基因自然聚类,将分离株分别与 GenBank收录的大肠杆菌通过DNASTAR进行同源性分析,并绘制成系统进化树(图2)。结果显示,2株分离株核苷酸序列之间的同源性为98.9%,与GenBank收录的其他大肠杆菌同源性在97.6%~99.8%。系统发育树结果如图3所示,2株分离菌处于同一分支,且与牦牛源大肠杆菌JN180964.1最近,最终构成一个分支。 图1 2株分离菌16S rRNA目的基因的PCR结果Fig.1 PCR results of 16S rRNA target genes of two isolates1:阴性对照; 2:E1; 3:E2; M:DL-2 000 Marker1:Negative control; 2:E1; 3:E2; M:DL-2 000 Marker 图2 2株分离菌16S rRNA基因序列的同源性Fig.2 The homology of 16S rRNA gene sequence of two isolates 图3 分离菌16S rRNA基因系统进化树Fig.3 Phylogenetic tree of 16S rRNA gene of isolates 本试验从腹泻驴驹的肺脏和肠管内分离到2株大肠杆菌E1、E2,分离株E1、E2与大肠杆菌的同源性最高为99.8%。除采用传统细菌鉴定方法外,本试验选取了16S rRNA基因扩增测序法对未知菌落进行了鉴定。因16S rRNA基因在细菌中具备高度保守序列,具有细菌种、属特征,已被用作细菌系统发育分类的目的基因,是一种对细菌分类鉴定快速、准确的方法[12]。据高静雯等[13]报道,从患乳房炎驴的乳汁中分离鉴定出大肠杆菌,其耐药性较差,对青霉素、阿莫西林、庆大霉素等药物都敏感。据孙莹慧等[14]报道,其从腹泻驴驹脾脏组织内分离到1株大肠杆菌,对22种药物都有耐药性,仅对多黏菌素敏感,提示该养殖场大肠杆菌分离株耐药现象严重,需要在用药方面引起管理者的重视。 细菌耐药性产生原因是多方面的,除了细菌本身内在特性外,还与抗生素不合理应用有极大关系[15]。结合该驴场用药史及现场的饲养管理情况,提示该场暴发驴驹腹泻主要原因是滥用抗生素,导致大肠杆菌耐药性的产生,诱因是饲养管理较为粗放,加剧了该病的发展。因此,笔者建议驴场需从源头上查找并解决问题,严格遵守兽药用药规范,合理用药,提升饲养管理水平,做好已发病驴驹治疗与护理工作,以降低驴驹发病率与死亡率。半个月后回访,该场长告知,通过选用敏感药物丁胺卡那霉素灌服,配合肌内注射环丙沙星注射液,及时给脱水驴驹补液等处理措施,场内驴驹腹泻情况已经得到控制。1个月后电话回访,通过圈舍卫生条件的改善及选用敏感药物治疗,驴驹腹泻问题已可控,其发病率已降至7%,再未出现因腹泻导致的死驹情况。由此可见,细菌引起的驴驹腹泻问题是可控的。本试验为腹泻驴驹病因查找提供了理论依据,并为驴场腹泻驴驹筛选出了有效抗菌药物,也为该驴场疾病防治提供了参考。2 结果
3 讨论

