五味子醇提物对TNBS致小鼠肠道炎症的损伤修复作用
武晓英,李 博,曹贵东,刘爱玲,刘桂兰,刘 地,李 娜,郝雪峰,乔宏萍
(1. 太原师范学院生物系,山西 晋中 030619;2. 山西瑞象生物药业有限公司,山西 太原 030032;3. 天津渤海农牧产业联合研究院有限公司,天津 滨海新区 300308)
肠炎在畜禽养殖中发病率很高,目前抗生素类药物是主要治疗方法,但这些药物的使用经常导致畜禽肠道菌群失调,治疗效果并不理想,而且抗生素的残留问题对环境和人类健康都存在潜在风险[1]。中草药在中国有着几千年的传承,其药效显著,已有大量的研究证明,中草药的有效成分可以增强肠黏膜的抗炎效应,对肠道炎症起到治疗作用[2-3]。因此,本试验采用五味子醇提液对2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)肠炎模型小鼠进行治疗效果观察,为找到更安全有效的肠炎治疗办法提供有效的理论依据。
1 材料与方法
1.1 主要试剂 TNBS,购自美国Sigma公司;血清促炎症细胞因子白细胞介素1β(Interleukin-1β,IL-1β)、白细胞介素6(Interleukin-6,IL-6)、抑制炎症细胞因子白细胞介素10(Interleukin-10,IL-10)和肿瘤坏死因子(Tumor necrosis factor-a,TNF-α)检测试剂盒,均购自武汉博士德生物工程有限公司;组织细胞因子IL-1β、IL-6、IL-10和TNF-α检测试剂盒,均购自上海西唐生物科技有限公司;血清及组织抗氧化指标总超氧化物歧化酶(Total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、总抗氧化力(Total antioxidation capacity,T-AOC)及丙二醛(Malondialdehyde,MDA)检测试剂盒,均购自南京建成生物工程研究所。
1.2 主要仪器 旋转蒸发仪,上海亚荣生化仪器厂;高压灭菌锅,日本松下电器公司;全波段酶标仪,赛默飞世尔科技(中国)有限公司。
1.3 实验动物 SPF级雌性昆明系小鼠18只,4~5周龄,体重20~22 g,购自山西医科大学实验动物中心。
1.4 试验方法
1.4.1 五味子醇提物的制备 五味子中药粉碎后称取50 g装于1 000 mL圆底烧瓶中,用95%乙醇浸泡过夜(药材与水的体积比1∶7),次日,电热套加热微沸冷凝循环持续4~6 h,加热结束后6 000 r/min离心,上清液用旋转蒸发仪浓缩至50 mL,即药液浓度为1 g/mL生药,于4 ℃冰箱中保存备用。
1.4.2 试验设计 18只小鼠随机分为3组,每组6只,称重记录,分别为对照组(C组)、致病组(TNBS组)和治疗组(S+TNBS组)。
小鼠肠炎模型建立:将小鼠预饲1周,试验前禁食24 h,自由饮水,采用灌肠法处理。TNBS组和S+TNBS组按每只小鼠5%TNBS[0.2 mL/(100 g·bw)]+50%乙醇(0.25 mL)进行灌肠,每周1次,连续处理4周。C组小鼠按生理盐水[0.2 mL/(100 g·bw)]+生理盐水(0.25 mL)进行灌肠。
中药治疗:造模4周后,S+TNBS组每只小鼠灌胃1 g/mL五味子醇提液0.2 mL,TNBS组和C组小鼠灌胃生理盐水,自由采食饮水0.2 mL,连续处理10 d。末次给药后给水禁食24 h,采用摘眼球法取小鼠血样冻存于-20 ℃冰箱以测定细胞因子和抗氧化性能。
1.4.3 小鼠血清、肠组织细胞因子含量测定 ELISA双抗夹心法检测血清中细胞因子IL-1β、IL-6、IL-10和TNF-α的含量,严格按照试剂盒说明书进行操作。ELISA双抗夹心法检测肠组织中细胞因子IL-1β、IL-6、IL-10和TNF-α的含量。肠组织制备匀浆液,用PBS缓冲液反复清洗小鼠肠组织样品,称取0.5 g组织样加生理盐水5 mL进行匀浆,离心沉淀收集上清液进行细胞因子检测,检测方法严格按照试剂盒说明书进行操作。
1.4.4 小鼠血清、肠组织抗氧化指标检测 除血清外,肠组织制备成10%的组织匀浆,4 ℃下15 000 r/min离心15 min,取上清液检测T-SOD、GSH-Px、T-AOC活性及MDA含量,操作方法按试剂盒说明书进行。
1.5 数据分析 试验采用单因素方差分析并进行Duncan法多重比较,数据利用SPSS17.0软件分析,试验结果用平均值±标准误差表示。
2 结果
2.1 不同处理组小鼠生理体征变化及剖检病理观察 小鼠生理体征变化:造模前,小鼠机体健康,精神状态良好,排便正常;造模过程,每隔7 d采用TNBS/乙醇法对TNBS组和S+TNBS组小鼠进行灌肠处理,处理4次28 d后TNBS组和S+TNBS组小鼠出现身体弓背蜷缩、活动减少、食量减少、大便溏且排血便。对照组小鼠采用生理盐水灌肠后饮食、活动正常;中药治疗过程,4周后,S+TNBS组小鼠灌胃五味子醇提液,TNBS组和C组小鼠灌胃生理盐水,在治疗的10 d中,S+TNBS组小鼠进食和饮水逐步增加,精神好转,便溏改善,无血便,S+TNBS组较TNBS组有较大的改观,但是同正常C组相比仍体质虚弱。
小鼠剖检观察:试验结束后剖检小鼠,肉眼观察肠道组织形态变化。C组小鼠肠道组织形态完整,无水肿,无出血;TNBS组小鼠肠道组织变形、肠管狭窄,伴有肠组织溃疡和出血;S+TNBS组小鼠经五味子醇提物灌胃治疗后,其肠道组织形态较完整,轻微水肿现象,无溃疡,无出血,与TNBS组相比损伤症状有明显的减缓作用。
2.2 五味子醇提物对肠炎小鼠血清中细胞因子分泌的影响 见表1。由表1可知,TNBS组血清中促炎症细胞因子IL-1β、IL-6和TNF-α的含量显著高于S+TNBS组(P<0.05),极显著高于C组(P<0.01),S+TNBS组显著高于C组(P<0.05);S+TNBS组IL-10的含量极显著高于TNBS组(P<0.01),显著高于C组(P<0.05)。
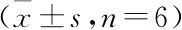
表1 不同处理组小鼠血清中细胞因子分泌的比较Table 1 Comparison of cytokine secretion in serum of mice in different treatment groups
2.3 五味子醇提物对肠炎小鼠血清抗氧化性能的影响 见表2。结果显示,经五味子醇提物治疗后,S+TNBS组血清中T-SOD的含量极显著高于C组和TNBS组(P<0.01),TNBS组显著高于C组(P<0.05);小鼠血清中GSH-Px和T-AOC的含量S+TNBS组极显著高于C组(P<0.01),显著高于TNBS组(P<0.05),TNBS组显著高于C组(P<0.05);S+TNBS组血清中MDA的含量显著低于TNBS组(P<0.05),显著高于C组(P<0.05),C组极显著低于TNBS组(P<0.01)。
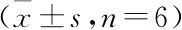
表2 不同处理组小鼠血清抗氧化性能的比较Table 2 Comparison of serum antioxidant properties of mice in different treatment groups
2.4 五味子醇提物对肠炎小鼠肠组织细胞因子分泌的影响 见表3。由表3可知,经五味子醇提物治疗后,小鼠S+TNBS组肠组织中IL-1β、TNF-α和IL-6的含量显著低于TNBS组(P<0.05),但显著高于C组(P<0.05),TNBS组极显著高于C组(P<0.01);S+TNBS组肠组织中IL-10的含量极显著高于TNBS组(P<0.01),显著高于C组(P<0.05),C组显著高于TNBS组(P<0.05)。
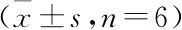
表3 不同处理组小鼠肠组织中细胞因子分泌的比较Table 3 Comparison of cytokine secretion in intestinal tissues of mice in different treatment groups
2.5 五味子醇提物对肠炎小鼠肠组织抗氧化性能的影响 见表4。结果显示,经五味子醇提物治疗后,比较不同试验组肠组织中T-SOD的含量,S+TNBS组极显著高于C组和TNBS组(P<0.01),TNBS组显著高于C组(P<0.05);S+TNBS组肠组织中GSH-Px和T-AOC的含量极显著高于C组(P<0.01),显著高于TNBS组(P<0.05),C组显著低于TNBS组(P<0.05);S+TNBS组肠组织中MDA的含量极显著低于TNBS组(P<0.01),显著高于C组(P<0.05),C组极显著低于TNBS组(P<0.01)。
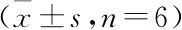
表4 不同处理组小鼠肠组织中抗氧化性能的比较Table 4 Comparison of antioxidant properties in intestinal tissues of mice in different treatment groups
3 讨论
肠道是机体免疫水平最高的重要器官,肠炎的发生主要与肠黏膜屏障损伤相关,各种致病因素通过刺激肠道发生组织病变[4]。TNBS和乙醇混合法是通用的动物肠炎造模方法之一,该方法一方面活化并释放促炎症因子TNF-α促使NO的生成,导致细胞损伤,形成溃疡;另一方面TNF-α加速白细胞介素IL-1β、IL-2、IL-8等的释放,从而导致肠黏膜屏障的损伤[5]。中草药能够通过调节促炎症细胞因子的表达缓解炎症反应[6-11]。已有的研究证实,中草药五味子对于治疗腹泻、疲劳、失眠和神经衰弱等病症具有很好的疗效[12]。近年来不少研究者在临床上应用五味子配伍的四神丸治疗腹泻型肠易激综合征取得了显著疗效[13]。研究人员还发现,四神丸对脾虚小鼠具有肠道菌群调整及促进损伤肠组织恢复的作用[14]。但五味子作为四神丸中的重要配伍成分,其作用机理尚未明确。Tsujikawa T等[15]通过检测TNF-α水平变化来评估TNBS诱导小鼠结肠炎模型中炎症程度及药物治疗的效果。因此本试验使用TNBS进行小鼠肠炎造模,通过检测TNF-α、IL-10、IL-6、IL-1β四种细胞炎症因子的表达来揭示五味子醇提液对TNBS型肠炎的作用机制,试验结果显示,TNBS致小鼠肠炎经五味子醇提物治疗后,S+TNBS组小鼠肠道损伤虽不能完全恢复到和C组小鼠一致,但小鼠血清与肠组织中细胞促炎症因子IL-1β、IL-6和TNF-α的含量显著低于TNBS组(P<0.05),抑制炎症的细胞因子IL-10的含量极显著高于TNBS组(P<0.01)。本试验结果与前人一致[16-17],证实五味子醇提物可以使促炎症细胞因子分泌降低,抑制炎症细胞因子分泌升高,有效促进了损伤肠组织的恢复。
生物体通过自身防御系统来维持氧化还原平衡状态,一旦平衡被打破,氧化应激会使得组织和细胞内蓄积大量活性氧(ROS),进而损伤细胞内的生物大分子,造成机体功能障碍[18]。大量的研究表明,TNBS化学制剂能诱导机体产生高水平的ROS,ROS破坏了细胞膜脂产生大量的MDA,干扰脂质代谢平衡,从而导致细胞和组织氧化损伤[19]。T-SOD和GSH-Px是机体清除氧化损伤所产生ROS的重要酶,MDA是膜脂质过氧化最重要的产物之一,T-AOC可以用来检测机体的抗氧化能力。本试验采用TNBS法进行小鼠肠炎建模,经五味子醇提物治疗后,无论血清或肠组织中,S+TNBS组小鼠的抗氧化能力明显提高,小鼠剖检肠道病理观察与TNBS组相比炎症损伤症状有非常明显的减缓作用。本试验阐明了五味子醇提物在浓度为1 g/mL时对TNBS致小鼠肠炎的损伤修复有较好的治疗作用。

