成人静脉-动脉体外膜氧合期间血制品输入的回顾性分析
滕 媛,王 建,闫姝洁,刘 刚,吉冰洋
静脉-动脉(veno-artery,V-A)体外膜氧合(extracorporeal membrane oxygenation,ECMO)为难治性心源性休克、心脏骤停、心脏术后脱机困难的危重患者提供有效的机械循环支持,使心脏功能恢复,有利于提高患者存活率[1-2]。虽然近年来ECMO设备和管理技术不断改善,但其相关的并发症仍在威胁患者的预后,其中出血是ECMO期间最常见的并发症,既往文献报道出血发生率约27%甚至更高[3-5]。血液和ECMO管路的非生理性接触以及ECMO过程中产生的高剪切力可导致凝血因子激活、血小板活化以及炎症反应[6],增加出血风险,此外,ECMO期间的抗凝方案[7]、手术的创伤和患者的状态也是常见引发出血的因素。
血制品输入可以改善氧供、补充凝血因子等,是出血的常见处理措施之一,但同时也是增加危重症患者死亡率的危险因素[8]。了解ECMO期间血制品使用情况不仅可以指导合理利用有限的血资源,个体化治疗,还可以帮助评估患者的预后。迄今为止,已发表的关于ECMO期间血制品应用的文章数量很少,因此本文回顾性分析成人V-A ECMO期间红细胞悬液、新鲜冰冻血浆、血小板的输注量以及在手术组和非手术组不同亚组之间的差异,并分析血制品输注量对院内死亡率的影响。
1 资料与方法
1.1 研究对象 本研究回顾性分析2017年1月至2019年6月阜外医院成人V-A ECMO患者的临床资料共63例。排除标准:年龄<18岁、ECMO运行时间<48 h、外院转运至本院者,经排除后共纳入49例患者。因心脏手术脱机困难和心脏手术后心源性休克建立V-A ECMO者为手术组(n=32),非心脏手术后建立ECMO者为非手术组(n=17)。手术组和非手术组患者各自根据出院结局,又分为手术-院内死亡组(n=15)和手术-院内存活组(n=17)、非手术-院内死亡组(n=6)和非手术-院内存活组(n=11)。
1.2 ECMO管理 所有ECMO患者统一使用MAQUET BE PLS2050套包和Rotaflow离心泵,经外周股静脉-股动脉插管(V-A模式),为预防肢体远端发生缺血坏死,常规放置股动脉远端灌注管。ECMO初始流量一般设置为50~70 ml/(kg·min),随后根据血流动力学和混合静脉血氧饱和度进行调整。ECMO期间均采用普通肝素进行抗凝,脱离体外循环困难转为ECMO辅助者,置管前无需额外单次给予普通肝素,心肌炎等非手术患者置管前普通肝素初始剂量100 U/kg。普通肝素维持剂量和泵入的时机因人而异,主要依据活化凝血时间(activa⁃ted clotting time,ACT)和活化部分凝血活酶时间(activated partial thromboplastin time,APTT)进行调整,ECMO期间ACT目标范围180~220 s、APTT目标范围60~80 s。合并出血时,医生根据临床情况综合判断,普通肝素剂量减低甚至会暂时中断抗凝。ECMO患者内环境依据血气结果进行调整。当流量降至患者理想心排量的20%~25%,使用小剂量正性肌力药即可维持血流动力学稳定,且心脏超声提示心脏搏动有力,左室射血分数≥40%,即可考虑撤除ECMO。
1.3 血制品管理 ECMO期间每日常规检测血常规、凝血五项和血生化,包括血红蛋白(hemoglobin,Hb)、血细胞比容(hematocrit,HCT)、血小板,以及凝血酶原时间(prothrombin time,PT)、APTT、国际标准化比率(international normalized ratio,INR)、纤维蛋白原、D-二聚体,以及肌酐(creatinine,Cr)。血气、ACT和APTT每3 h检测一次。严重出血的定义为24 h内Hb下降20 g/L、出血量超过20 ml/kg、需要外科开胸止血处理、中枢神经系统、消化道等脏器出血[9]等。出血风险高的患者给予血制品纠正凝血异常,ECMO期间Hb低于80 g/L输注红细胞悬液;血小板数量每
12 h检测一次,低于50×109/L时输注血小板;INR>1.5~2倍的正常值时输注新鲜冰冻血浆[9]。
1.4 研究终点 主要研究终点包括成人V-A EC⁃MO期间不同血制品的用量,以及随运行天数的变化趋势;次要研究终点包括V-A ECMO期间出血率、院内死亡率、血制品对院内死亡率的影响。
1.5 统计学分析 采用SPSS 19.0统计学软件进行统计分析。符合正态分布的计量资料用均数±标准差(±s)表示,组间比较采用t检验。符合偏态分布的计量资料用中位数(四分位数)表示,组间比较采用Wilcoxon秩和检验。率的比较用卡方检验。采用Logistic回归分析影响院内死亡因素。P<0.05认为存在统计学差异。
2 结 果
2.1 一般资料 本文共纳入49例患者,手术组32例,其中心脏移植脱机困难者12例;非手术组17例,其中心肌炎患者8例。ECMO运行时间、ECMO期间出血率、ICU时间、院内死亡率等患者的一般资料见表1。与非手术组比较,手术组患者年龄(P<0.01)和呼吸机使用时间(P<0.05)显著增加,差异有统计学意义。手术组和非手术组不同亚组患者的一般资料见表2。
2.2 成人V-A ECMO期间血制品用量分析 成人V-A ECMO期间仅有3例(6.1%)患者未输任何血制品,总体红细胞悬液输注率83.7%,新鲜冰冻血浆输注率77.6%,血小板输注率63.3%,ECMO期间患者平均接受10 U红细胞悬液,800 ml新鲜冰冻血浆,1 U血小板。手术-院内死亡组患者三种血制品输注量均显著高于手术-院内存活组,均具有统计学差异(P<0.05),见表3。与非手术-院内存活组对比,非手术-院内死亡组患者ECMO期间新鲜冰冻血浆(P<0.05)和血小板(P<0.05)用量显著升高(表3)。在ECMO期间红细胞悬液、新鲜冰冻血浆和血小板输注量随运行天数变化趋势,ECMO运行前7天血制品用量大。
2.3 血制品用量对不同亚组院内死亡率影响的多因素分析 将手术组亚组患者资料中P<0.05的单因素纳入多因素分析,为研究连续变量对因变量的影响程度,将血制品用量按是否大于中位数转换为分类变量。模型的最终分析结果显示,红细胞悬液和血小板的输注量能显著影响手术组患者的院内死亡率(P<0.05),OR值均为8.78。见表4。在对非手术组患者院内死亡率的多因素分析中,由于样本量太少,模型出现过拟合迭代终止,没有找到唯一解,血制品用量对非手术组院内死亡率影响尚不确定。
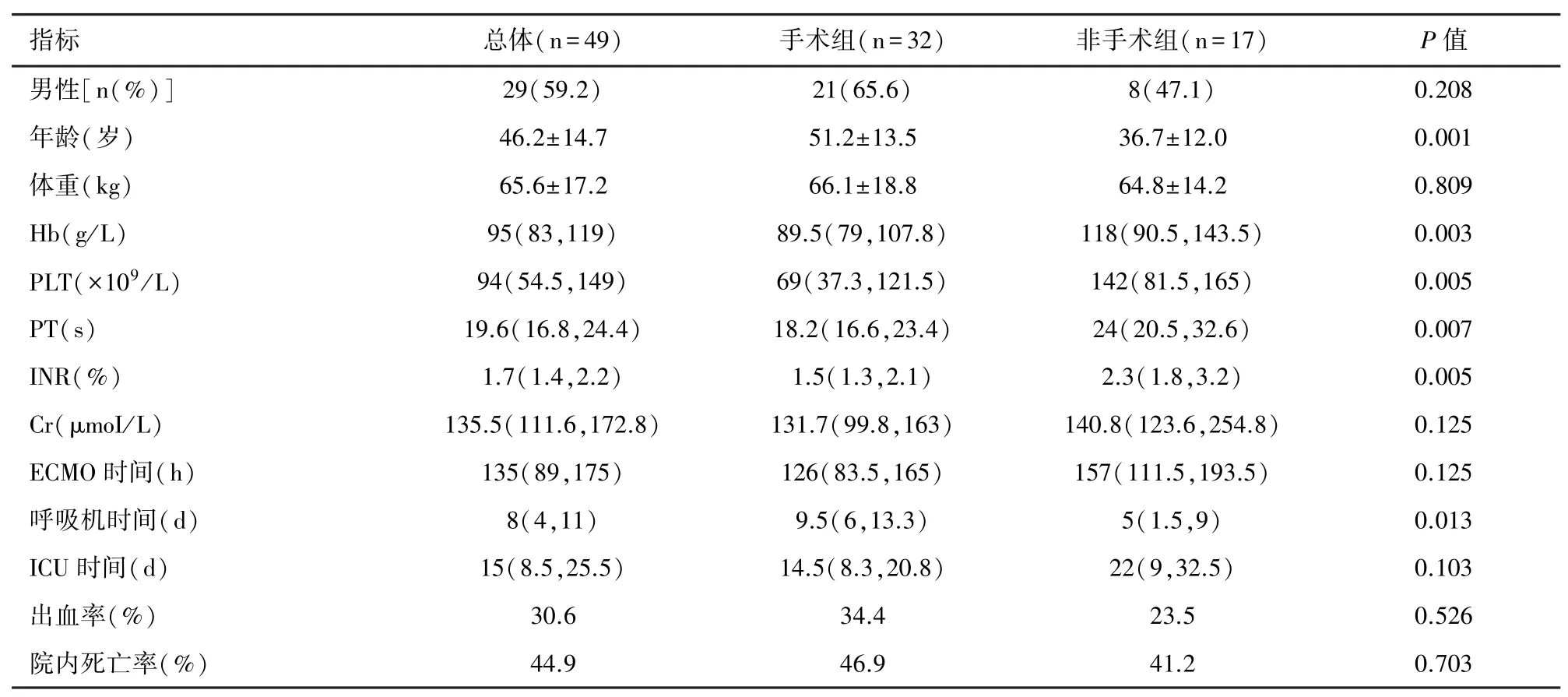
表1 患者一般资料

表2 手术组和非手术组的亚组患者一般资料比较

表3 ECMO期间不同亚组患者的平均血制品用量比较

表4 手术组院内死亡率相关的多因素分析
3 讨 论
V-A ECMO是救治心源性休克的一种有效手段,最新的一项meta分析结果表明V-A ECMO可以提高心脏手术后三分之一患者的存活率[10]。但是ECMO技术复杂,其高创伤、高消耗、高并发症等特点,仍严重影响患者的预后。Cheng等[11]系统回顾了包括20项研究和1 866例患者在内的文献,发现40.8%的ECMO患者合并大出血或严重出血,41.9%的ECMO患者在心脏术后需再次开胸探查止血。Aubron等[12]通过5年的队列研究表明,出血是ECMO期间最严重的并发症,且显著增加死亡率。血制品输注是ECMO治疗期间纠正出血的一项重要措施,但却少有文献提及相关血制品输注的数据。
出血和血制品的用量是重症监护病房患者预后不良的因素之一。本研究发现,成人V-A ECMO期间出血率30.6%,所有ECMO患者平均接受10 U红细胞悬液、800 ml新鲜冰冻血浆及1 U血小板。手术组患者ECMO期间三种血制品用量均显著高于非手术组,这是由于手术组患者不仅经历了手术创伤,还遭受长时间体外循环辅助带来的血液稀释、机械破坏、溶血和非生理性接触[13],激活凝血反应,促进血小板的活化聚集,从而导致手术组患者血红蛋白、凝血因子和血小板数量下降程度更高,凝血功能异常的风险增加。此外,手术组术后再次开胸探查止血的概率较高,又会对凝血功能产生二次打击,增加血制品用量。另外,手术组患者术后前几日由于胸液量较多,ECMO期间抗凝强度常需维持在目标范围低限,出血和血栓之间的困难平衡,也会影响血制品用量。本中心的研究结果与Buscher的结果[14]相似,他回顾了42例ECMO患者,认为手术组患者每日输入的新鲜冰冻血浆[1.1(1.93)U vs.0.2(0.59)U,P=0.049]和血小板量[0.5(0.51)vs.0.1(0.25)U,P=0.003]高于非手术组。但该研究认为两组红细胞悬液输注量无显著差异[1.8(1.73)vs.1.3(1.84),P=0.431],推测这一结果可能与他们纳入部分V-V ECMO有关,有研究报道V-V ECMO血制品输注量低于V-A ECMO[15]。
在本次回顾性研究中,手术-院内死亡组患者V-A ECMO期间三种血制品用量显著升高,非手术-院内死亡组患者新鲜冰冻血浆和血小板输注量也显著上升,这一发现很可能与其高发的出血事件、凝血功能障碍相关,而与ECMO治疗本身无关,但考虑到这是回顾性数据,尚不能确定这一结果是否还与大量输血本身带来的负面影响有关。Aubron等[12]调查了105例成人V-A ECMO患者,非存活组和存活组患者三种血制品用量之间具有统计学差异(P<0.05),这与本研究结果相似。不同亚组之间血制品用量的差异,也提醒临床医师在ECMO建立和管理过程中,应该密切关注ECMO适应证和血制品的应用情况,考虑血制品应用后潜在的风险和输血相关的费用成本。
本研究通过回归分析,红细胞悬液是影响手术组患者死亡率的独立危险因素之一。ECMO期间由于出血、血液稀释和溶血等情况,HCT会下降,为了增加氧供,减少机体缺氧程度,以及尽可能降低ECMO流量,输注红细胞悬液的需求增加,但大量输注红细胞悬液又会增加感染、急性肺损伤以及免疫介导反应等副作用[16],增加死亡风险。Smith等回顾了484例ECMO患儿的输血情况,发现在非心脏ECMO适应证中,红细胞悬液是影响死亡率的独立危险因素(OR 1.024,95% CI 1.004~1.046,P=0.018)[17]。Swol等认为ECMO期间HCT>0.31时会增加死亡率(RR 1.73,95% CI 1.134~2.639),红细胞悬液输注量增加,死亡风险增加[8]。目前为了降低红细胞悬液对生存预后的影响,有研究建议ECMO期间可以采用限制性输血[18]、自体输血等方案,但仍需开展前瞻性研究进一步论证。
血小板输注量是影响手术组患者死亡率的独立危险因素之一。ECMO管路可引起血小板黏附和激活,增加血小板消耗[19],此外,有研究表明ECMO过程中高剪切力可以进一步增强血小板活化,von Will⁃ebrand因子多聚体丢失也会促进血小板功能的缺陷[20-21]。ECMO期间血小板数量显 著 低于ECMO前的数值,这已在既往研究中证实[22]。血小板在ECMO期间的上述变化,是影响患者凝血功能的重要因素之一,血小板数量和功能的下降,既可以促进血栓形成也可导致出血风险增加。Guennec等研究发现ECMO启动时血小板低于100×109/L会增加颅内出血风险,增加死亡率(OR=3.7,95%CI 1.4~9.7,P=0.009)[23]。Karhausen认为术后低的血小板与脑卒中发生显著相关,血小板每降低30×109/L,卒中风险增加12%(95%CI 1.01~1.24;P=0.0255)[24]。此外,血小板也是导致器官炎症反应损伤的因素之一,有研究证实血小板减少会降低机体免疫保护,增加感染率[25]。Kertai等[26]发现冠状动脉旁路移植术后患者的血小板计数不仅和急性肾损伤相关(OR=3.04,95%CI 2.26~4.07;P<0.0001),也与术后短期死亡率存在显著相关性(OR=5.46,95% CI 3.79~7.89;P<0.0001)。本研究发现血小板输注量和手术组院内死亡率相关,主要原因可能是ECMO期间需要大量输血小板的患者往往伴存出血多、凝血障碍或可疑肝素诱导血小板减少症、凝血功能紊乱、炎症反应程度深、病情重等。这也提醒在ECMO管理过程中应该密切监测血小板计数和功能变化,优化管道涂层,保护血小板功能。
本研究存在一定局限性,首先研究仅局限于成人V-A ECMO,样本量有限,且为单中心回顾性数据,影响最终结果的混杂因素仍可能存在;其次,不同单位ECMO插管部位、血制品使用标准、ECMO管路可能存在差异,这在一定程度上限制了本研究结果的普适性。最后,不同单位ECMO期间抗凝强度和抗凝方案存在差异性,本单位的出血管理策略,包括在出血风险高的时候频繁中断抗凝,导致APTT值低于目标或者处于目标值低限,这种保守和目标导向的方法可能会影响血制品用量。
4 结 论
成人V-A ECMO患者血制品用量取决于建立ECMO前的适应证和患者的预后,脱机困难转为ECMO者和院内死亡者血制品用量更高。成人V-A ECMO期间红细胞悬液和血小板输注量是影响手术组患者院内死亡率的独立危险因素。由于影响血制品输入的因素较多,仍需扩大样本量进一步加以验证。

