体外循环膜肺添加一氧化氮的临床应用进展
要惜梦(综述),周成斌(审校)
心肺转流(cardiopulmonary bypass,CPB)易产生缺血再灌注损伤及全身炎症反应,影响器官功能,增加心脏手术围术期并发症的风险。一氧化氮(nitric oxide,NO)是由一氧化氮合成酶以左旋精氨酸为底物,经氧化反应生成的一种具有多种生理活性的小分子化学物质,通过扩张血管,抑制中性粒细胞激活、血小板聚集,以减少多种炎性介质的产生[1-2]。有研究显示NO加入CPB膜肺,通过其气血界面进入血液,不经肺代谢,能改善CPB引起的全身炎症反应[3]。现对CPB膜肺添加NO的临床应用进展做一综述。
1 膜肺气源管路连接NO装置
在空氧混合器和麻醉挥发罐之后的气源管路(图1的①)上增加一个NO气体入口。在气体滤过器和膜肺入口位置前将一个三通管接入气体管路(图1的②),在三通管顶部连接NO采样管道,通过这条采样管道监测膜肺入口处的NO浓度,并通过反馈回路返回到NO装置(图1的③),NO装置可以根据设定的目标浓度精准调整NO输送量,从而达到治疗效果[4]。每个CPB中心可根据自身习惯进行管路调整连接NO装置,但基本连接方式是一致的。
2 不同类型CPB膜肺添加NO的安全性
Bennett等[4]总结前人研究的研究结果显示,在Terumo FX系列膜肺中使用NO没有明确副作用。James等[1]和Checchia等[2]分别使用Terumo FX系列、RX05膜肺未发生相关并发症(表1)。而其他文献中没有指明使用何种类型膜肺,但也未报道副作用。由于CPB膜肺均采用聚丙烯(polypropylene,PP)中空纤维膜编织,因此虽然膜肺品牌、型号不同,但NO都是通过PP中空纤维膜进入血液。现有临床文献显示往膜肺气源中添加NO是可行的。

图1 CPB管路添加NO的图示[4]
3 CPB膜肺添加NO的浓度和时机
在涉及CPB膜肺添加NO的临床研究中,NO使用浓度从20 ppm到80 ppm[1-2,5-7],儿童和成人都能安全使用。已出版文献均未见添加NO后产生任何风险,证实了NO的安全性(表2),多数研究者选择加入低浓度NO(等于或小于20 ppm)以达到治疗目的,但NO理想治疗浓度仍有待进一步研究。
目前对于CPB膜肺添加NO的时机尚无定论。大部分研究者都是在CPB开始同时添加NO。唯有Kamenshchikov等[5]明确提出,应在阻断主动脉,即心肌缺血开始之前补充NO,可更好保护心肌。
4 CPB膜肺添加NO对重要器官的影响
4.1 心脏 研究表明,NO在缺血再灌注损伤的心脏保护机制中起重要作用。冠状动脉旁路移植术患者在NO供体(硝普钠)治疗后促炎性细胞因子下降[5]。缺血再灌注的动物模型中,NO诱导新生血管形成并改善心肌储备功能;通过呼吸机吸入NO可降低心肌损伤标志物并缩小心肌梗死范围[5]。临床研究也显示CPB膜肺中添加NO可以减少CPB过程中的心肌损伤。Checchia等[2]报道8名法洛四联症矫治术患儿在膜肺气源中添加NO,患儿血清炎性因子和心肌损伤标志物减少,机械通气时间和ICU停留时间缩短。一项大型单中心研究表示,CPB膜肺给予NO后可降低心脏术后低心排血量综合征发生率,以2周岁以下的儿童最为明显[1]。Gianetti等[3]研究证明,成人CPB期间膜肺加入NO并联合术后吸入NO,可降低心肌损伤标志物峰值水平。Kamenshchikov等[5]发现冠状动脉旁路移植术患者CPB期间膜肺添加NO,术后血管活性药物的用量减少,间接证明了NO可以预防心肌顿抑和左心室功能不全(表1)。
4.2 肾脏 急性肾损伤(acute kidney injury,AKI)是心脏手术后常见和主要的并发症,与短期和长期的发病率以及死亡率上升相关[6,8]。Checchia等[2]研究发现,患儿CPB期间添加NO,术后利尿剂用量减少,表明该方式可以改善肾脏血管内皮功能,促进液体平衡,提供肾保护。2018年美国心脏协会年会上,Kamenshchikov等[8]公布成人CPB期间膜肺加入NO对肾脏的保护作用,与安慰剂组相比,NO组AKI发生率显著降低。
长时间CPB和心内吸引导致血浆游离血红蛋白(free hemoglobin,FHb)增高是围术期肾损伤的重要危险因素[6]。一项关于多瓣膜置换术的研究中,术中CPB膜肺和术后24 h呼吸机内给予NO,NO与FHb结合生成高铁血红蛋白(methohemoglobin,Met-Hb),可有效地预防AKI并降低长期肾功能不全发生率[6](表1)。
4.3 肺脏 临床上通过呼吸机吸入NO已广泛应用于急性呼吸窘迫综合征和新生儿肺动脉高压等。NO使肺血管内皮细胞环磷酸鸟苷升高从而扩张血管及支气管平滑肌,降低肺动脉高压,改善氧合。CPB膜肺加入NO通过PP中空纤维膜直接进入体循环,抑制中性粒细胞等炎性细胞黏附,中和氧自由基[7],改善肺功能(表1)。Gianetti等[3]在CPB膜肺中加入NO,观察到NO对外周血管阻力没有影响,而肺血管阻力如预期般显著降低。此外,与对照组相比,NO组在动脉血氧饱和度、动脉血氧分压、插管时间、ICU停留时间和术后射血分数等方面表现更优,间接表明CPB期间添加NO可以降低肺损伤,改善肺功能。但一项meta分析[9]的结论显示,围术期吸入NO对接受心脏手术的肺动脉高压患者没有或几乎没有益处。但因其纳入的研究存在高度异质性,且多数研究是通过呼吸机吸入NO,因此评估CPB中膜肺添加NO模式下对患者,特别是肺高压患者的肺功能的影响,仍需大型随机试验。
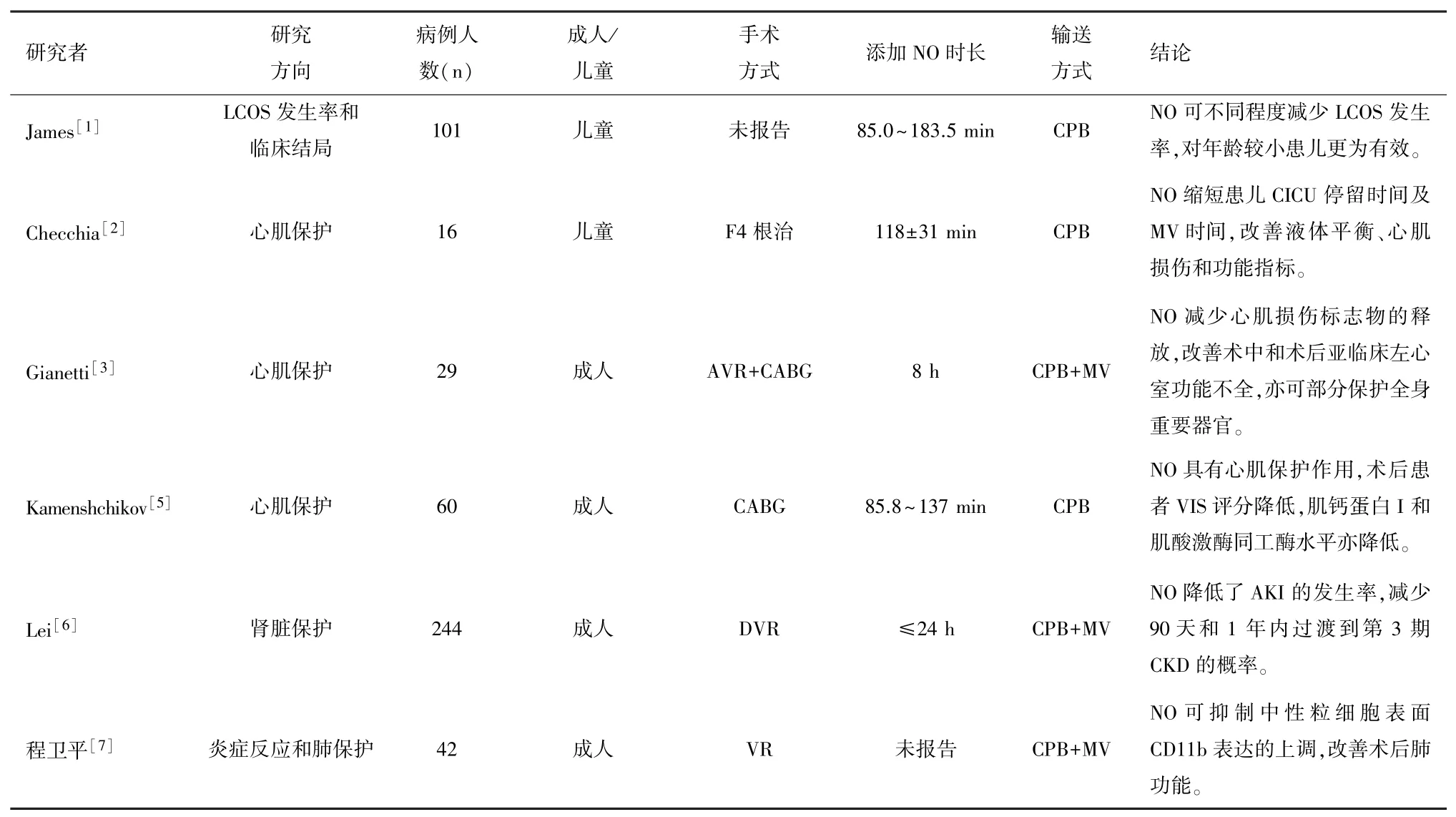
表1 CPB膜肺添加NO的临床研究总结
5 CPB膜肺添加NO的副作用
临床上CPB膜肺加入80 ppm或更低浓度的NO未见明显副作用。理论上使用NO的副作用有Met-Hb血症、二氧化氮(nitrogen dioxide,NO2)、出血及反跳性肺动脉高压(表2)。
5.1 Met-Hb血症 血红蛋白辅基血红素中的亚铁离子易与NO氧化生成三价铁,形成Met-Hb,Met-Hb无法有效携带氧气。低水平Met-Hb天生存在于人类体内,一般低于2%,大于10%被认为有害,称为Met-Hb血症,患者会处于相对缺氧状态,造成机体损害[4]。Gianetti等[3]研究表明,CPB膜肺加入20 ppm(百万分率)NO不会导致患者产生Met-Hb血症。James等[1]研究显示膜肺添加20 ppm NO会对Met-Hb水平产生影响,但不会达到Met-Hb血症水平。甚至术中CPB膜肺加入80 ppm NO,亦未见Met-Hb超过10%[6](表2)。为了预防Met-Hb血症的发生,CPB期间膜肺使用NO时有必要持续监测Met-Hb水平。
5.2 形成NO2在心脏手术CPB高氧分压状态下,NO与O2易形成细胞毒性气体NO2,产生氧自由基,损伤内皮细胞。高浓度的NO2可能导致肺水肿。临床研究中NO2浓度最高达1.8 ppm,未见明确不良影响(表2)。NO2的水平与NO浓度呈线性相关。为避免NO2的细胞毒性,NO使用最小有效治疗浓度且持续监测NO2浓度[12]。
5.3 出血 研究表明NO可抑制血小板的聚集、黏附,具有抗血栓性质[2]。动物试验观察到,通过呼吸机吸入NO后延长出血时间,理论上CPB膜肺添加NO存在潜在出血风险,然而,目前临床研究中并没有监测到凝血或出血的指标变化[2],也没有CPB膜肺添加NO治疗后的患者大出血的文献报道(表2)。因此NO对临床凝血结果是否有影响仍需进一步研究。
5.4 反跳性肺动脉高压 通过呼吸机接受NO治疗,撤离NO时会引起肺高压反跳现象。而NO通过CPB膜肺的气血界面直接进入全身循环,不直接经过肺代谢,能更有效地对全身器官发挥作用[3],且NO进入循环后会很快失活,现有临床研究显示膜肺气源撤离NO时不会引起肺高压反跳。
6 小结
CPB膜肺中添加NO增加了NO使用的途径。临床研究显示对心脏和肾脏有保护作用,对肺脏的保护作用不明确。针对神经系统保护的研究局限于呼吸机吸入NO[8,11]以及注射NO前体,CPB膜肺气源加入NO的模式没有相关研究。该技术临床简单易行、副作用小,但CPB期间NO的供给系统和监测系统仍值得重视。目前该技术仍处于探索阶段,对于膜肺加入NO的时机、时长、浓度、不同膜肺的通透性,以及成人与儿童患者使用的区别、短期CPB期间使用与围术期间长时间使用的区别等诸多方面,仍需进一步的研究。

