不同时机应用氨甲环酸对主动脉瓣置换术临床疗效及血栓弹力图评估
朱叶苇,侯天亮,艾克拜尔·努尔买买提,杨 龙
出血是心脏外科手术危及生命的主要并发症之一,手术及非手术原因引起的出血常常会导致不良后果及死亡率的增加。心脏手术心肺转流(cardiop⁃ulmonary bypass,CPB)过程影响凝血和纤溶,血液与非内皮化的CPB管路接触会释放组织因子,进而激活细胞和体液系统,包括凝血级联反应、补体和纤溶系统、血小板和白细胞的激活导致水肿、组织损伤、纤溶亢进和消耗性凝血障碍。围术期大剂量肝素、抗凝药物等因素极易导致机体凝血紊乱从而增加出血及血栓形成的概率。因此,心脏手术围术期血液管理至关重要,在有效降低围术期出血的基础上,还应特别关注术后静脉血栓栓塞(venous throm⁃boembolism,VTE)并发症[1]。氨甲环酸(tranexamic acid,TXA)减少心脏手术围术期出血和异体输血的作用,已被大量临床研究所证实[2-3]。目前,有关TXA不同剂量和给药方式(主要是静脉、局部和联合给药)的研究报道较多[4-5]。但不同给药时机是否对纤溶系统、围术期失血量和输血需求产生影响,以及CPB心脏手术TXA最佳使用时机尚存在争议。血栓弹力图(thrombelastography,TEG)可动态监测凝血和纤维蛋白溶解的全过程,识别凝血异常的原因,本文TEG监测和分析围术期凝血和纤溶变化,探讨心脏手术中TXA不同给药时机对凝血、纤溶以及围术期失血的影响,为其临床应用的安全性和有效性提供依据。
1 资料与方法
1.1 一般资料 本研究为随机对照、双盲、单中心临床试验,所有患者均签署书面知情同意书。以2018年1月至2019年12月于本院心脏外科就诊,择期行CPB主动脉瓣置换术的患者为研究对象,最终纳入符合研究标准的人员共68例。纳入标准:①NYHA心功能Ⅱ~Ⅲ级,1个月内无急性心梗史;②首次进行CPB心脏手术;③术前凝血酶原时间(pro⁃thrombin,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、TEG、血小 板(platelet,PLT)无异常;④无慢性贫血、术前血红蛋白(hemoglobin,Hb)>100 g/L。⑤单纯主动脉瓣置换术且同一个医疗组的手术。排除标准:①对TXA药物过敏者;②患有先天性凝血功能紊乱、获得性血液系统疾病及免疫系统疾病;③既往有深静脉血栓(deep venous thrombosis,DVT)或肺栓塞(pulmonary embolism,PE)病史者;④术前24 h使用过肝素、术前14 d使用过华法令、阿司匹林者;⑤肝肾功能严重不良者。
1.2 研究方法 将纳入研究对象用随机数字表法随机分为A组(n=33)和B组(B=35),随机序列由不参与麻醉的护士保管。麻醉和CPB均按照统一标准流程操作。所有患者于术前30 min肌注0.1 mg/kg吗啡,麻醉诱导给予静脉注射舒芬太尼1.0~1.5μg/kg、罗库溴铵1 mg/kg、咪达唑仑0.1~0.2 mg/kg或诱导剂依托咪酯0.2~0.3 mg/kg,术中持续输注丙泊酚6~8 mg/(kg·h)和罗库溴铵0.6~1 mg/(kg·h),间断推注舒芬太尼维持麻醉深度。麻醉诱导后A组静脉给予负荷量TXA 15 mg/kg(10 min内输注),继以10 mg/(kg·h)持续泵注,至手术结束;B组在CPB转机结束,鱼精蛋白中和肝素10 min后,静脉注射TXA负荷剂量15 mg/kg(10 min内输注),继以10 mg/(kg·h)持续泵注至手术结束。术中所有结局指标都由麻醉助手实时记录。CPB中维持体温在32~34℃,肝素化使用肝素3 mg/kg,并根据活化凝血时间(activated clotting time,ACT)测量结果间断补充肝素,维持ACT>480 s。CPB结束后,两组患者均根据肝素初始计量1∶1.5~1.8给予鱼精蛋白拮抗肝素,剂量保证ACT达到术前的基准值。
1.3 观察指标 ①异体血输血量和围术期失血量(术中失血量+术后心包纵隔引流量);②Hb下降差值(术前Hb-术后Hb较低值);③异体输血:按照《心脏外科手术血液管理专家共识(2015版)》及《围术期输血指南》,CPB过程中Hb<60 g/L,CPB后Hb<70 g/L输注红细胞;新鲜冰冻血浆输注时机:国际标准化比值>1.4或者APPT>50 s或者TEG检査中R时间>10 min;PLT≤50×109/L,输注PLT;纤维蛋白原(fibrinogen,FIB)≤1 g/L输注FIB;④血栓形成率:术前彩超未发现血栓,术后发现PT或DVT;⑤分别于以下时点:术前(T0)、术后即刻(T1)、术后24 h(T2)、术后3 d(T3)抽全血,测定各组患者的TEG、凝血功能、血常规,并进行分析比较。
1.4 统计学处理 采用SPSS 22.0统计学软件进行分析,计数资料用(%)表示,组间比较采用χ2检验或确切概率法;计量资料用(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料比较 两组患者基线资料未见统计学差异(P>0.05),见表1。
2.2 围术期失血量、输血率及血栓事件比较 A组较B组术后24 h引流量显著减少(P<0.05)。B组围术期总失血量及最大Hb下降值较A组高,但均无统计学差异(P>0.05)。两组各有4例输血,输血率比较无统计学意义(P>0.05)。A组有1例发生下肢肌间VTE。见表2。
2.3 两组凝血功能比较 B组与A组术前(T0)凝血功能无统计学差异;在T1时点纤维蛋白原降解产物(fibrinogen degradation products,FDP)、D-二聚体(D-dimer,DD)B组较A组显著增加(P<0.05);T2时点,A组FIB、DD较B组显著减少(P<0.05);其余时点组间比较均无统计学意义。见表3。
2.4 两组TEG比较 结果显示两组TEG各指标在相应时点数值均无统计学差异(P>0.05)。见表4。
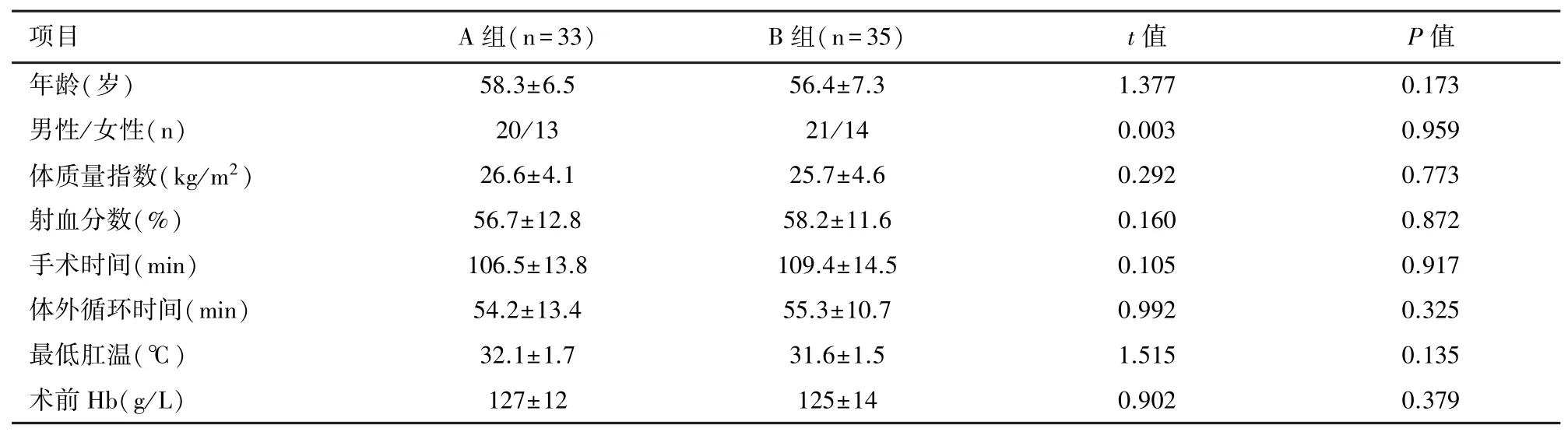
表1 两组患者的一般资料对比

表2 两组患者围术期失血量、输血率及血栓发生率
表3 两组患者不同时间凝血功能比较(±s)

表3 两组患者不同时间凝血功能比较(±s)
?
表4 两组患者不同时间TEG比较(±s)
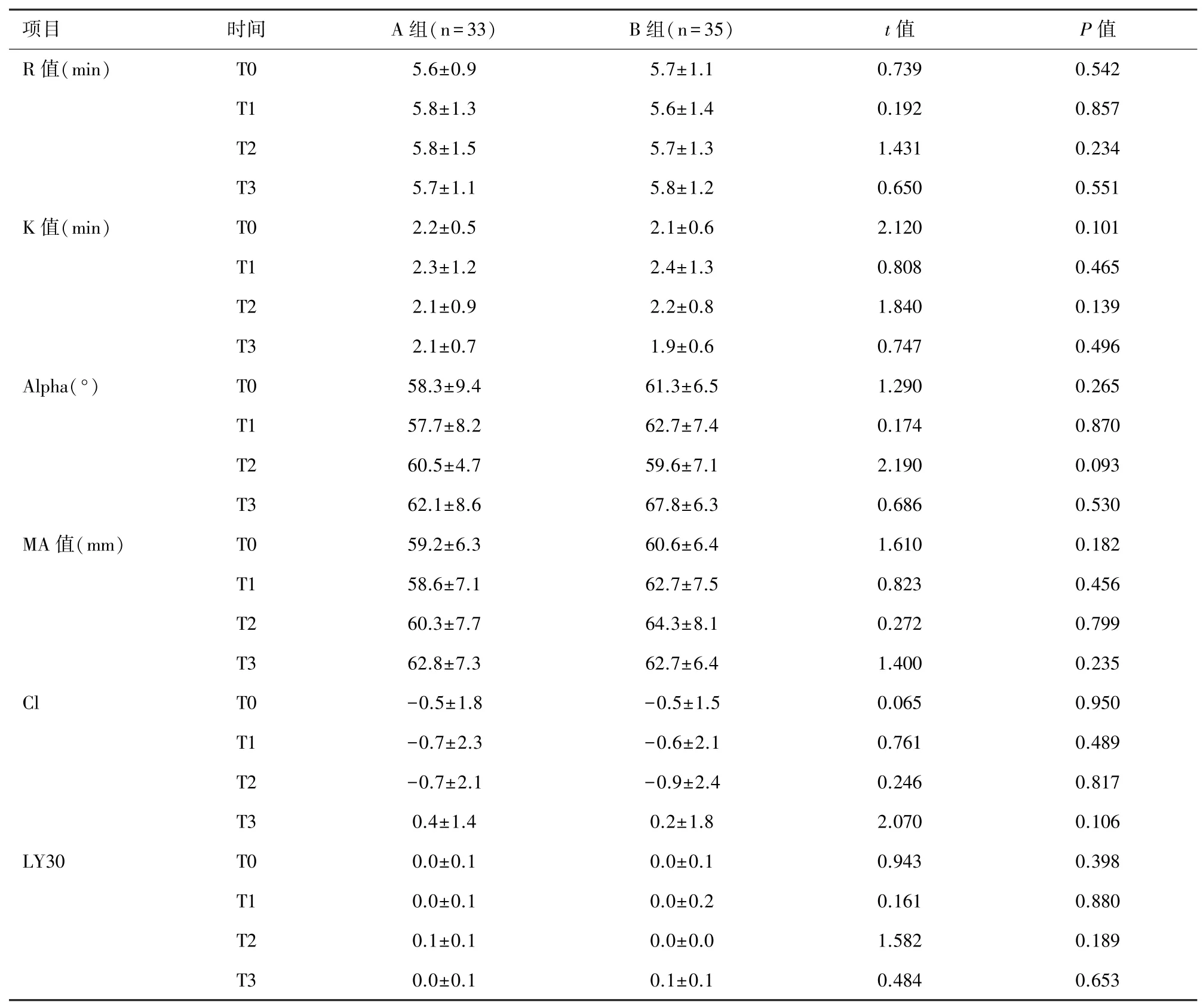
表4 两组患者不同时间TEG比较(±s)
注:CI:凝血指数;LY30:MA后30 min血凝块幅度减少速率。
?
3 讨 论
心脏外科手术因其手术创伤大、CPB、低温以及术中肝素化等原因,常导致不同程度的出血。CPB时体内的红细胞、凝血因子及PLT等有形成分被破坏,PLT数量及功能降低,肝素反弹及血液稀释等因素,极易引起患者术后异常出血,导致出血性事件(二次开胸止血、消化道出血、出血性卒中)的发生,严重威胁患者生命安全[6]。因此,对心脏手术患者实施有效的血液保护至关重要,其中抗纤溶药物便是临床医师血液管理的有力措施[7]。最初用于临床的抑肽酶,由于价格高昂、肾毒性及过敏风险等退市。TXA因其具有与赖氨酸相似的化学结构,可逆性结合纤溶酶原和纤溶酶的赖氨酸结合位点,从而阻断后者与纤维蛋白特异性赖氨酸残基的相互作用,抑制纤维蛋白分解,进而抑制纤溶。此外,体内单核细胞、PLT等含有许多纤溶酶原受体,当纤溶酶原与之结合后被激活,导致纤溶亢进;TXA与纤溶酶原结合,抑制其活性来发挥作用[8]。TXA对于纤溶亢进所致的各种出血具有显著的止血效果,同时有研究发现TXA具有调控免疫反应、降低中性粒细胞弹性蛋白酶,从而减轻术后炎症的作用[9-10]。
由于CPB非生理过程常引起血液系统病理生理改变,如何平衡凝血和纤溶成为临床医生关注的焦点。CPB后,血液自人体进入人工心肺机,打破机体凝血-纤溶系统平衡,凝血系统被激活为促凝状态,TXA因抑制FIB溶解,FIB与凝血酶具有高亲和力,从而吸附凝血酶,可促使局部血凝块的形成,有形成微血栓的风险;CPB停机后,缺少了CPB的刺激,机体由促凝状态转为抗凝状态,即纤溶亢进;从理论上讲,在CPB结束后给予TXA可对抗纤溶亢进,且不增加前期微血栓形成的风险。目前,有关TXA给药时间窗尚存在一定争议[11-12],本研究分别在CPB前、CPB后使用TXA,观察比较是否对凝血系统及术后血栓事件产生影响。
结果显示:A组较B组患者术后24 h引流量明显减少、DD在术后即刻和术后24 h时点明显低于B组,其余凝血功能指标的影响无统计学意义。其原因可能是静脉注射TXA在健康个体血药浓度达峰于1 h内,而口服TXA血药浓度峰值在3 h出现,TXA半衰期约80 min,生物利用度达33%~34%,TXA通过肾小球滤过消除,第一小时可代谢30%,24 h内90%可经肾脏排泄消除[13-14]。A组在CPB开始前即给予治疗量TXA,总体给药时间和剂量高于B组,在CPB激活纤溶系统前便可发挥药效,较B组在CPB后纤溶系统亢进再使用TXA可更加有效抑制DD上升。最新研究结果表明,与非出血患者相比,出血者的DD及纤溶酶-抗纤溶酶复合物升高,应用TXA可减弱两种产物升高程度[15],与本试验观察一致。另外,由于CPB致使血浆FIB含量和活力受损是术后出血的一个重要因素[16],本研究中两组患者FIB在T1时点较T0均呈现下降趋势,在T2时点B组较A组FIB有明显升高,其余时间点均未见显著差异,可能是由于经历CPB急性等容稀释对凝血功能的影响,产生不同程度FIB下降,在术后第1天逐渐恢复,也说明机体纤溶活动增强,本试验中两组术后24 h引流量差异可能与上述因素有关。然而两组在术中出血量、围术期失血量、最大Hb下降值及输血率未见显著性差异(P>0.05),以此推断在CPB前使用TXA可更加有效抑制继发性纤溶亢进,减少术后早期出血。
目前国内外很多临床研究证实TXA对于CPB心脏手术的血液保护作用,但同时,TXA由于其特有的抗纤溶作用,理论上存在增加血栓事件的风险(如DVT、心梗、脑栓塞等)。血栓栓塞并发症最常发生在心脏瓣膜置换术后早期,故早期即需要进行监测和抗凝治疗,以预防血栓栓塞事件的发生。Myles PS等有关冠状动脉旁路移植手术的随机对照试验显示,围术期应用TXA与空白对照组比较,不仅降低出血风险,而且未观察到术后30 d血栓事件的增加[17]。刘静等一项回顾性研究发现,即使心梗、缺血性脑卒中的发生率较低,但TXA仍有增加此不良事件的倾向[18]。
TEG利用血栓弹力描绘特殊图形,动态反映凝血全过程[19]。TEG中R值主要体现凝血因子质量,血液高凝状态时R值减小;K值是形成20 mm血凝块所需时间,反映网织速度,理论上与FIB呈负相关;MA值反映血凝块最大强度和稳定性,受PLT数量和功能影响较大,MA值可作为预测VTE发生的风险指标。伍娟等一项回顾性研究表明TEG较常规凝血功能检测对老年心脏手术患者术后VTE并发症有更高的预测价值,且DD在血栓诊断依然具有独特优势[20]。因此,临床上在TXA最佳使用方案的研究中,应将TEG与FDP、DD联合监测纤溶,以指导抗纤溶药物的使用[21]。Faraoni等研究报道了不同剂量TXA与空白对照比较,均未发现明显纤溶亢进改变(LY30>7.5%为标准),与本研究结果相似,尽管两组早期FIB及DD有显著差异,但两组TEG差异均未见统计学意义(P>0.05),同时本研究两组患者血栓发生率亦未见统计学差异。
然而,本研究尚存在一定局限性。首先,本试验只纳入了主动脉瓣置换术患者,研究样本量偏少且为单中心研究,限制了研究的扩展性,只适用于CPB心脏手术。另外心脏机械瓣膜置换术后早期即需要进行抗凝治疗,以预防栓塞事件,以上各因素对本研究中血栓发生率及实验室检查结果可能存在一定干扰。此外,由于TEG的应用,围术期输血率尚不能简单看作TXA单因素作用结果。因此,尚需要更大范围多中心大样本进一步深入探索[22]。
综上,在CPB转机前应用TXA可更加有效抑制纤溶,减少心脏术后早期出血,且不增加术后血栓发生率,同时TEG是CPB心脏手术围术期凝血功能监测的可靠指标,对实施血液保护具有重要临床价值。

