LncRNA FEZF1-AS1靶向miR-1254调控肝癌细胞的生物学行为
田贵金 刘军红 陈 晶 张小龙 杨志森
河北省邯郸市第一医院综合外科1(056002) 河北省武安市第一人民医院产科2
背景:肝癌是我国常见的恶性肿瘤之一,严重威胁人们生命健康。目前,越来越多研究证实长链非编码RNA(LncRNA)在癌症发生、进展中的作用。目的:探讨LncRNA FEZF1-AS1靶向miR-1254调控肝癌细胞生物学行为的分子机制。方法:采用qRT-PCR法检测肝癌组织和细胞株中FEZF1-AS1和miR-1254表达。将肝癌Hep3B细胞分为NC组、si-Lnc FEZF1-AS1组、si-con组、miR-1254组、miR-con组、si-Lnc FEZF1-AS1+anti-miR-con组、si-Lnc FEZF1-AS1+anti-miR-1254组。MTT法检测细胞活力,流式细胞术检测细胞凋亡,Transwell实验检测细胞迁移和侵袭能力,双萤光素酶报告基因实验验证FEZF1-AS1与miR-1254的靶向调控关系,蛋白质印迹法检测相关蛋白的表达。结果:肝癌组织和3种肝癌细胞株中FEZF1-AS1表达显著高于相应癌旁组织和正常细胞,miR-1254表达显著降低。转染si-Lnc FEZF1-AS1或miR-1254 mimics均可显著抑制Hep3B细胞Ki-67、N-cadherin和Vimentin表达,促进cleaved caspase-3和E-cadherin蛋白表达,抑制细胞增殖、迁移和侵袭能力,抑制EMT发生,促进细胞凋亡。FEZF1-AS1靶向负调控miR-1254表达。转染si-Lnc FEZF1-AS1可抑制PI3K/AKT信号通路活化。转染anti-miR-1254可逆转转染si-Lnc FEZF1-AS1对Hep3B细胞增殖、迁移、侵袭、EMT、凋亡以及PI3K/AKT信号通路的影响。结论:LncRNA FEZF1-AS1在肝癌患者中的表达上调。沉默LncRNA FEZF1-AS1通过靶向miR-1254抑制肝癌细胞增殖、迁移、侵袭以及EMT发生,促进细胞凋亡,其机制与抑制PI3K/AKT信号通路活化有关。
肝癌是我国最常见的恶性肿瘤之一[1]。目前,手术切除和肝移植是肝癌早期的主要治疗策略,但由于肝癌细胞迅速生长且具有高侵袭性,多数肝癌患者确诊时已处于晚期[2]。尽管索拉非尼和程序性死亡受体-1(PD-1)抑制剂等在肝癌治疗中取得了较好的疗效,但患者的长期生存率仍较低[3-5]。因此,开发新的肝癌治疗方法至关重要。最近研究表明,长链非编码RNA(LncRNA)FEZ家族锌指1反义RNA1(FEZF1-AS1)是人类癌症发生的关键调控因子。FEZF1-AS1在胃癌和结肠癌等恶性肿瘤中表达上调,其异常表达与患者的临床特点有关,并通过多种潜在机制调控细胞增殖、凋亡、侵袭和迁移[6]。有研究显示FEZF1-AS1通过激活JAK2/STAT3信号通路促进肝癌细胞侵袭和上皮-间质转化(EMT)[7],但FEZF1-AS1调控肝癌细胞生物学行为的分子机制尚未完全阐明。MiR-1254是一种癌症相关基因,有研究证实miR-1254在胃癌中表达下调,过表达miR-1254可明显抑制胃癌细胞增殖、迁移和侵袭[8]。LncRNA DCST1反义RNA1(DCST1-AS1)通过吸附miR-1254调控FAIM2表达来促进肝癌细胞增殖和生长[9]。生物信息学预测显示miR-1254是FEZF1-AS1的潜在靶基因,但目前仍未明确FEZF1-AS1是否通过调控miR-1254表达影响肝癌细胞生物学行为。本研究通过在肝癌细胞中干扰FEZF1-AS1或miR-1254表达,旨在探讨FEZF1-AS1在肝癌中的生物学功能及其调控机制。
材料与方法
一、实验材料
收集2015年3月—2018年10月于邯郸市第一医院进行外科手术切除的原发性肝癌组织及其对应的癌旁组织56例。其中男30例,女26例;年龄35~65岁,中位年龄58岁。诊断依据肝穿刺活检、CT检查等确诊。所有患者术前均未接受过化疗、放疗等抗肿瘤治疗。手术切除的标本-80 ℃保存。
人肝永生化细胞THLE-2、肝癌细胞株Hep3B、Huh7、MHCC97L购自中国典型培养物保藏中心;RPMI-1640培养基、DMEM培养基均购自美国Gibco公司;Lipofectamine 2000购于美国Invitrogen公司;MTT试剂盒购于美国Sigma公司;细胞凋亡检测试剂盒购于大连美仑生物技术有限公司;逆转录试剂盒、SYBR Green qPCR Master Mix购于宝生物工程(大连)有限公司;Transwell小室和基质胶购于美国BD公司;双萤光素酶报告基因检测试剂盒、TRIzol试剂、BCA试剂盒购于上海碧云天生物技术有限公司;FEZF1-AS1小干扰RNA(si-Lnc FEZF1-AS1)、小干扰RNA对照(si-con)、miR-1254模拟物(miR-1254 mimics)、模拟物对照(miR-con)、miR-1254抑制物(anti-miR-1254)、抑制物对照(anti-miR-con)、空载体质粒(pcDNA)、FEZF1-AS1过表达载体(pcDNA-FEZF1-AS1)、野生型萤光素酶报告基因载体(WT-FEZF1-AS1)以及突变型萤光素酶报告基因载体(MUT-FEZF1-AS1)由生工生物工程(上海)股份有限公司提供;鼠源Ki-67、E-cadherin、N-cadherin和Vimentin抗体购于美国Santa Cruz公司。兔源cleaved caspase-3抗体、鼠源PI3K抗体、兔源AKT抗体、二抗购于美国Abcam公司;兔源p-PI3K抗体和兔源p-AKT购于美国CST公司。
二、实验方法
1. 细胞培养:采用RPMI-1640培养基培养THLE-2细胞,采用含10%胎牛血清和1%青链霉素的DMEM培养基分别培养肝癌Hep3B、Huh7和MHCC97L细胞,5% CO2、37 ℃培养箱中培养。每周传代2次,取对数生长期细胞进行后续实验。
2. 细胞转染和实验分组:利用脂质体转染法分别将si-Lnc FEZF1-AS1、si-con、miR-1254 mimics、miR-con转染Hep3B细胞,依次记为si-Lnc FEZF1-AS1组、si-con组、miR-1254组、miR-con组。转染48 h后,qRT-PCR法检测转染效果,随后行后续研究。将正常培养的Hep3B细胞作为NC组。为进一步验证LncRNA FEZF1-AS1是否通过调控miR-1254表达来影响肝癌细胞的生物学行为,将si-Lnc FEZF1-AS1分别与anti-miR-con、anti-miR-1254共转染Hep3B细胞,分别记为si-Lnc FEZF1-AS1+anti-miR-con组、si-Lnc FEZF1-AS1+anti-miR-1254组,转染48 h,检测细胞的生物学行为变化。
3. qRT-PCR法检测FEZF1-AS1和miR-1254表达:收集肝癌组织、癌旁组织、THLE-2细胞、Huh7细胞、MHCC97L细胞以及各组转染后的Hep3B细胞,以TRIzol试剂提取总RNA,反转录为cDNA,行qRT-PCR。FEZF1-AS1引物上游:5’-AGA GGC TAT GAC TCA GGG TT-3’,下游:5’-TGT TGC TCC ACA GTA AAG GT-3’;内参β-actin引物上游:5’-GCA TCG TCA CCA ACT GGG AC-3’,下游:5’-ACC TGG CCG TCA GGC AGC TC-3’;miR-1254引物上游:5’-AGC CTG GAA GCT GGA GCC TGC AGT-3’,下游:5’-GCG AGC ACA GAA TTA ATA CGA C-3’;内参U6引物上游:5’-CTC GCT TCG GCA GCA CA-3’,下游:5’-AAC GCT TCA CGA ATT TGC GT-3’。引物均由生工生物工程(上海)股份有限公司合成。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共35个循环。采用2-ΔΔCt法计算目的基因相对表达量。
4. MTT实验检测细胞活力:将各组Hep3B细胞按2×103个/孔接种于96孔板,分别于转染24、48、72 h时每孔加入20 μL MTT溶液(5 mg/mL),培养箱孵育4 h,弃上清液,再向每孔加入150 μL DMSO,继续孵育2 h,全自动酶标仪测定490 nm波长处的吸光度(A)值(用空白孔进行调零)。
5. 流式细胞术检测细胞凋亡:转染48 h,胰酶消化后离心收集各组细胞,PBS洗涤,加入结合缓冲液,重悬细胞,使细胞浓度达1×106个/mL。吸取100 μL细胞悬液加入流式管,加入5 μL Annexin V-FITC和5 μL PI,混匀后室温避光孵育15 min。每管加入400 μL 结合缓冲液,混匀后上流式细胞仪检测细胞凋亡情况。
6. Transwell实验检测细胞迁移、侵袭能力:转染48 h后消化细胞,PBS洗涤,用无血清培养基重悬细胞,调整细胞密度为3×105个/mL。取200 μL细胞悬液加入Transwell小室,500 μL含10%胎牛血清的培养基加入24孔板下室,常规培养12 h。用棉签擦去上室内的细胞,行0.1%结晶紫染色,将Transwell小室倒置于显微镜下进行观察和拍照,随机选取5个视野,计数迁移细胞,取均值。
采用包被基质胶的小室,使用前将小室放入24孔板,向上室加入300 μL预温的无血清培养基,室温下静置15 min,使基质胶水化后吸去剩余培养液。其余步骤同上述细胞迁移实验,显微镜下随机选取5个视野计数侵袭细胞数,取均值。
7. 双萤光素酶报告基因实验:利用脂质体转染法将含FEZF1-AS1-3’-UTR的WT-FEZF1-AS1以及MUT-FEZF1-AS1分别与miR-1254 mimics、miR-con共转染Hep3B细胞,48 h后根据双萤光素酶报告基因检测系统测定Hep3B细胞的萤光素酶活性。随后将si-con、si-Lnc FEZF1-AS1、pcDNA、pcDNA-FEZF1-AS1分别转染Hep3B细胞,转染48 h,以qRT-PCR法检测miR-1254表达变化。
8. 蛋白质印迹法检测相关蛋白的表达:提取各组细胞总蛋白,BCA法定量蛋白浓度。取30 μg蛋白行SDS-PAGE电泳,随后将蛋白转移至PVDF膜。加入Ki-67(工作浓度1∶500)、cleaved caspase-3(工作浓度1∶500)、E-cadherin(工作浓度1∶500)、N-cadherin(工作浓度1∶500)、Vimentin(工作浓度1∶500)、鼠源PI3K(工作浓度1∶1 000)、兔源p-PI3K(工作浓度1∶1 000)、兔源AKT(工作浓度1∶500)、p-AKT抗体(工作浓度1∶2 000),4 ℃孵育过夜,加入二抗(工作浓度1∶1 000),ECL显影,曝光,摄片,应用凝胶成像分析系统和Image J软件分析各条带灰度值。
三、统计学分析
结 果
一、LncRNA FEZF1-AS1和miR-1254在肝癌患者和细胞株中的表达
与癌旁组织相比,肝癌组织中FEZF1-AS1表达显著升高,miR-1254表达显著降低(P<0.05;表1)。与THLE-2细胞相比,3种肝癌细胞(Hep3B、Huh7、MHCC97L)中FEZF1-AS1表达显著升高,而miR-1254表达显著下降(P<0.05;表2)。其中FEZF1-AS1在Hep3B细胞中的表达相对较高,因而选择Hep3B细胞行后续实验研究。
二、沉默LncRNA FEZF1-AS1可抑制肝癌Hep3B细胞增殖和诱导细胞凋亡
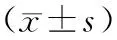
表1 LncRNA FEZF1-AS1和miR-1254在肝癌患者组织中的表达
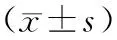
表2 LncRNA FEZF1-AS1和miR-1254在正常肝细胞和肝癌细胞中的表达
与si-con组相比,si-Lnc FEZF1-AS1组FEZF1-AS1表达显著下降(P<0.05),表明转染成功。与si-con组相比,si-Lnc FEZF1-AS1组Hep3B细胞在24、48、72 h的细胞活力显著降低,细胞凋亡率显著升高,Ki-67蛋白表达显著降低,cleaved caspase-3蛋白表达显著升高(P<0.05;表3)。
三、沉默LncRNA FEZF1-AS1可抑制肝癌Hep3B细胞迁移、侵袭和EMT发生
与si-con组相比,si-Lnc FEZF1-AS1组Hep3B细胞迁移、侵袭细胞数目显著降低,E-cadherin蛋白表达显著升高,N-cadherin和Vimentin蛋白表达显著降低(P<0.05;表4)。
四、LncRNA FEZF1-AS1靶向调控miR-1254表达
利用靶基因预测软件DIANA发现FEZF1-AS1的3’-UTR与miR-1254存在部分互补序列(图1)。双萤光素酶报告实验显示,miR-1254 mimics+WT-FEZF1-AS1共转染组萤光素酶活性显著低于miR-con+WT-FEZF1-AS1共转染组(P<0.05);miR-1254 mimics+MUT-FEZF1-AS1共转染组萤光素酶活性与miR-con+MUT-FEZF1-AS1共转染组相比无明显差异(表5)。qRT-PCR法结果显示,与si-con组相比,si-Lnc FEZF1-AS1组miR-1254表达显著升高;与pcDNA组相比,pcDNA-FEZF1-AS1组miR-1254表达显著降低(P<0.05;图2)。说明LncRNA FEZF1-AS1靶向负调控miR-1254表达。
五、过表达miR-1254抑制肝癌细胞Hep3B增殖、迁移和侵袭并诱导细胞凋亡
与miR-con组相比,miR-1254组miR-1254表达显著升高(P<0.05),表明转染成功。与miR-con组相比,miR-1254组24、48、72 h的Hep3B细胞活力显著降低,迁移、侵袭细胞数目显著降低,细胞凋亡率显著升高,Ki-67、N-cadherin和Vimentin蛋白表达显著降低,cleaved caspase-3和E-cadherin蛋白表达显著升高(P<0.05;表6、表7)。
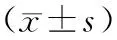
表3 沉默 LncRNA FEZF1-AS1可抑制肝癌Hep3B细胞增殖和诱导细胞凋亡

表4 沉默LncRNA FEZF1-AS1可抑制肝癌Hep3B细胞迁移、侵袭和EMT发生

图1 LncRNA FEZF1-AS1与miR-1254存在互补序列
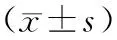
表5 双萤光素酶报告实验

*与si-con组比较,P<0.05;#与pcDNA组比较,P<0.05
六、干扰miR-1254可部分逆转沉默LncRNA FEZF1-AS1对肝癌细胞Hep3B的影响
与si-con组相比,si-Lnc FEZF1-AS1组miR-1254表达显著升高,24、48、72 h的细胞活力显著降低,迁移、侵袭细胞数目显著降低,细胞凋亡率显著升高,Ki-67、N-cadherin和Vimentin蛋白表达显著降低,cleaved caspase-3和E-cadherin蛋白表达显著升高;与si-Lnc FEZF1-AS1+anti-miR-con组相比,si-Lnc FEZF1-AS1+anti-miR-1254组miR-1254表达显著降低,24、48、72 h的细胞活力显著增强,迁移、侵袭细胞数目显著增高,细胞凋亡率显著降低,Ki-67、N-cadherin和Vimentin蛋白表达显著升高,cleaved caspase-3和E-cadherin蛋白表达显著降低(P<0.05;表8、表9)。
七、干扰miR-1254可部分逆转沉默LncRNA FEZF1-AS1对PI3K/AKT信号通路的影响
与si-con组相比,si-Lnc FEZF1-AS1组肝癌细胞p-PI3K和p-AKT表达显著降低;与si-Lnc FEZF1-AS1+anti-miR-con组相比,si-Lnc FEZF1-AS1+anti-miR-1254组p-PI3K和p-AKT表达显著升高(P<0.05;图3)。
讨 论
肝癌是一种全球性常见肿瘤,具有症状不典型、恶性程度高、侵袭转移率高、预后差等特点。肝癌的发病机制非常复杂,涉及多个基因和信号通路。阐明肝癌发生、发展的机制对开发新的治疗策略至关重要。

表6 过表达miR-1254可抑制肝癌Hep3B细胞增殖和诱导细胞凋亡

表7 过表达miR-1254可抑制肝癌Hep3B细胞迁移、侵袭和EMT发生
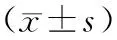
表8 干扰miR-1254和沉默FEZF1-AS1对肝癌Hep3B细胞增殖和凋亡的影响
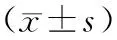
表9 干扰miR-1254和沉默FEZF1-AS1对肝癌Hep3B细胞迁移、侵袭和EMT发生的影响

1 Da=0.992 1 u
LncRNA通过在转录、转录后和表观遗传学水平调控基因表达,广泛参与疾病进展的调节。近年来,随着对肝癌发生机制的深入研究,已发现多种具有预测肝癌预后潜力的LncRNA。Pan等[10]发现肝细胞癌中LncRNA PDPK2P高表达且与患者的病理特征和严重程度有关;Yang等[11]的研究表明LncRNA SNHG7表达升高与进展期肝癌、肿瘤分级和血管浸润呈正相关,与预后呈负相关;LncRNA PVT1表达上调是进行肝切除和肝移植患者复发的标志[12]。最近研究[13]指出,FEZF1-AS1在结肠癌组织和细胞中表达上调,抑制FEZF1-AS1表达可明显抑制结肠癌细胞迁移、侵袭和增殖能力,抑制肿瘤生长。本研究发现,肝癌组织和细胞中FEZF1-AS1表达显著升高,沉默FEZF1-AS1可抑制肝癌细胞增殖、迁移和侵袭能力,促进细胞凋亡。转移是癌症的恶性生物学行为之一,EMT是诱导癌细胞转移的关键过程。EMT发生后上皮表型标志物表达下降,间充质表型标志物增多[14]。本研究结果显示沉默FEZF1-AS1可抑制肝癌细胞的EMT过程。由此可见,FEZF1-AS1在肝癌中具有致癌作用,但发挥作用的分子机制尚不清楚。
近年研究发现LncRNA通过发挥miRNA海绵的作用,降低靶miRNA表达间接调控基因或mRNA功能。已有研究证实FEZF1-AS1在口腔鳞癌、胰腺导管腺癌、乳腺癌等多种癌症中与不同miRNA包括miR-196a、miR-107、miR-30a等相互作用调控肿瘤进展[15-17]。通过靶基因数据库预测显示,miR-1254是FEZF1-AS1的靶基因。进一步研究发现FEZF1-AS1靶向负调控miR-1254表达。过表达miR-1254可抑制肝癌细胞增殖、迁移和侵袭能力以及EMT发生,促进细胞凋亡,这与沉默FEZF1-AS1的抗肿瘤作用相一致。此外,本研究发现干扰miR-1254表达可逆转沉默FEZF1-AS1对肝癌细胞增殖、迁移、侵袭、EMT发生以及凋亡的影响。提示FEZF1-AS1可能通过靶向miR-1254在肝癌进展中发挥促癌作用。与Chen等[9]发现DCST1-AS1通过吸附miR-1254促进肝癌进展的结果基本一致。
PI3K/AKT信号通路可调控细胞增殖、迁移、侵袭和凋亡,与肝癌的发生、发展密切相关[18]。本研究发现沉默FEZF1-AS1后p-PI3K和p-AKT表达显著降低,PI3K/AKT信号通路受到抑制,而干扰miR-1254表达则逆转沉默FEZF1-AS1对PI3K/AKT信号通路的影响。表明FEZF1-AS1通过吸附miR-1254调控PI3K/AKT信号通路来参与肝癌进展。
综上所述,LncRNA FEZF1-AS1在肝癌中表达上调,miR-1254表达下调。沉默LncRNA FEZF1-AS1通过调控miR-1254表达可抑制肝癌细胞增殖、迁移和侵袭,促进肝癌细胞凋亡,其机制与抑制PI3K/AKT信号通路活化有关。上述研究结果为阐述肝癌发病机制的复杂调控网络提供了新的见解,为肝癌治疗提供了新的方向。

