含缬酪肽蛋白促进单链RNA 和双链DNA 病毒复制或释放机制的研究进展
徐娜,桓晨,郑柏松
(吉林大学第一医院艾滋病与病毒研究所,吉林 长春 130021)
含缬酪肽蛋白(valosin-containing protein,VCP)又名P97,属三磷酸腺苷酸酶超家族(ATPases associated with various cellular activities,AAA)成员之一。自1982 年首次从酵母中分离后[1],VCP先后在多种哺乳动物中被发现[2]。作为一种普遍存在于各种哺乳动物细胞质中的蛋白,VCP 在结构上为一种环状同源六聚体复合物[3]。每个单体包含4 个结构域:1 个可移动的N 端结构域、2 个保守的AAA 结构域(称为D1 和D2)和1 个无序的C 端尾部结构域[4-5]。每个AAA 结构域都包含保守的核苷酸结合基序和水解基序以及有效水解所必需的第二同源区域[6-7]。以往研究[8-10]表明:VCP 的核心功能是依赖于其ATPase 活性的泛素化蛋白水解作用,这一功能使得VCP 不仅能够参与细胞内核酸重建、内质网和线粒体相关蛋白降解[11-12]、细胞周期调控[13-14]、核转录因子-κB(nuclear transcription factor-κB,NF-κB)活化[15]、膜融合和囊泡运输[16]等重要细胞活动,还具有抗细胞凋亡和促进细胞增殖及浸润等作用。
近年来,围绕VCP 的功能研究已经证实VCP与蛋白稳态失调相关疾病及癌症有关联,其中包括亨廷顿舞蹈病(Huntington’s disease,HD)[17]、雄激素非依赖性前列腺癌(androgen-independent prostate cancer,AIPC)[18]和多发性骨髓瘤(multiple myeloma,MM)[19]等。VCP 能有效杀伤癌细胞,可能是一种广泛的抗肿瘤因子。随着研究的深入,VCP 与感染性疾病的联系愈加紧密,其作为宿主因子参与病毒相关的感染性疾病的研究已受到广泛关注。目前,围绕VCP 研究的综述主要在2 个方面:一方面是围绕VCP 介导的蛋白质降解及其机制,包括蛋白酶体降解、内质网相关降解(endoplasmic reticulum-associated degradation,ERAD)和自噬[14];另一方面是关于VCP参与DNA 复制和染色质动力学等细胞周期的调控和机制研究[13,20]。目前,关于VCP 参与的ERAD 相关的蛋白降解途径的研究较为深入。尽管VCP 借助蛋白质降解和DNA 调控等功能参与多种疾病的发生发展,但未见针对VCP 作为宿主因子在病毒性疾病中的作用及其分子机制方面的报道。现针对近年来报道的VCP 同多种病毒在人体内的复制或释放的相关研究进行综述(表1),为病毒感染性疾病的诊治提供参考。
1 VCP 参与单股正链RNA 病毒的复制
在修饰的宿主细胞内膜上组装病毒复制酶以形成复制复合物(replication complex,RC)是几乎所有正链RNA 病毒成功复制的标志[21]。VCP 与单链RNA 病毒的复制有关联,其中包括西尼罗河病毒(West Nile virus,WNV)[22]、丙型肝炎病毒(hepatitis C virus,HCV)[23]、脊髓灰质炎病毒(poliovirus,PV)[24]、肠道病毒71型(enterovirus 71,EV71)[25]、冠状病毒(coronavirus,CoV)[26]、辛德毕斯病毒(Sindbis virus,SINV)[27]和基孔肯雅病毒(Chikungunya virus,CHIKV)[28]。
1.1 VCP 参与黄病毒科黄病毒属病毒成员的复制WNV 和HCV 均是黄病毒科黄病毒属的成员,属于有包膜结构的单股正链RNA 病毒[22-23]。WNV主要导致西尼罗河脑炎,HCV 主要引起丙型肝炎。PHONGPHAEW 等[29]研究发现:在HeLa 细胞中使用VCP 抑制剂或siRNA 抑制内源性VCP 表达后,WNV 病毒感染能力及RNA 表达水平明显降低,表明VCP 可能在WNV 病毒生命周期的吸附或进入的早期步骤中起作用。该研究通过构建WNV 病毒样颗粒和基于WNV-DNA 的复制子,证明VCP 参与合成新的WNV 病毒基因组并介导WNV 病毒复制[29]。研究[30]发现:在Huh7.5 细胞中利用分子生物学技术敲除VCP 或加入VCP 生理抑制剂EerI 和NMS-873 后,能够降低HCV 病毒的复制水平。在此过程中,VCP 通过与HCV 病毒的一种无酶活性的多功能非结构蛋白NS5A DI 相互作用,达到参与HCV 病毒复制的目的。VCP 表达受抑制后,促使HCV NS5A 聚集并减少NS5A 的高度磷酸化,影响HCV 病毒复制酶的组装,进而影响复制复合物的形成[30-31],最终影响HCV 病毒的复制。综上所述,在HCV 复制过程中,VCP 发挥解聚作用,利用腺苷三磷酸酶(ATPase)酶活性(氨基酸位点:241~647 位)防止HCV NS5A 聚集,帮助HCV 病毒复制。
1.2 VCP 参与小核糖核酸病毒科肠道病毒属病毒成员的复制PV 和EV71 同属于小核糖核酸病毒科肠道病毒属成员,是无包膜结构的单股正链RNA 病毒[24-25]。PV 主要引起脊髓灰质炎,EV71是导致手足口病的重要病原体之一。ARITA 等[24]针对膜转运基因对PV 病毒复制所需的宿主因子进行小干扰RNA(siRNA)筛选,发现VCP 与PV病毒复制有关。为了确定VCP 与PV 病毒复制相关的主要活性位点,研究者对VCP ATPase 活性位点进行点突变[32],获得K524A 失活突变体和R191Q及A232E 活性增强突变体。通过在沉默VCP 的HEK293T 细胞中过表达野生型VCP 和2 种突变体VCP[32],结果显示:与转染了野生型和活性增强突变体VCP 的细胞比较,PV 病毒在转染K524A失活突变体细胞中的复制能力明显降低,表明VCP 的ATPase 活性对于维持PV 病毒的复制至关重要。WU 等[33]首次针对EV71 病毒易感细胞——横纹肌肉瘤细胞(RD)中21 121 个人类全基因组siRNA 文库进行了基于免疫荧光的表型筛选,鉴定出促进 EV71 病毒复制的因子(host susceptibility factors,HSFs,又称宿主易感性因子)和抑制EV71 病毒复制的因子(host resistance factors,HRFs,又称宿主抗性因子);最终发现可能参与EV71 病毒复制所涉及的256 个宿主因子,其中宿主抗性因子包含细胞周期调节剂极光激酶B(aurora kinase B,AURKB)和细胞周期蛋白依赖性激酶6(cyclin-dependent kinase 6,CDK6),而EV71 可能通过诱导CDK6 的出核而对EV71 病毒的复制进行调节。另外,ERAD 成分N-聚糖酶1(N-glycanase 1,NGLY1)和VCP 被证明是EV71宿主易感因子,能够在特定的细胞周期阶段促进EV71 的复制。WANG 等[34]通过探讨EV71 病毒感染过程中ERAD 底物的变化发现:EV71 病毒感染能够通过多重位点——HES 相关抑制蛋白(hes-related repressor protein,Herp)、羟甲基戊二酰辅酶A 还原酶降解蛋白1(Hmg-Co A reductase degradation 1,Hrd1)、E2 泛素结合酶(E2 ubiquitin-conjugating enzymes,Ubc6e)、VCP 相关膜蛋白(VCP-interacting membrane protein,VIMP)和泛素调节X 结构域的膜蛋白8(ubiquitin regulatory X domain-containing protein 8,UBXD8)将ERAD 底物锚定在内质网上,VCP 能够促进EV71 病毒的复制。其中,EV71 3C 蛋白能够在Q219G、Q260S 和Q273G 3 个位点[35]处切割E2泛素结合酶Ubc6e,而EV71 2A 蛋白则抑制Herp和VIMP 的合成,导致ERAD 途径受到抑制。其中,VIMP 是一种与VCP 具有相互作用的膜蛋白[36],能够招募VCP 和其他辅助因子至内质网[37]。免疫共沉淀实验[34]表明:VCP ATPase 活性区域能够与EV71 病毒相结合,而且VCP 能与EV71 2C 蛋白在复制复合物中发生共定位,致使内质网膜发生重塑,促进EV71 病毒的复制。VCP 并不能作用于肠道病毒属柯萨奇病毒 B3(coxsackievirus B3,CVB3)的复制[24],表明VCP对肠道病毒属病毒的促进作用具有偏好性,有待进一步研究。
1.3 VCP 参与CoV 的复制CoV 是一类有包膜的正链RNA 病毒,可在人类和多种哺乳动物中引起呼吸道和肠道疾病[26]。WONG 等[38]以CoV 家族成员之一的传染性支气管炎病毒(infectious bronchitis virus,IBV)为模型,发现VCP 在IBV病毒复制早期发挥作用。
1.4 VCP 参与披膜病毒科甲病毒属病毒的复制1955 年分离的SINV 和1952 年分离的CHIKV 同属于披膜病毒科甲病毒属,是具有囊膜结构的单股正链RNA 病毒。VCP 能够调节SINV[27]进入受体天然抗性相关的巨噬细胞蛋白2(natural resistanceassociated macrophage protein 2,NRAMP2)的运输,在果蝇细胞中敲除VCP 后,将改变NRAMP2的运输途径导致NRAMP2 被溶酶体降解和SINV病毒的复制受到抑制[27]。VCP 在CHIKV 生命周期中的病毒RNA 复制中起作用[28],但不影响CHIKVA 病毒的吸附或进入。
2 VCP 促进双链DNA 病毒的复制
尽管VCP 参与多种单链RNA 病毒的复制,但截止目前为止VCP 同DNA 病毒相互关系的研究鲜有报道。加州苜蓿多核核型多角体病毒(autographa californica multiple nucleopolyhedrovirus,AcMNPV)属于昆虫细胞杆状病毒,是一种双链DNA 病毒。LYUPINA 等[39]发现:利用药物NMS-873 抑制VCP 可阻断杆状病毒AcMNPV 的感染周期,导致芽状病毒粒子产生受到抑制,并且VCP 通过其ATPase 活性参与泛素-蛋白酶体途径,促进AcMNPV 病毒的复制。
人类巨细胞病毒(human cytomegalovirus,HCMV)作为一种感染人类的双链DNA 病毒,是疱疹病毒家族中基因组最大的成员,先天性感染在HCMV 病毒感染中占据较高比例[40]。HCMV 的早期蛋白质IE1 和IE2 是HCMV 复制的关键,能够平衡激活感染和潜伏感染。LIN 等[41]敲除VCP 后导致IE2 表达丢失,表明VCP 是HCMV 蛋白IE2 表达所必需的。RNAseq 分析[41]显示:敲除VCP后,IE1 剪接水平增加,IE2 剪接水平相应减少。病毒转录的整体分析显示:尽管IE2 表达丢失,但包括UL112/113 在内的病毒基因的子集表达水平并未降低,表明VCP 敲低引起的IE1 和IE2 水平变化不是病毒复制延迟所导致。免疫荧光实验研究[41]结果显示:VCP 与细胞核中的病毒复制区具有共定位,进一步表明VCP 对于HCMV 的复制具有重要意义。
3 VCP 参与病毒粒子的释放
除影响病毒复制外,VCP 与病毒粒子释放相关。裂谷热病毒(rift valley fever virus,RVFV)属于布尼亚病毒目白纤病毒科白蛉病毒属,RVFV病毒是裂谷热(rift valley fever,RVF)的病原体,RVF 是一种人畜共患病毒,可导致人畜共患病[42]。BRAHMS 等[43]研究发现:在分泌途径中涉及膜重塑功能的VCP 对RVFV 病毒的释放很重要;Vero 细胞中敲除VCP 后导致RVFV 病毒复制减少,且RVFV 病毒糖蛋白Gn 与高尔基复合体定位减少,而在ER 的积累增加;在用靶向VCP 的siRNA 转染的细胞中也观察到RVFV 病毒粒子在细胞内的积累。该研究结果提示:siVCP 后RVFV病毒粒子的组装发生在高尔基体中,但在组装后将其锚定至内质网来阻止病毒粒子释放。
在关于PV 病毒的研究中,ARITA 等[24]通过在PV 病毒感染的RD 细胞和HEK293T 细胞中进行VCP 与病毒蛋白共定位及相互作用分析发现:VCP 与PV-2BC/2C 蛋白和3AB/3B 蛋白存在共定位情况,邻位连接作用(proximity ligation assay,PLA)分析显示VCP 与2BC 和3AB 蛋白相互作用,但不与2C 蛋白和3A 蛋白相互作用;敲除VCP 后,PV 病毒蛋白表达相应减少。该研究发现了细胞蛋白分泌与病毒RNA 复制之间的新型联系。
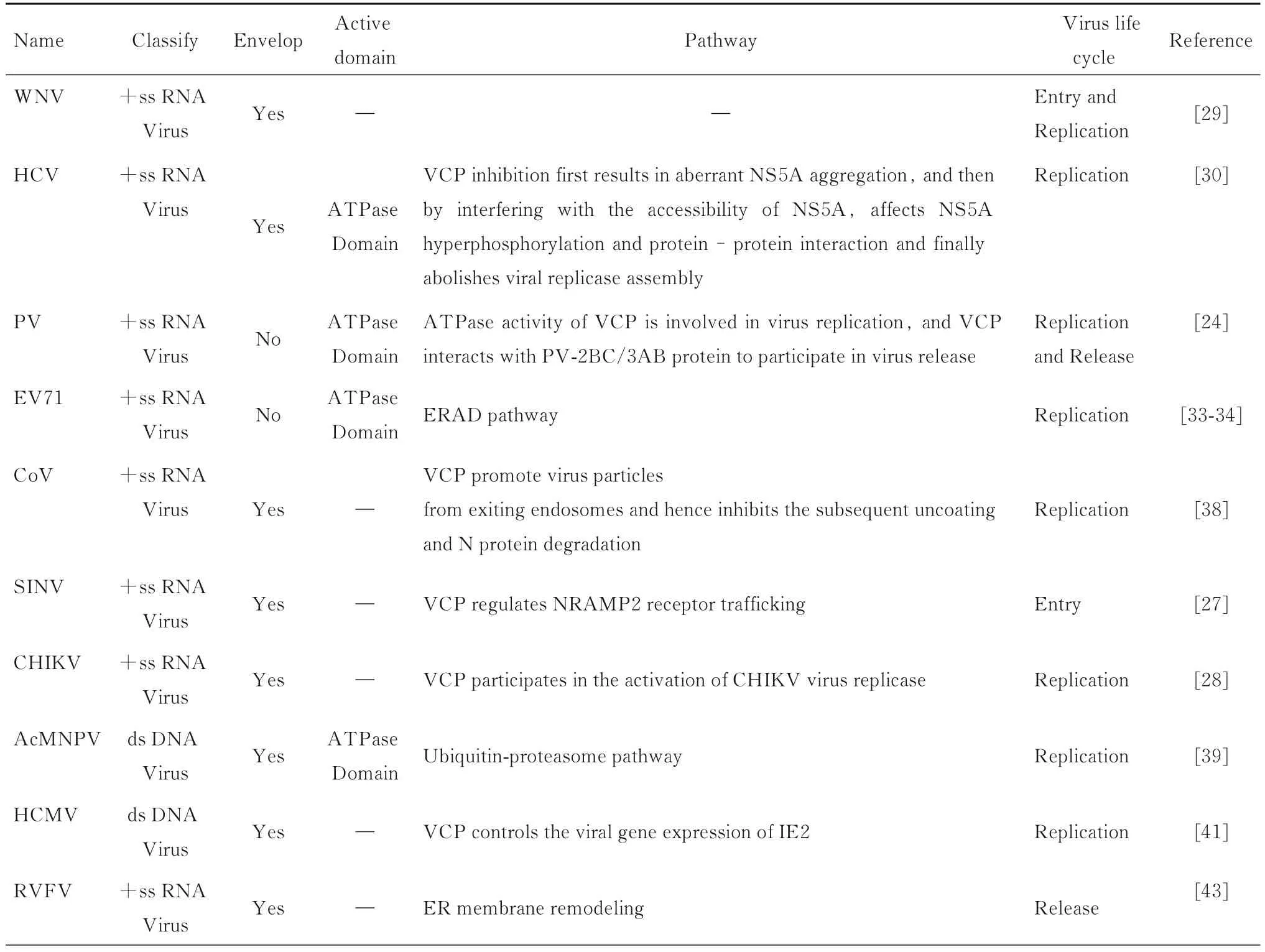
表1 VCP 与单链RNA 和双链DNA 病毒关系Tab.1 Relationships between VCP and single-stranded RNA and double-stranded DNA viruses
4 总结与展望
目前,VCP 不仅可以通过参与病毒复制体的组装实现促进病毒基因复制的作用,还可以通过膜重塑功能参与病毒粒子的释放。VCP 不参与负链RNA 病毒水疱性口炎病毒(vesicular stomatitis virus,VSV)的生命活动。目前针对VCP 与单股正链RNA 病毒的研究较多,其中VCP 对肠道病毒属PV 和EV71 均能有效的促进病毒复制,但不影响CVB3 病毒的复制,表明不同肠道病毒的致病机制不同。针对VCP 参与正链RNA 病毒WNV、HCV、PV、EV71、CoV、SINV、CHIKV 和RVFV 病毒生命周期的广谱性,以及对于DNA 病毒AcMNPV、疱疹病毒HCMV 特异的促进作用及依据VCP 能够有效调控ERAD 和自噬等相关途径的特点,将有助于设计新的抗病毒药物,为感染性疾病的诊治提供新的思路。

