Paraburkholderia caffeinilytica CF1咖啡因降解关键酶CdnB的特性
孙 迪, 杨 雪 莹, 曾 超, 高 子 晴
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
咖啡因是一种嘌呤类生物碱,是茶、咖啡和可乐等的重要组成成分。随着茶产品的不断流行,茶渣的排放问题亟待解决。一方面由于咖啡因在自然条件下不易被降解,会引起土壤盐碱化,进而影响农作物的生长,污染环境[1];另一方面因茶渣富含蛋白质和糖类,可代替传统谷类作为饲料,但由于咖啡因的存在,动物食用含咖啡因的茶渣会出现异常躁动和睡眠障碍,进而影响肉质产量[2-3]。因此,在排放及利用茶渣前对其进行脱咖啡因处理显得尤为重要。相较于常见的脱咖啡因技术[4],生物降解法脱咖啡因具有成本低廉、操作简便和环境友好等特点,因此受到人们越来越多的关注[5]。
研究表明,细菌对咖啡因的降解主要存在两种途径:脱甲基途径和氧化途径。在已报道的具有咖啡因降解能力的菌株中,80%都通过N-脱甲基途径降解咖啡因[6]。N-脱甲基途径是指在降解咖啡因过程中,咖啡因先后在N1和N3位脱甲基酶催化下生成3,7-二甲基黄嘌呤或1,7-二甲基黄嘌呤,经代谢中间体7-甲基黄嘌呤转化成甲基尿酸或黄嘌呤,再氧化或水解成甲酸或甲醇,随后转化成CO2和H2O[7-8]。相较于咖啡因降解菌株的筛选及降解途径的解析,咖啡因降解酶类的研究却相对滞后。Woolfolk[9]于1975年确定了N-脱甲基酶的存在及在咖啡因降解中的作用,但由于该酶在提取纯化过程中快速失活,使得N-脱甲基酶的研究一直处于停滞状态。直到2011年,Summers等[10]才从恶臭假单胞菌CBB5中分离出了一种N-脱甲基酶,这是国内外对于脱甲基酶纯化的唯一报道。
课题组前期分离得到一株高效咖啡因降解菌ParaburkholderiacaffeinilyticaCF1[11],并完成了该菌全基因组测序及基因注释工作,经代谢产物鉴定证明其通过N-脱甲基途径降解咖啡因;利用已报道的咖啡因降解相关基因序列信息,成功地在P.caffeinilyticaCF1基因组上找到咖啡因N3-脱甲基酶,该酶负责催化3,7-二甲基黄嘌呤转化为7-甲基黄嘌呤。由于已报道的N3-脱甲基酶的酶活较低且极不稳定,因此本研究在前期实验的基础上,利用大肠杆菌表达体系异源表达酶活力高、稳定性强的N3-脱甲基酶CdnB-His6;通过镍离子亲和层析技术实现纯酶的回收,得到了高酶活力及稳定性的N3-脱甲基酶,并对CdnB-His6进行催化特性表征,以期为今后咖啡因脱甲基酶系的分子改造及实际应用奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌 株
本实验使用宿主菌株为E.coliRosetta-gamiB(DE3)-pLysS。
1.1.2 培养基
称取蛋白胨10 g、酵母浸粉10 g及氯化钠5 g 溶于800 mL去离子水中,将pH调至7.5后定容到1 L,121 ℃灭菌20 min,备用。
1.1.3 试 剂
限制性内切酶BamH Ⅰ、Hind Ⅲ、T4 DNA连接酶、蛋白Marker均为Takara产品;BDR溶液与Ni-NTA,上海生工生物公司;考马斯亮蓝染液:100 mL染色液包括0.1 g的考马斯亮蓝R-250、25 mL异丙醇及10 mL醋酸,其余用超纯水补齐;脱色液:100 mL脱色液含有10 mL醋酸和5 mL乙醇,其余用超纯水补齐;酶活测定所需的氧化还原酶CdnB-His6为实验室从CF1菌株中自主纯化出的还原酶。
1.2 方 法
1.2.1 表达菌株的构建
将实验室自主构建的质粒pGM-T-CdnB和pET32a表达质粒在BamH Ⅰ和Hind Ⅲ酶切位点分别进行双酶切并连接,在E.coliRosetta-gamiB(DE3)中进行异源表达。
1.2.2 蛋白的表达纯化
将构建好的CdnB-His6表达菌株接种到含有氨苄西林(50 μg/mL)的500 mL LB培养基中,培养至OD600=0.5后,加入IPTG至终浓度0.05 mmol/L,15 ℃下诱导培养16 h。离心收集菌体沉淀,用50 mmol/L的磷酸盐缓冲液(pH 8.0)洗涤2次后,低温条件下超声破碎裂解细胞。将得到的细胞悬液离心,收集上清,即为粗酶液。
将粗酶液经0.22 μm的微孔膜过滤后,上样到平衡好的镍离子亲和层析柱,用洗涤缓冲液(50 mmol/L 咪唑、50 mmol/L氯化钠、20 mmol/L磷酸钾缓冲液,pH 8.0)洗涤,用洗脱缓冲液(100 mmol/L 咪唑、50 mmol/L氯化钠、20 mmol/L 磷酸钾缓冲液,pH 8.0)洗脱,得到纯度较高的蛋白溶液。将得到的CdnB-His6纯蛋白置于处理好的MWCO 10 000透析袋中,4 ℃于50 mmol/L pH 8.0的磷酸缓冲液中透析6 h后,超滤浓缩备用。
氧化还原酶CdnD-His6的洗涤缓冲液为20 mmol/L 咪唑、50 mmol/L氯化钠、20 mmol/L磷酸钾缓冲液,pH 8.0;洗脱缓冲液为50 mmol/L咪唑、50 mmol/L氯化钠、20 mmol/L磷酸钾缓冲液,pH 8.0;其余纯化步骤同CdnB-His6。
利用考马斯亮蓝法测定蛋白质浓度[12]。将5 μL 样品用超纯水稀释到0.5 mL后加入0.5 mL BDR溶液,于25 ℃水浴中反应5 min后,用紫外分光光度计在595 nm处测定吸光度,根据标准曲线计算蛋白浓度。
1.2.3 SDS-PAGE及Native-PAGE电泳分析
1.2.3.1 SDS-PAGE电泳
将纯化后的CdnB-His6与样品处理液以1∶1 混匀,95 ℃水浴10 min后,转速8 000 r/min离心5 min,上样量15 μL。电泳条件:分离胶质量分数12%,浓缩胶质量分数5%;电泳开始时电压60 V,进入分离胶后,电压调至120 V。考马斯亮蓝R250染色30 min后,将染色液换为脱色液,置于振荡仪上脱色3 h,置于凝胶成像仪观察。
1.2.3.2 Native-PAGE电泳
将纯化后的CdnB-His6与样品处理液以1∶1混匀,上样量为15 μL。电泳条件为分离胶质量分数12%;电泳电压为170 V。考马斯亮蓝R250染色30 min后,脱色3 h,置于凝胶成像仪观察[13]。
1.2.4 酶活的测定方法
由于单独的CdnB-His6无法行使脱甲基功能,需要氧化还原酶CdnB-His6的参与,因此按照Summers[10]方法略做修改,酶反应体系(1 mL):1.5 mmol/L 3,7-二甲基黄嘌呤,1 mmol/L NADH,0.05 mmol/L硫酸亚铁铵,50 mmol/L Tris-盐酸缓冲液(pH 8.0),0.2 mg纯化的CdnB-His6及0.2 mg氧化还原酶CdnD-His6。按照酶反应体系加入试管中,在30 ℃下反应20 min后,于100 ℃加热5 min终止反应。以灭活的CdnB-His6蛋白反应作为对照,HPLC测定酶反应过程中产物的生成量。30 ℃下将1 min生成1 μmol 7-甲基黄嘌呤所需的酶量定义为1个活力单位(U)。
色谱(Waters 2695/2998,USA)条件:Hypersil C-18柱(φ4.6 mm×250 mm,5 μm),流动相为体积比30∶70的甲醇和水,体积流量1 mL/min,紫外检测波长254 nm,柱温40 ℃。
1.2.5 CdnB-His6的酶学性质表征
1.2.5.1 酶的底物特异性
分别以咖啡因、3,7-二甲基黄嘌呤、1,3-二甲基黄嘌呤及3-甲基黄嘌呤为底物进行酶反应,测定酶促反应动力学参数研究酶的底物特异性。
酶促反应动力学参数的测定方法:分别于0.1、0.2、0.5、1.0及2.0 mmol/L底物浓度下进行酶促反应,通过Lineweaver-Burk双倒数作图法绘制1/cs-1/V0图,计算米氏常数Km和最大反应速度Vmax。
式中:Km为米氏常数,μmol/L;V0为反应速度,μmol/(L·mg·min);Vmax为最大反应速度,μmol/(L·mg·min);cs为底物浓度,μmol/L。
1.2.5.2 温度对酶活力的影响
在15、20、25、30、37 ℃下,缓冲液为pH 8.0的Tris盐酸,每个温度做3组平行实验,分别测定酶活力,以灭活的酶作为对照。
1.2.5.3 pH对酶活力的影响及酶的pH稳定性
在pH 3.0~11.0分别测定酶活力,每个pH做3组平行实验,以灭活的酶作为对照。
在pH 3.0~11.0条件下,于4 ℃保温2 h后,每个pH做3组平行实验,分别测定残留酶活力,与最高的酶活力相比,计算百分比,以灭活的酶作为对照。其中,pH 3.0~6.0采用柠檬酸-柠檬酸钠缓冲体系进行调节;pH 6.0~8.0采用磷酸二氢钾-磷酸氢二钾缓冲体系进行调节;pH 8.0~10.0采用Tris-盐酸缓冲体系进行调节;pH 10.0~11.0采用甘氨酸-氢氧化钠缓冲体系进行调节。
1.2.5.4 金属离子对酶活力的影响
分别向酶反应体系中添加不同金属离子,使其终浓度达到2 mmol/L,随后在pH 8.0、30 ℃条件下测定酶活力,以不添加金属离子的酶反应体系作为对照(计为100%),计算相对酶活力,每种金属离子做3组平行实验。选取的金属离子分别为Na+、K+、Pb2+、Ni2+、Ca2+、Mg2+、Fe2+、Mn2+、Cu2+、Co2+和Fe3+。
2 结果与讨论
2.1 表达质粒的构建
对实验室保存的克隆质粒pGM-T-CdnB及载体pET32a进行双酶切,于4 ℃连接过夜,将连接产物转化至E.coliRosetta-gamiB(DE3)感受态细胞中。挑取氨苄西林抗性平板上的阳性克隆进行重组质粒提取。对提取的质粒进行双酶切鉴定,重组质粒经BamH Ⅰ和Hind Ⅲ双酶切后显示有大小为1 100和5 700 bp的两条特异性片段,与预测正确重组质粒的酶切结果一致;对其进行菌液PCR鉴定,可观察到约1 100和1 300 bp的两条特异性条带,结果表明本实验成功构建了N3-脱甲基酶表达菌株E.coliRosetta-gamiB(DE3)-pLysS-pET32a-CdnB。
2.2 重组蛋白的表达纯化
对细胞破碎上清液及镍柱纯化后的蛋白进行SDS-PAGE分析,如图1(a)所示。经纯化后,蛋白条带单一,杂蛋白已被有效去除,获得纯度大于90%的目的蛋白,分子质量为58 ku。可以看到蛋白在大肠杆菌中表达量较高,且分子质量大小与预期一致。此外,对于未添加IPTG诱导剂的阴性对照,细胞破碎上清液中并未出现目的蛋白质表达条带,且未检测到N3-脱甲基酶活性(图中未显示),进一步证明图1(a)中诱导表达的大小为58 ku的蛋白质为N3-脱甲基酶CdnB-His6。
对纯化后的CdnB-His6进行Native-PAGE分析,如图1(b)所示。于49.1、116 ku两条已知大小的蛋白质条带间出现一条单一蛋白质条带,结合SDS-PAGE分析可知,CdnB-His6是一个分子质量为58 ku的单亚基单倍体蛋白。
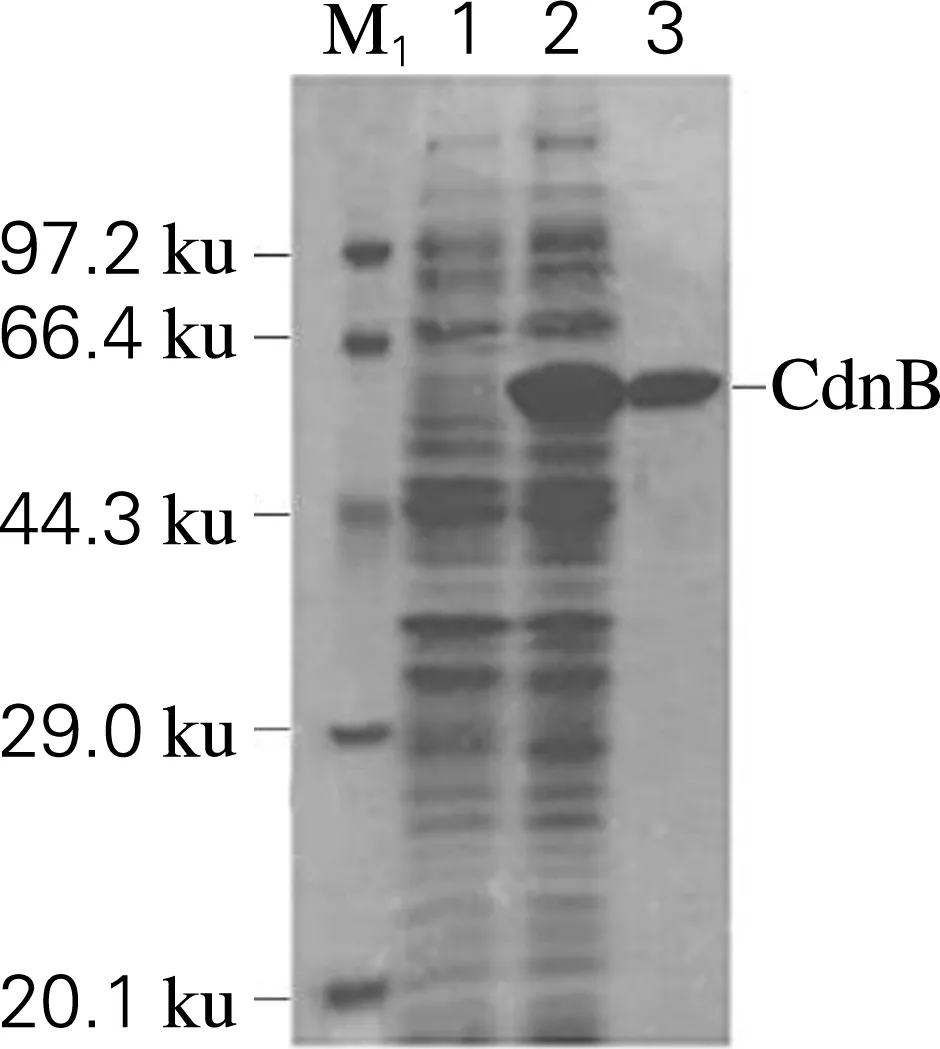
(a) SDS-PAGE
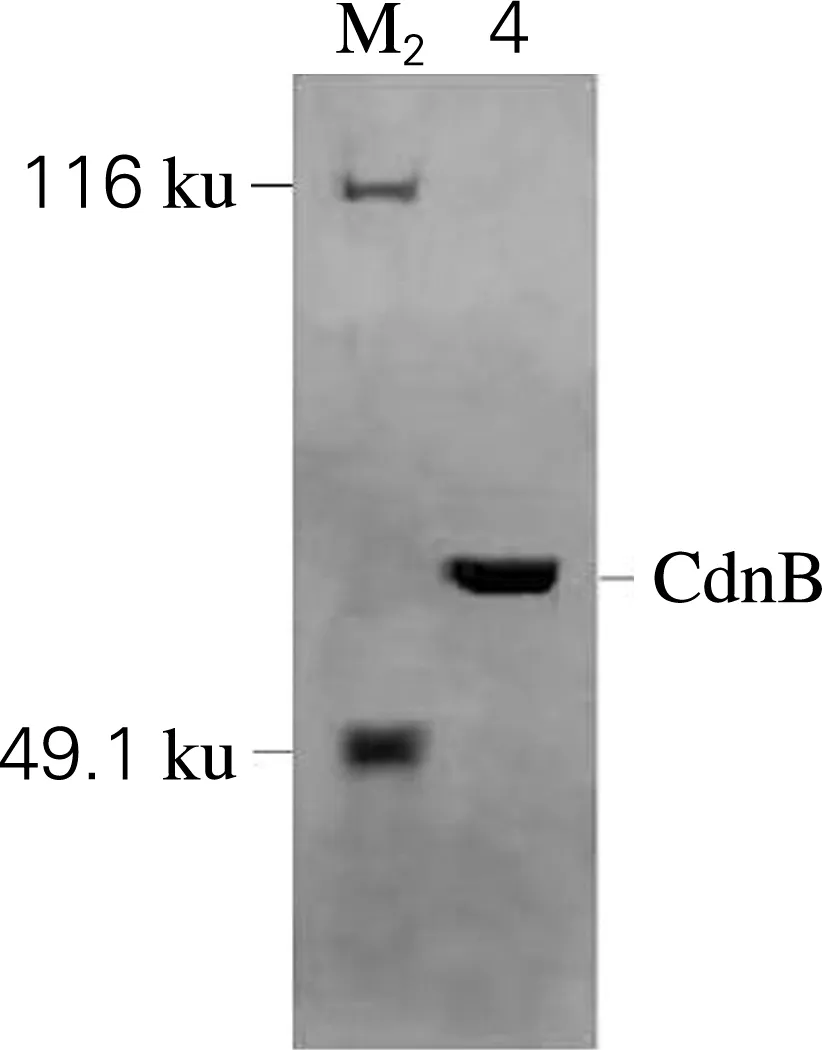
(b) Native-PAGEM1,标准蛋白;1,空载;2,粗酶液;3,纯化后的CdnB-His6;M2,已知大小蛋白;4,纯化后的CdnB-His6图1 CdnB-His6 的SDS-PAGE和Native-PAGE 电泳图Fig.1 SDS-PAGE and Native-PAGE of CdnB-His6
2.3 蛋白的紫外可见分光光度分析
将纯化后的N3-脱甲基酶(CdnB-His6)在室温下用紫外可见光谱扫描仪进行全波长扫描,波长范围为200~1 100 nm,如图2所示。在279、326、460和572 nm处CdnB-His6出现明显吸收峰,而在添加2 mmol/L还原剂连二亚硫酸钠后,460及572 nm处的特征峰完全消失,这是铁硫蛋白特有的光谱特征[14],说明N3-脱甲基酶CdnB是一种铁硫蛋白,同时解释了纯化后的CdnB-His6蛋白呈红褐色的原因。插入的图像为CdnB-His6与还原型CdnB-His6对比图。
2.4 N3-脱甲基酶的表征
2.4.1 CdnB-His6的底物特异性分析
Summers[10]等于2012年首次从Pseudomonasputida. CBB5中分离纯化出一种N3-脱甲基酶NdmB。相较于NdmB可以作用于所有含有N3位甲基的底物[15],CdnB-His6表现出更为严格的专一性。在最适条件下,对CdnB-His6进行不同底物的酶反应,利用HPLC对酶反应产物进行分离鉴定。结果显示,N3-脱甲基酶CdnB-His6只能作用于3,7-二甲基黄嘌呤及3-甲基黄嘌呤。与预测的蛋白功能相同,即只能对N3位甲基进行去甲基化,且不能在N1位甲基存在的情况下进行N3位去甲基化。由此推出,CdnB负责催化咖啡因降解第二步,即3,7-二甲基黄嘌呤转化为7-甲基黄嘌呤。
Km表示酶和底物的亲和能力大小,Km越大,表明酶和底物的亲和力越弱;Km越小,则表明酶和底物亲和能力越强。因此,通过比较不同底物的Km,如表1所示,由底物3,7-二甲基黄嘌呤的Km稍小于3-甲基黄嘌呤为底物时的Km,得出3,7-二甲基黄嘌呤为CdnB-His6的最适反应底物;当底物浓度远大于Km时,酶促反应速率不受底物浓度影响,此时的酶促反应为零级反应,因此选取1.5 mmol/L作为反应中底物的终浓度。CdnB虽然与Summers等[15]分离出的NdmB同为N3-脱甲基酶,与NdmB不同的是,NdmB的最适底物为3-甲基黄嘌呤,一方面可能是由于CdnB-His6和NdmB分别来源于不同的菌属,另一方面也可能是CdnB-His6具有更为严格的底物特异性导致的。
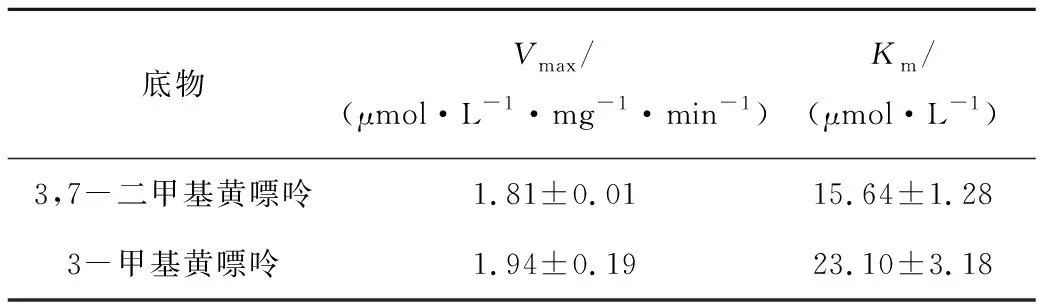
表1 CdnB-His6的酶学参数Tab.1 Apparent kinetic parameters of CdnB-His6
2.3.2 温度对CdnB-His6酶活力的影响
将制备好的纯酶液以3,7-二甲基黄嘌呤为底物进行反应。从图3中可以看出,在15~30 ℃,CdnB-His6的活力随温度的升高而增大,在30 ℃达到峰值,显示最大酶活力;之后随着温度的升高,酶活力降低。一般来说,温度升高有利于提高酶反应速度,但同时酶作为一种蛋白质也会逐渐变性失活,从而降低反应速度。在本实验中,当温度上升到37 ℃时,纯酶活力下降至最适温度条件下酶活力的60%,说明CdnB-His6蛋白质在此温度下可能已经部分变性,表明N3-脱甲基酶CdnB-His6对热敏感,且最适反应温度为30 ℃。这一结果与CF1菌株的培养条件相吻合,只有在30 ℃条件下,CF1菌株才会正常生长。
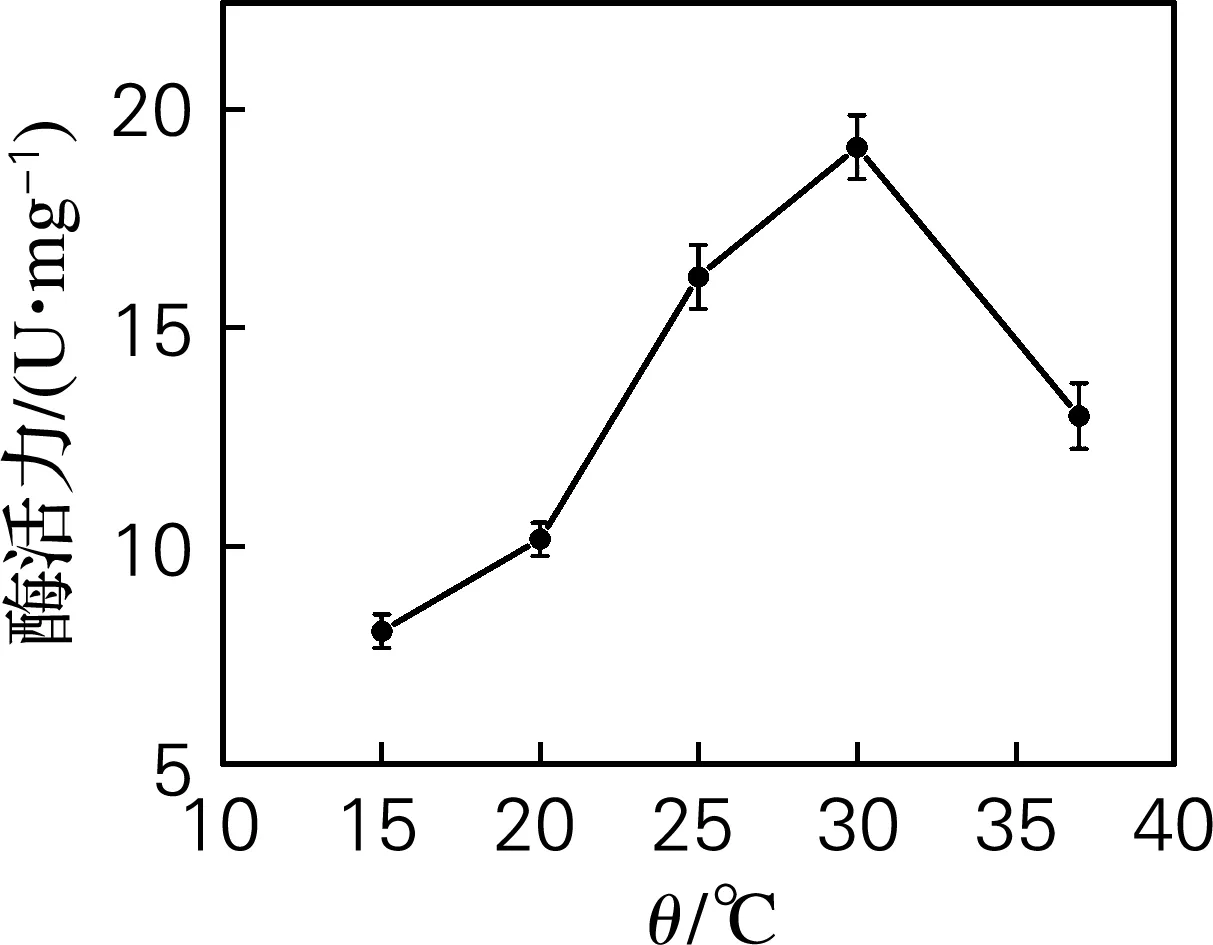
图3 温度对CdnB-His6酶活力的影响Fig.3 Effect of temperature on the activity of CdnB-His6
2.3.3 pH对CdnB-His6酶活力的影响及CdnB-His6的pH稳定性
在最适反应温度下,将CdnB-His6置于不同pH缓冲体系中,测定其酶活力,结果如图4所示。随着pH升高,CdnB-His6的酶活力逐渐增强,直到pH 8.0时到达峰值,随后酶活力随着pH的升高直线下降。由于pH会改变酶的构象,在过酸或过碱的条件下使酶活力丧失,酶活力急剧下降,因此CdnB-His6的最适反应pH为8.0(Tris-HCl缓冲体系)。
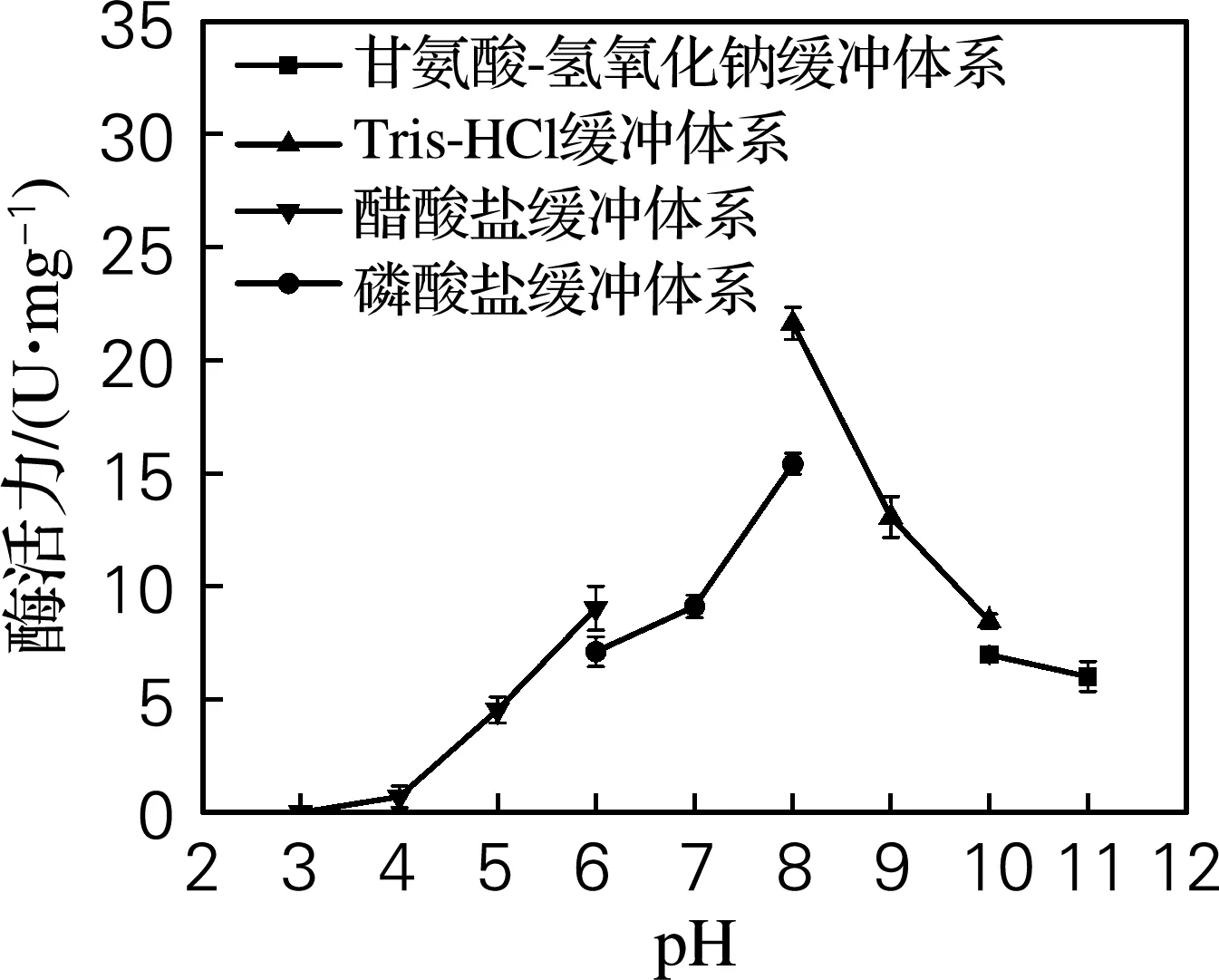
图4 pH对CdnB-His6酶活力的影响Fig.4 Effect of pH on the activity of CdnB-His6
pH除了影响酶的反应速度外,还会影响酶的稳定性。图5为CdnB-His6在pH 3.0~11.0的酶活,通过酶的残余活性表现出酶的相对稳定性,CdnB-His6在pH 8.0时达到最大酶活力,于pH 6.5~8.5达到最大酶活力的60%,甚至更高,而在pH 3.0~6.5及8.5~11.0,酶活力损失严重甚至完全变性失活,说明CdnB-His6既不耐酸也不耐碱,因此CdnB-His6的稳定pH区间为6.5~8.5,适宜于中性环境。
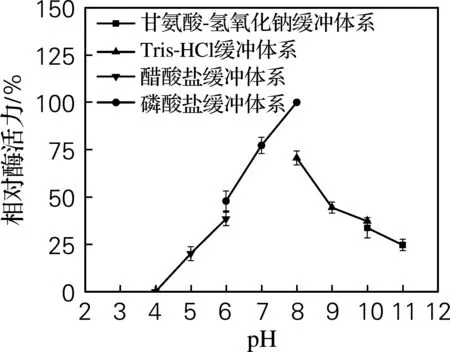
图5 CdnB-His6的pH稳定性Fig.5 Effect of pH on the stability of CdnB-His6
2.3.4 金属离子对CdnB-His6酶活力的影响
金属离子对酶活力的影响较为复杂,在30 ℃、pH 8.0条件下进行酶反应,以不添加任何金属离子的反应作为对照,酶活力为21.63 U/mg。从表2中可以看出,Fe2+能轻微促进脱甲基酶CdnB-His6活性,与CdnB-His6是铁硫蛋白相一致。Na+对酶活力无明显作用,而其他离子均不同程度地抑制了酶活力,其中Co2+与Cu2+对酶活力抑制效果最为显著,其酶活力分别减少到23%和25%,由此可以看出,重金属对CdnB-His6酶活性影响极大,这也是今后工程菌株的应用中所面临的巨大考验之一。

表2 金属离子对CdnB-His6酶活力的影响Tab.2 Effects of metal ions on the activity of CdnB-His6
3 结 论
本实验成功构建了N3-脱甲基酶表达菌E.coliRosetta-gamiB(DE3)-pLysS-pET32a-CdnB,且利用高表达量可溶性CdnB-His6纯化出了高纯度蛋白,为研究脱甲基酶的结构和功能提供物质基础。对CdnB-His6进行酶学特性研究可知,CdnB-His6是分子质量约为58 ku的单亚基单倍体铁硫蛋白;最适反应底物为3,7-二甲基黄嘌呤;最适反应温度为30 ℃;最适反应pH为8.0(Tris-HCl体系);pH稳定区间为6.5~8.5;除Fe2+对其酶活有促进作用外,其他离子均不同程度地抑制其活性。

