基于生物信息学的胃肠道间质瘤低级至高级转变的潜在关键基因与信号通路研究
吴江山,黄兴蔚,曾毅飞,莫兰梅,方青华,韦珍平
(广西医科大学附属武鸣医院 消化内科,广西 南宁 530000)
0 引言
胃肠道间质瘤(GISTs)指原发于胃肠道、大网膜和肠系膜的c-KIT(CD117,干细胞因子受体)染色阳性的梭形细胞或上皮样细胞的一组间叶源性肿瘤,其最常发生在胃,发病率为60%~70%,为胃间质瘤[1]。GISTs 的大体病理表现为肿瘤直径2~20cm不等,境界清楚质硬肿块,切面呈灰白色或红棕色,囊性或实性,也可伴有坏死及黏液变性;其常见临床症状有恶心、呕吐、上腹痛、贫血、肿块与上胃肠道出血等。GISTs 是一种交界性肿瘤,国内外常用的风险评估标准有Fletcher 分级标准、AFIP 分级标准和改良的NIH 分级标准;而后,Fletcher 等人[2]在2002 年提出用极低危险度、低危险度、中危险度及高危险度取代良恶性划分,这一分级标准得到学术界广泛的认可。
众所周知,GISTs 的临床表现多样,其非特异的临床表现给临床诊断及治疗带来了困难[3]。因此,目前对GISTs 的防治及基础研究仍然刻不容缓。GISTs 的发生、发展是个复杂的生物学过程,目前一般认为GISTs 的发生是沿着“低度恶性原发病灶-高度恶性原发病灶-转移病灶”方向发展与恶化。而这一过程涉及到多基因、多通路,并伴随复杂的分子机制的过程[4]。因此探讨“GISTs 恶化”的关键基因及信号通路,对阻断GISTs 由低度恶性向高度恶性转化具有重要意义。
此外,近年来,随着基因工程技术的完善和高通量测序技术的广泛应用[5-6],临床中积累了大量GISTs 基因表达谱数据,这为全面探究GISTs 发病及恶化机制的分子生物学机制研究创造了条件。为了阐明GISTs 恶化过程中的潜在关键分子及生物学过程,本文利用公共基因芯数据库GEO 中的芯片数据,对恶性GIST(转移性和高危GIST)和恶性程度较低的GIST(低和极低风险GIST)的相关基因进行生物信息学分析,挖掘出与GISTs 恶化过程相关的潜在关键基因及信号通路,并构建了这些基因编码蛋白的蛋白互作网络,找出其中关键蛋白,以揭示GISTs恶化的发病机制。同时为改善GIST 预后、阻断“GIST恶性转变”的研究提供新的思路。
1 材料和方法
1.1 基因表达谱芯片
利用 NCBI(National Center for Biotechnology Information) 平台下 的 GEO(GENE EXPRESSION OMNIBUS)数据库,检索GIST 的相关基因数据,在检索结果中选择 GSE136755[7]数据进行挖掘。GSE136755 是由日本学者使用agilent sureprint g3 人类基因表达8×60k v2 微阵列测定65 个GIST的mrna 表达谱。其中,包括6 个转移瘤和59 个原发瘤(胃、小肠、直肠和食道)。同时,GIST 的恶性程度如表1。
1.2 数据处理及差异基因分析
下载研究所需的GSE136755 数据[8],然后对数据进行整理及优化。将探针转化为标准基因名称,对具有相同基因名的表达水平取平均水平。随后将数据分为高恶化组(17 例)和低恶化组(33 例),利用 R 语言的 Limma 软件包进行差异基因筛选。选取adj.PValue<0.05、|logFC |>1 的基因作为候选差异基因。
1.3 GO 富集和 KEGG 通路富集
为了阐明这些差异基因在GISTs 恶化过程中所发挥的作用,我们采用clusterprofile 包对基因GO 和KEGG 信号通路富集分析。根据 adjusted P-value<0.05 进行GISTs 恶化过程差异基因相关GO 条目及通路的筛选,进而从生物过程及信号通路程角度分析这些差异基因在GISTs 恶化过程中可能发挥的分子生物学作用。
1.4 PPI 网络联合转录因子预测
为了从差异基因所表达的蛋白层面说明这些蛋白之间的相互作用关系,将差异基因所对应的蛋白上传至STRING 数据库,本研究选取的是打分值高于0.4 的最高置信度的数据,构建由导入基因所表达产物组成的PPI 网络,并且利用Cytoscape 软件将蛋白相互作用网络图可视化。同时,我们使用iRegulon 软件对PPI 网络内的基因进行转录因子富集预测,NES 排名前6 的转录因子被可视化。
1.5 关键基因的筛选
为了进一步筛选与GISTs 恶化过程相关的潜在关键基因,我们使用cytoHubba 插件里面的11 中算法对PPI 网络进行重要模块分析。最后选择Degree前10 的基因作为与GISTs 恶化过程相关的潜在关键基因。
2 结果
2.1 数据预处理及差异分析
从GEO 数据库下载的GSE136755 数据经预处理后(如图1 所示,A 是预处理前的数据表达情况,B是处理后的基因表达情况,可知经数据处理后基因的表达处于均一化),我们得到18652 个基因的表达矩阵(图1C)。经过差异分析后,753 个差异基因被筛选出来,其中378 个差异基因在GIST 高恶化组是上调的,而375 个基因在GIST 高恶化组是下调的 (adj.PValue<0.05、|logFC |>1)。分别选择这些差异基因中上下调最明显的100 个基因作热图展示(图1D,50 个上调基因和50 个下调基因)。
2.2 富集分析
本研究进行了差异基因的富集分析。753 个差异基因的GO 生物过程功能主要富集在免疫方面,如MHC II 类受体活性,抗原结合和受体调节活性等(图1E,adjusted P-value<0.05)。而KEGG 信号通路富集分析结果显示,这些差异基因主要富集在多种信号通路和免疫功能方面,如PI3K-Akt 信号通路、p53 信号通路、Th1 和Th2 细胞分化、产生IgA 的肠道免疫网络、Th17 细胞分化和抗原处理等(图1F,adjusted P-value<0.05)。
2.3 PPI 和转录因子预测网络
通过STRING 11.0 在线网络工具对753 个差异基因进行蛋白质相互作用网络分析,排除其中无相互作用的蛋白,最后得到由 635 个节点(其余118 个基因,相互之间无关联网络)、7036 条连接构成的蛋白质相互作用网络图。此外,我们还通过iRegulon 插件对这些PPI 网络里面的基因进行了转录因子预测,最后构建了PPI 和转录因子预测网络(图2A)。6个转录因子被预测出来,包括IRF1、SIN3A、E2F4、TFDP1、FOXM1 和MYBL2,图中的蛋白与其他节点连线越多,表明该蛋白在该网络中越重要。
2.4 潜在关键基因筛选
在本研究中,我们最后通过cytoHubba 插件里面的11 种方法筛选PPI 网络中的重要模块,筛选出可能与GISTs 恶化过程相关的潜在关键基因。其结果显示在这11 种方法里面没有共同的交集基因。同时,目前较为准确的预测方法为Degree。因此,我们最后通过Degree 排名确定了前10(>100)的10 个关键基因,分别是KIF11、CDK1、AURKA、CCNB1、KIF15、CCNA2、BUB1、KIF4A、KIF2C 和KIF20A(图2C)。
3 讨论
在本研究中,我们使用综合的生物信息学方法挖掘了GSE136755 这一芯片数据,筛选出753 个差异差异基因。同时,我们进一步通过各种在线软件及R 语言软件分析了可能与GIST 恶化这一分子生物学过程相关的潜在关键基因和信号通路。结果我们发现这些差异基因的GO term 主要富集在免疫方面,如MHC II 类受体活性,抗原结合和受体调节活性等;其信号通路富集主要体现在多种信号通路和免疫功能方面,如PI3K-Akt 信号通路、p53 信号通路、Th1 和Th2 细胞分化、产生IgA 的肠道免疫网络、Th17 细胞分化和抗原处理等。同时,KIF11、CDK1、AURKA、CCNB1、KIF15、CCNA2、BUB1、KIF4A、KIF2C 和KIF20A 可视为“GIST 恶化”过程的关键基因。因此,我们就以上结果简要作以下分析。
首先,从与GIST 恶化过程相关的生物学过程及信号通路上分析。众所周知,肿瘤的发生发展涉及到许多的生物学过程及信号通路,如细胞增殖、细胞分化、Hippo 通路[9]、Wnt 通路[10]、免疫反应[11]等。而本研究结合大数据分析发现GIST 的恶化过程主要与免疫学机制相关。当肿瘤发生时,机制产生免疫反应对肿瘤细胞进行抵抗,包括固有免疫和适应性免疫。同时,当机制的免疫调节机制发生变化时,肿瘤细胞也会发生一定的反应[12]。同时,免疫学机制在各种生物学过程中的研究已收到越来越多的关注,但其在GIST 的恶化过程的研究还较少,故免疫机制在GIST 恶化过程中的研究仍有广泛前景。
其次,从与GIST 恶化过程相关的潜在关键基因来 说。KIF11[13](kinesin family member 11) 是驱动蛋白家族成员。众所周知,这种蛋白质家族的成员参与各种纺锤体动力学,该基因产物的功能包括染色体定位、中心体分离和在细胞有丝分裂期间建立双极纺锤体。这种纺锤丝中心体的分裂可促进细胞分裂,而GIST 恶化是一种肿瘤细胞不断增殖的过程,因而KIF11 是否可通过中心体机制调控GIST肿瘤细胞增殖有待进一步研究。CDK1[14](cyclin dependent kinase 1)是一种细胞周期蛋白,其编码的蛋白质是丝氨酸/苏氨酸蛋白激酶家族的成员;这种蛋白是高度保守的蛋白激酶复合体的催化亚单位,被称为M 相促进因子(MPF),它在真核细胞周期的G1/S 和G2/M 相转变过程中发挥着重要作用[15]。同时,CDK1 的激酶活性受细胞周期蛋白在细胞周期中积累和破坏的调控,其磷酸化和去磷酸化过程在细胞周期控制中也起着重要的调节作用。AURKA[16](aurora kinase A)编码的蛋白质是一种细胞周期调节激酶,在染色体分离过程中参与微管的形成和纺锤体杆的稳定。已有大量的研究表明,AURKA 可能在肿瘤的发展和进程中发挥作用,但其在GIST 恶化过程中发挥的机制有待进一步探索。众所周知,CCNB1(cyclin B1)编码的蛋白质是参与有丝分裂的调节蛋白,其基因产物与p34(cdc2)复合形成促成熟因子(MPF);同时调控着细胞周期G2/M 的转换。而KIF15(kinesin family member 15)目前来说研究的还较少[17]。CCNA2[18](CCNA2 cyclin A2)编码的蛋白质属于高度保守的细胞周期蛋白家族,其可结合并激活细胞周期蛋白依赖激酶2,从而促进通过G1 和G2 的转化。BUB1(BUB1 mitotic checkpoint serine/threonine kinase)该基因编码丝氨酸/苏氨酸蛋白激酶,在有丝分裂中起核心作用。其编码蛋白的部分功能是通过磷酸化有丝分裂检查点复合体的成员和激活纺锤体检查点而发挥作用。已有研究表明,BUB1 的突变与非整倍性和几种癌症有关,但尚未见有关BUB1 与GIST 恶化相关的报道。KIF4A[19](kinesin family member 4A)编码的蛋白是一种依赖三磷酸腺苷的微管基运动蛋白,可参与膜性细胞器的细胞内运输;这种蛋白质也与浓缩的染色体臂相关联,并可能在有丝分裂期间参与维持染色体完整性。目前研究较多的是KIF4A 可能在胞质分裂前参与中枢神经的组织。KIF2C[20](kinesin family member 2C)编码一种驱动蛋白样蛋白,起微管依赖分子马达的作用;其主要在正端解聚微管,从而促进有丝分裂染色体的分离。而KIF20A[1](kinesin family member 20A)基因目前研究的还较少。值得注意的是,我们通过数据挖掘所得到的这些基因发挥的作用(有丝分裂及细胞周期的变化)与我们预测的信号通路(细胞的增殖、分化)息息相关;但其是否在GIST 恶化过程中也发挥着重要作用有待进一步的体内外实验验证。
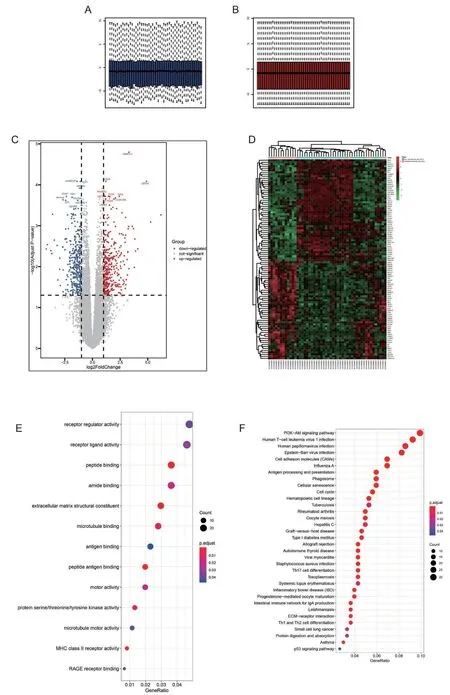
图1
总而言之,本研究通过对GEO 数据库中的关于恶性GIST(转移性和高危GIST)和恶性程度较低的GIST(低和极低风险GIST)的相关数据进行挖掘,发现GIST 恶化过程中潜在的关键基因与通路。通过对这些关键基因与通路进行分析,发现他们在肿瘤形成当中可能发挥的作用,可为今后进一步开展实验研究,探索GIST 的发生、发展及抗肿瘤药物的研制提供思路和依据。同时,从治疗及患者手术预后角度而言,运用手术及基因靶向治疗的多种机制相契合,运用系统生物学方法可更好地探索GIST 的恶化,通过信息学手段全面地构建通路网络,可以为后续GIST 的恶化过程干预机制研究提供潜在的思路。
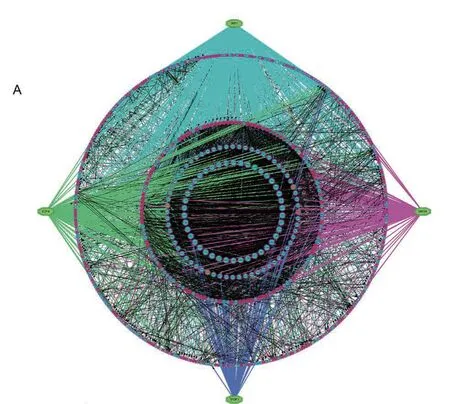
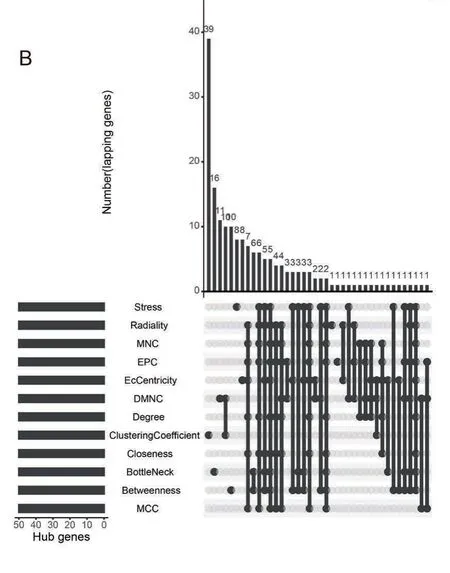
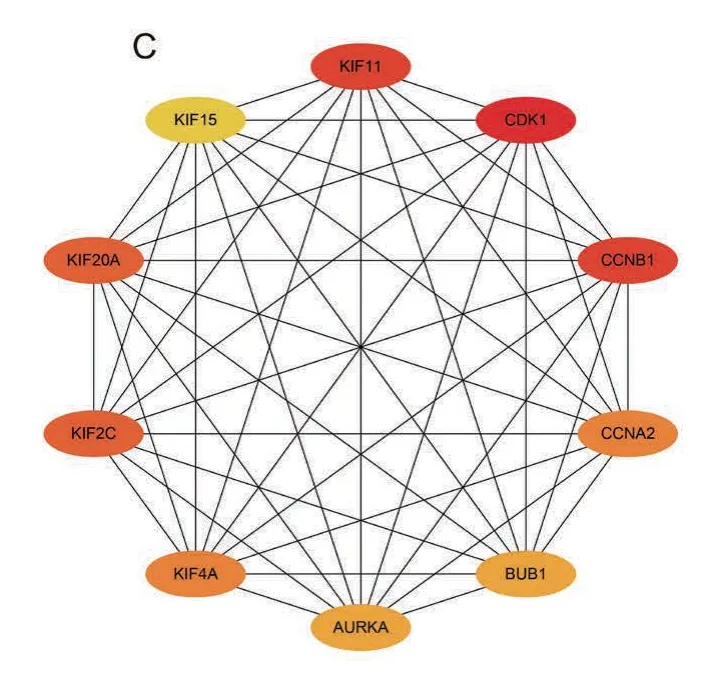
图2

