猪小肠黏膜下层脱细胞基质中I、Ⅲ型胶原检测方法研究
张 扬, 陈 毅, 高建萍, 夏磊磊, 李勇超, 王清石, 张贵锋, 赵 博
(1. 北京博辉瑞进生物科技有限公司, 北京 100026; 2. 中国科学院过程工程研究所 生化工程国家重点实验室, 北京 100190; 3. 河南科技学院 生命科技学院, 新乡 453003)
猪小肠黏膜下层脱细胞基质(SIS, Small intestinal submucosa)是猪小肠黏膜下层去除免疫原性物质后的生物材料,可诱导细胞黏附生长、促进组织再生,广泛用于各种软组织缺损的修复[1-3]。胶原是动物组织细胞外基质(ECM)的重要结构蛋白,约占其总蛋白的25%~30%,主要存在于皮肤、骨、肌腱及结缔组织等部位[4-6],其自身具有良好的生物相容性和低免疫原性[7],在高温、酸、碱或酶等条件下可被降解,性能也随之改变。大量研究表明,胶原作为敷料可抑制溃疡、调节T细胞抗炎因子释放以改善关节炎并增加骨密度,通过增强NK细胞活性提高免疫力,被用作止血、药物缓释以及组织工程和化妆品等材料[7-10]。
目前确认的胶原类型有27种,其中Ⅰ、III型是ECM中两种主要胶原,其比例与组织修复质量相关[11-13]。文献报道的胶原类型鉴别和定量方法主要包括基于溴化氢降解的多肽分析法,基于光度分析的羟脯氨酸(Hyp)比色法、高效液相色谱法(HPLC)、免疫学检测法及基于化学染色的天狼星红法等[4,14-15]。目前最常用的方法是羟脯氨酸比色法,但不同来源或组织的胶原中所含Hyp的比例也不同,而且过程繁琐,样品水解程度对结果影响较大,故该方法准确性不高[16];免疫学检测法以胶原作为抗原,利用其和抗体结合显色来检测胶原含量,该方法灵敏度高、特异性强,但重复性较差且不适用于组织样本[17];天狼星红法灵敏度较高,对Ⅰ、Ⅲ胶原染色特异性强,但其检测结果与组织切片厚度和位置相关,不适用于非均匀组织的胶原含量分析[18]。因此,建立一种组织胶原的类型及含量检测方法尤为必要。
本实验中胶原被胰蛋白酶特异性降解,再通过高效液相色谱-质谱(HPLC-MS)联用技术检索和识别Ⅰ、III型胶原的特征多肽并进行定量分析,可识别动物组织ECM中不同类型胶原并准确定量。
1 材料与方法
1.1 材料
1.1.1 供试材料与试剂
SIS(VIDASISTM)取自北京博辉瑞进生物科技有限公司;SIS(Biodesign®)购自美国库克公司;Ⅰ、Ⅲ型胶原标准样品购自YO Proteins AB公司;胰蛋白酶(序列纯)购自Promega公司(美国)。
1.1.2 主要仪器
高效液相色谱-质谱联用系统(HPLC-MS)由1100液相色谱(美国Agilent公司)和LCQ DecaXP电喷雾质谱(美国Thermo Fisher公司)组成,数据处理软件Xcalibur 3.0;液相色谱-三重四级杆质谱联用系统由U3000液相(美国Thermo Fisher公司)和TSQ Quantum ACCESS MAX质谱组成,数据处理软件为Xcalibur 3.0。
1.2 实验方法
1.2.1 氨基酸组成分析
称取10 mg样品于安培瓶中,加入2 mL HCl(6 mol/L),110 ℃条件下水解12 h,用6 mol/L NaOH 调至pH 7.0~8.0,60 ℃避光衍生1 h。通过HPLC检测Hyp含量,根据Hyp比例对样品中总胶原进行定量[15,19]。
1.2.2 胰蛋白酶酶解
SIS、猪跟腱及真皮ECM粉碎后分别称取10 mg,加入10 mL NH4HCO3缓冲液(50 mmol/L, pH 8.0),100 ℃变性10 min,冷却至室温后按照50∶1的比例加入胰蛋白酶,37 ℃酶解16 h,酶解产物进行HPLC-MS分析[1]。
1.2.3 分析方法
1)羟脯氨酸HPLC分析条件
色谱柱为Zorbax C18 [250 mm×4.6 mm(I.D.),5 μm];流动相A:0.05 mol/L乙酸钠溶液,流动相B:乙腈∶水(1∶1,V/V);梯度0~15 min, 30% ~55% B,15~25 min, 55%~100% B,25~35 min, 100% ~30% B,进样量5 μL;UV为360 nm;流速1 mL/min。
2)HPLC-MS质谱条件
色谱柱为Zorbax SB C18 [150×2.1 mm(I.D.),5 μm];流动相A:水(含0.1%甲酸),流动相B:60%乙腈(含0.1%甲酸);梯度0~120 min,5%~100% B;进样量50 μL;流速0.2 mL/min。
质谱条件:离子源喷雾电压4.5 kV,毛细管温度300 ℃,扫描范围m/z 300~2000,精确质量数扫描和二级质谱扫描均为数据依赖型扫描,碰撞能量为35%。选择离子扫描,Ⅰ型胶原特征多肽的 m/z为773.90,Ⅲ型胶原特征多肽的 m/z为533.09。
2 结果与分析
2.1 HPLC法检测Hyp
Hyp是胶原的特征氨基酸,其在哺乳动物胶原中的比例约为12%,几乎不存在于其他蛋白质[14,17]。本实验通过HPLC法检测定VIDASISTM和Biodesign®两种SIS产品中的Hyp含量,经换算得到其胶原含量分别为87.16%±1.31%和89.93%±1.99%。
2.2 基于质谱的检测方法
2.2.1 Ⅰ、III型胶原特征多肽筛选
将猪胶原标准品的酶解产物用离子阱质谱Full Scan模式进行检测,图 1为猪胶原标准品酶解多肽的总离子流图。
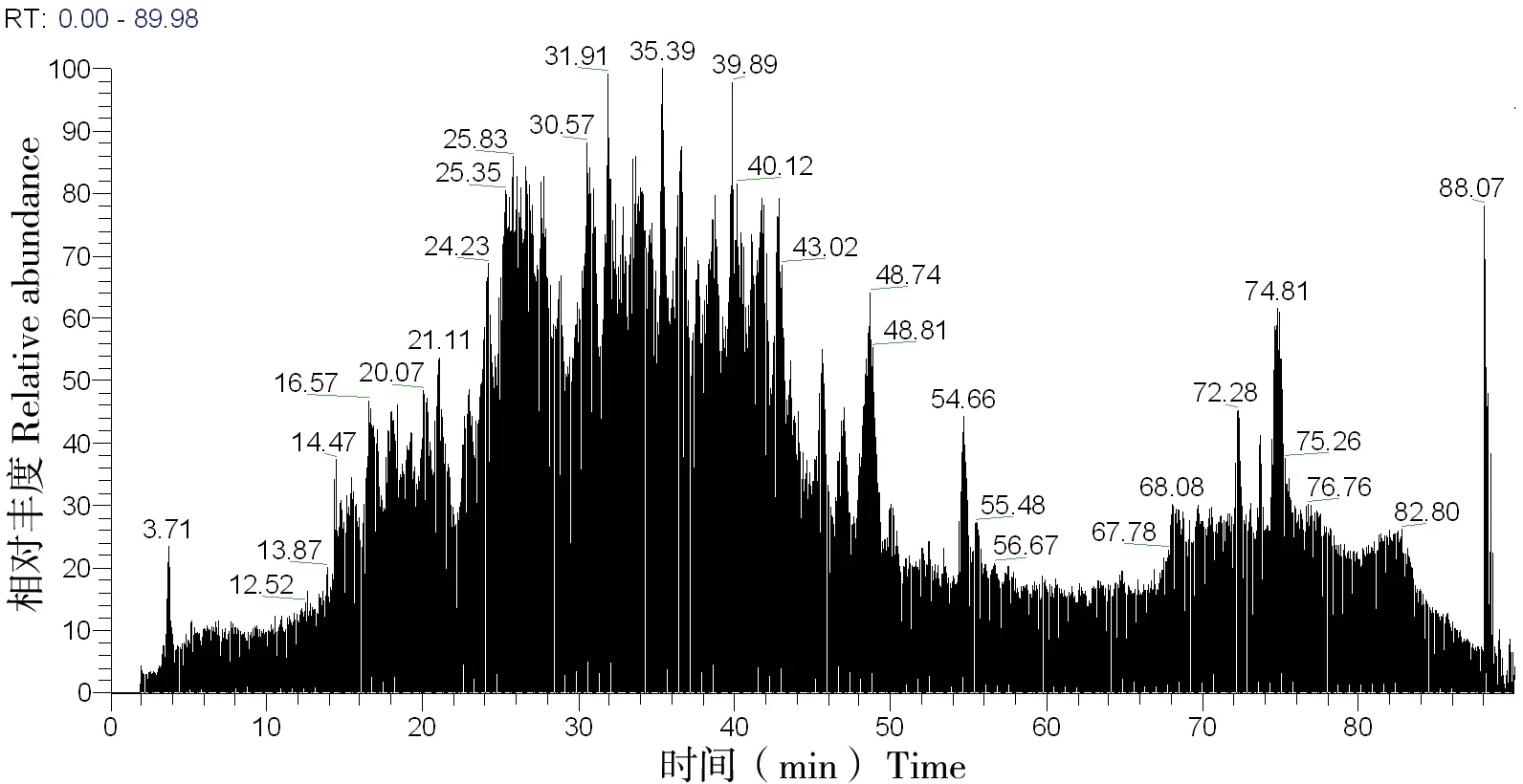
图1 猪胶原标准品酶解多肽总离子流图
胶原经变性处理后可被胰蛋白酶(序列纯)降解,酶解产物中存在大量分子量接近、等电点和亲疏水性相似的多肽;实验对多肽进行BLAST序列比对,确定猪I、III型胶原特征肽。胶原酶解产物经HPLC分离后,多肽逐一通过质谱进行检测,在质谱图中形成不同质荷比的离子信号,多肽质谱信息用搜库软件结合数据库搜索,多肽过滤参数参考文献[1,15],Xcorr>1.5(单电荷),Xcorr>2.0(2个电荷),Xcorr>2.5(3个电荷),同时Deltacn>0.1,信噪比S/N>10,满足要求的肽段视为阳性结果,即可作为候选特征多肽,多个符合条件的候选肽段又宜选择肽段较短、羟基化位点较少、二级碎片离子匹配度较高的肽段。特征多肽通过选择离子监测模式检测可提高低浓度样品的信号强度。
采用上述方法得到猪I、III型胶原的特征多肽分别为GETGPAGPAGPVGPVGAR、GPPGAVGPSGPR。图 2和图 3分别为猪I型胶原标准品特征多肽经质谱分析后获得的提取离子流图以及二级质谱图。

图2 猪Ⅰ型胶原标准品特征肽段的提取离子流图及含一级质谱图
2.2.2 猪胶原特征多肽浓度与信号强度关系
分别对猪I、III型胶原特征多肽的目标离子m/z 773.9和533.09进行选择离子监测,以样品浓度为横坐标、峰面积为纵坐标作线性回归曲线。图4和图5分别为猪I型胶原特征多肽GETGPAGPAGPVGPVGAR的提取离子流图和线性回归曲线[y=171.04x+4.154(R2=0.9984)],二者线性关系良好。利用相同的方法得到猪III型胶原的线性回归曲线为y=41.54x+1.63(R2=0.9981)。按照1.2.2中的方法处理样品,进行定量分析。
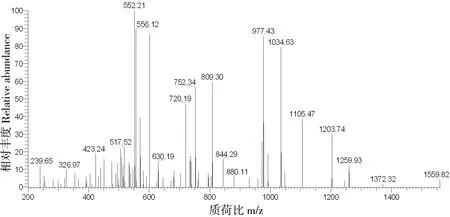
图3 猪Ⅰ型胶原标准品特征肽段的二级离子质谱图
2.2.3 猪不同组织ECM中胶原类型及含量检测结果分析
VIDASISTM中Ⅰ、III型胶原分别为28.09%±0.67%和59.5%±1.42%,Biodesign®中Ⅰ、III型胶原分别为27.56%±0.60%和65.71%±1.56%,Ⅰ、Ⅲ型胶原的总和与HPLC法检测的总胶原含量较接近。Ⅲ型胶原主要存在于血管、淋巴管和肠胃ECM中,而猪小肠黏膜下层是小肠多层膜结构之一,其内存在大量的血管和淋巴管,因此,III型胶原在SIS中含量较高。

图4 不同浓度Ⅰ型胶原特征多肽GETGPAGPAGPVGPVGAR提取离子流图

图5 Ⅰ型胶原特征多肽GETGPAGPAGPVGPVGAR浓度与峰面积标准曲线
为进一步验证该方法的可行性,对猪不同组织中Ⅰ、III型胶原的含量进行检测。结果表明,猪跟腱ECM中Ⅰ、III型胶原的含量分别为59.13%±1.38%和2%,此结果与文献报道一致,跟腱中胶原约占其干重的70%,其中Ⅰ型胶原占总胶原的95%左右,III型胶原低于4%[20-21]。猪真皮ECM中Ⅰ、III型胶原含量分别为54.87%±1.31%和26.54%±0.35%,此结果与文献报道一致,真皮中III型胶原的含量与年龄相关,胎儿期最高可达50%左右,随着年龄的增长Ⅰ型胶原逐渐增加,有研究表明老年人皮肤中Ⅰ、Ⅲ型胶原的比值为2.97±0.40[22-23]。SIS和猪跟腱、真皮ECM中Ⅰ、Ⅲ型胶原的含量检测结果符合胶原在动物组织中的分布规律。
2.3 方法学实验
2.3.1 精密度
按照2.2.2的方法,对样品中m/z 553.09的肽段重复检测3次。图6为样品中m/z 533.09质谱图,峰面积相对偏差RSD=2.38%,表明该方法精密度较高。
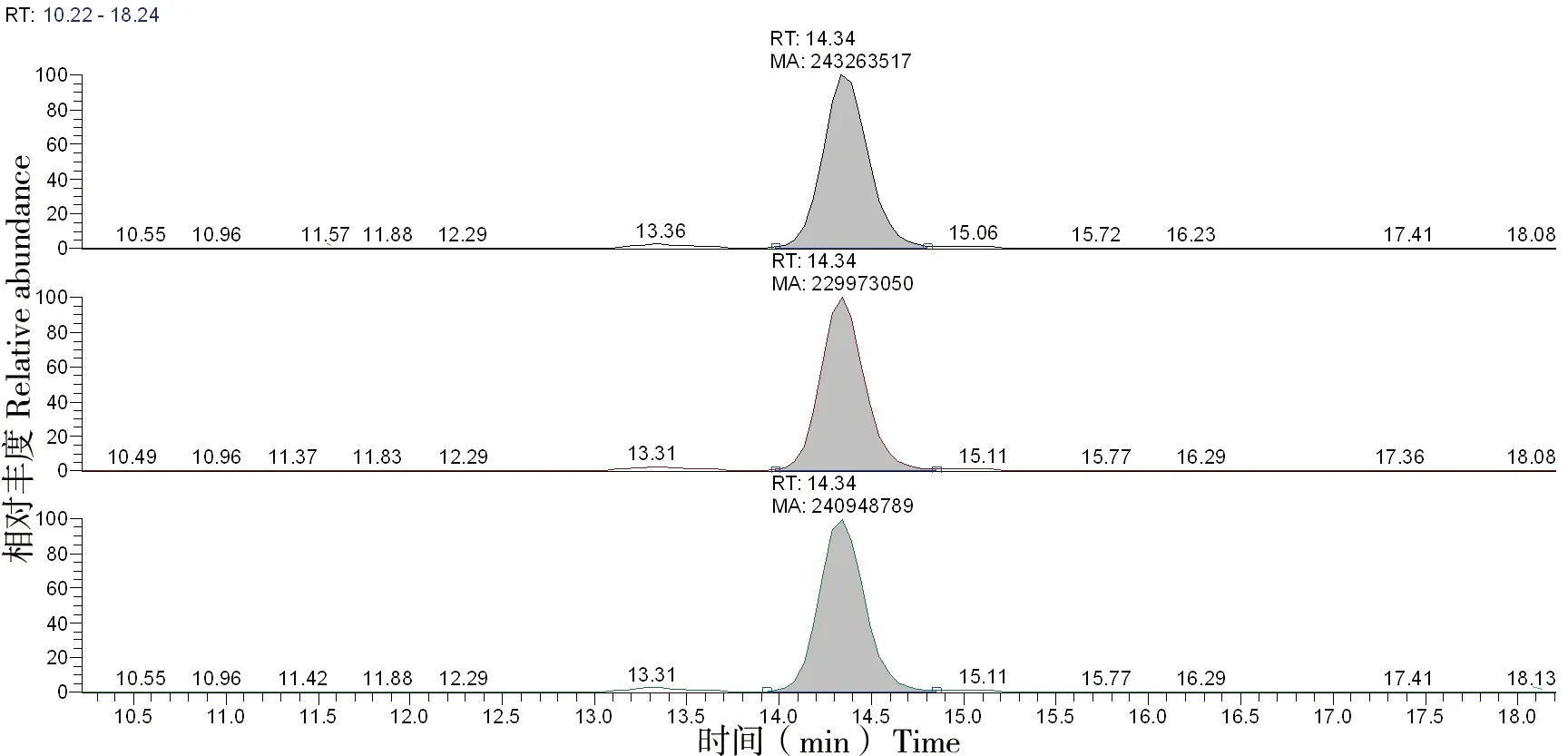
图6 基于HPLC-MS的胶原检测方法精密度分析
2.3.2 稳定性
将胶原酶解产物置于-20℃保存,分别于1、10、15和20 d取样,对III型胶原特征多肽GPPGAVGPSGPR进行检测,峰面积分别是2.2×108、2.0×108、1.98×108和2.3×108,证明该方法稳定。
3 讨论
胶原和细胞外基质是当前植入性医用材料的热点,其本身具有低免疫原性和可降解性,可促进组织再生。目前,组织胶原的定性、定量检测还主要依赖于胶原的特征氨基酸Hyp的测定、免疫学检测和化学染色等方法[24]。本研究建立的基于HPLC-MS的胶原特征多肽检测方法,可以特异性地检测不同类型胶原的含量,将类型识别和定量检测结合到同一方法中,操作简便。
由于不同动物来源的胶原氨基酸序列不同,该方法通过特征多肽不仅可以对组织或材料进行胶原成分表征,还可动态监测胶原材料在体内的降解情况,降低动物自身胶原对其检测的影响,在一定程度上补充天狼星红染色等方法的不足[25]。此外,通过该方法检测特定组织中不同类型胶原的含量,可辅助某些胶原相关疾病的诊断和治疗[26]。

