线叶龙胆(Gentiana lawrencei var. farreri)ITS序列杂合性与遗传分化分析
付鹏程, 林清银, 孙姗姗
(洛阳师范学院 生命科学学院, 洛阳 471934)
龙胆属植物是典型的高山植物,以青藏高原及其周边地区为分布中心和分化中心[1-2]。线叶龙胆(Gentianalawrenceivar.farreriT. N. Ho)是龙胆属多枝组中的常见物种,多年生草本,是青藏高原特有植物,也是高山草甸的重要组成部分。线叶龙胆可用于医药,具有较高的药用价值;同时其花色素雅,形态优美,也具有较高的园艺观赏价值。已有的进化研究表明,线叶龙胆的叶绿体基因组存在ndh基因缺失[3];基于叶绿体片段和微卫星标记的群体研究表明,该物种目前的遗传格局受到了冰川运动及环境气候变化的显著影响[4]。
ITS序列(Nuclear ribosomal internal transcribed spacer)是核糖体RNA 18S、5.8S和25S的间区序列,分别为ITS1和ITS2,其中ITS1-5.8S-ITS2序列是进化生物学中常用的分子标记之一[5-6]。相较于叶绿体或线粒体的单亲遗传,ITS序列位于细胞核,遵循双亲遗传规律,在揭示种间杂交等复杂进化过程中具有重要作用。由于ITS位点的通用引物在不同物种中均易于扩增,且其基因间区的序列变异较大,是重要的barcoding标记之一[5],能较好地反映种间系统发育关系。ITS序列在物种居群内往往也存在较丰富的变异,可用于群体遗传学研究[7-8]。然而,由于ITS序列常存在杂合现象,经PCR扩增后直接Sanger法测序的结果常出现套峰或乱峰,导致无法准确获取部分物种的序列。
本研究以线叶龙胆的7个居群为研究对象,通过对部分个体进行基因克隆与测序,探讨线叶龙胆ITS序列的基本特征及其遗传分化,研究结果将为龙胆属植物的进化研究提供参考。
1 材料和方法
1.1 样品采集
在青海、四川和西藏等地采集线叶龙胆7个居群共39个个体。在居群内,每个个体间距至少10 m;选取幼嫩的叶子用干燥硅胶快速干燥,密封保存于-20 ℃中。
1.2 DNA提取与PCR扩增
用CTAB法[9]提取总DNA,用1%琼脂糖检测。选用通用的ITS1a-ITS4引物[10]进行PCR扩增,扩增体系和扩增反应见表1,得到线叶龙胆的ITS1-5.8S-ITS2序列。将PCR产物纯化后用ABI3730xl(Applied Biosystems, USA)进行双端测序,发现测序结果存在严重的套峰和乱峰,可能存在高度的杂合性。
1.3 分子克隆与测序
为解决序列杂合性问题,将PCR产物用MiniBEST胶回收试剂盒(TaKaRa, China)回收,1%琼脂糖电泳检测,用分光光度计NanoDrop 2000(Thermo Scientific, USA)测定浓度后,与pMD 18-T载体(TaKaRa, China)在16 ℃连接4 h,5 μL反应体系如下:载体50 ng,PCR纯化产物20 ng, Solution I 1.0 μL。连接后的产物与E.coliDH5α感受态细胞(Takara, 大连)进行转化,操作参见产品说明书。37 ℃培养1 h后涂平板做蓝白斑筛选,37 ℃倒置过夜培养。每个样品挑取3~10个阳性单克隆在LB培养基中培养3~5 h,对菌液做PCR检测,反应体系和扩增程序见表1。阳性克隆用BigDye v3.1(Applied Biosystems, USA)和ABI3730xl(Applied Biosystems, USA)测序。
1.4 数据分析
在软件GENEIOUS PRO 3.5.6[11]中查看测序结果,去掉载体序列,进行数据整理和比对。在软件DnaSP 5.1[12]中统计单倍型个数,在ARLEQUIN 3.5[13]中计算基因多态性(h)与核苷酸多态性(π),并通过分子变异分析(AMOVA)[14]检测遗传变异在居群内和居群间的分布情况。
采用最大似然法,在IQ-TREE[15]中基于单倍型构建系统发育树,核苷酸替换模型由IQ-TREE自动计算,设置bootstrap为100。参照龙胆属的系统发育关系[2],从GenBank中下载序列,以线叶龙胆的近缘类群蓝玉簪龙胆(AY858677),以及龙胆属秦艽组的麻花艽(MF579734)、粗茎秦艽(MF506958)和粗壮秦艽(KM190185),龙胆属龙胆草组的三花龙胆(KM051451)和一年生类群的钻叶龙胆(AY858671)为外类群。
2 结果与分析
2.1 序列特征
本研究对来自7个居群的39个个体进行基因克隆与测序,共得到81条ITS序列,长度为631~646 bp。这些序列在175个位置存在碱基变异,包含153个碱基突变和23个缺失/插入,共鉴定出76个单倍型(GenBank No. MN124292-MN124367, 表2)。在153处碱基突变中,两种碱基间的突变有142处,3种碱基间的突变有11处,分别占92.8%和7.2%。缺失/插入的碱基片段长度从1~14 bp,其中14 bp的缺失/插入只出现在居群6025的一个个体(6025_8)中。在这些线叶龙胆ITS序列中,碱基变异主要来源于ITS1和ITS2这两个间区,分别包含67处和76处变异,分别占总变异位点的38.28%和43.43%;5.8S核糖体RNA长度为156 bp,其中包含31个单碱基突变和1个14 bp的缺失/插入,占所有变异位点数的18.29%。这种高度杂合性,说明在线叶龙胆中对ITS序列的PCR产物直接测序是无法得到高质量结果的。
在鉴定出的76个单倍型中,仅有2个单倍型在多个克隆中共享,剩余74个单倍型均为单个克隆特有。在共享的2个单倍型中,一个单倍型分布于4123居群的2个个体中,另一个单倍型分布于6025居群的1个个体和6039居群的3个个体中。
2.2 遗传多样性与遗传分化
本研究中,线叶龙胆7个居群的基因多态性为0.9429~1,核苷酸多态性为0.007 924~0.034 529,遗传多样性高,但居群间的差异小(表2)。AMOVA分析表明,遗传变异中的87.61%来自居群内,仅有12.39%的遗传变异来自居群间(表3)。由于几乎每条序列均为一种单倍型,因此用个体名称来描述系统发育树,并将不同居群用颜色加以区分,以考察居群间是否存在谱系关系。结果显示,线叶龙胆ITS序列构成了5个遗传支系,但不同支系的支持率普遍较低,其中低于60%的支持率在图中均未标注(图1)。同一居群的不同个体在系统发育树上并不能聚到一支,而是分散于发育树中。

表3 基于ITS序列的线叶龙胆分子变异分析
3 讨论与结论
通过基因克隆,本研究发现线叶龙胆居群内ITS序列存在高度的杂合性和遗传分化,具体主要表现在两个方面。一是变异位点非常丰富。在线叶龙胆长度为646 bp的ITS序列中,变异位点占比27.24%,显著高于青藏高原的其他特有物种[7,16-18]。相较于基于叶绿体片段得到的遗传多样性指数[3],本研究的研究结果明显高于前者。二是个体间共享的单倍型少。在已鉴定的76个单倍型种,仅有2个共享单倍型,个体间以及居群间的遗传分化大,AMOVA的分析结果也证实了这一点。
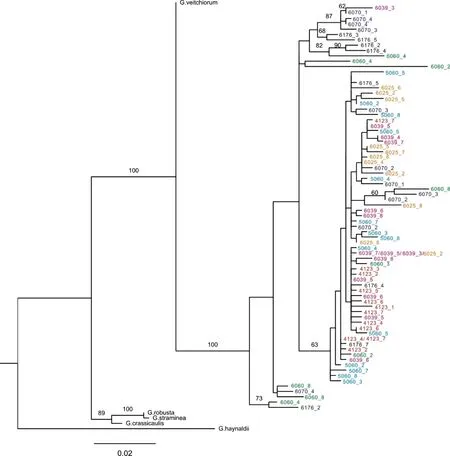
每个单倍型用个体标号表示;若一个单倍型为多个个体共享时,图中用“/”分隔;同一居群的个体用同一种颜色标注
对于线叶龙胆居群中ITS序列的高度杂合性,可能有如下3个原因。一是扩增与测序错误。本研究采用的一代测序方法,即Sanger测序法,是目前准确率最高的测序方法之一,常用于高通量测序结果的验证。然而,由于聚合酶存在一定的错配率,通过PCR扩增后的产物可能存在一些人为突变,尤其是扩增循环次数过大时错误率会增高,而测序过程本身也包括了一次PCR扩增。因此,测序错误是客观存在的,但错误率一般很低[18]。然而,本研究所检测的个体,均出现了大量的碱基替换以及缺失,且其频率远大于测序错误率,因此我们可以排除测序错误这一因素。二是核基因的杂合性。ITS序列是双亲遗传,杂合性是其特征之一。虽然在部分物种中ITS序列基本上为纯合,如石砾唐松草[8]等;但由于重组和自然杂交,ITS杂合性在生物中是普遍存在的,如菊叶红景天[3]、鲜卑花属[17]等。然而已报道的ITS序列在居群中的杂合性多为碱基突变,缺失与插入报道较少,而在本研究中发现个体内存在长达14 bp的缺失与插入。三是纯化选择不完全。由于ITS是串联重复序列,在生物体内存在大量的拷贝,经过长期的进化作用,生物体内的ITS串联序列一般是纯合的。然而,若串联序列在复制过程中出现变异,且纯化选择不完全时,一个个体内就会出现多种变异类型共存的情况。线叶龙胆的ITS序列的杂合度很高,可能是由核基因特性与不完全的纯化选择共同导致的。
ITS序列作为常用的分子标记片段之一,广泛用于系统发育树的构建和群体遗传结构分析。然而,在处理ITS杂合序列时,如果人工选取某一条序列或采用PHASE方法[19]进行分型,都无法得到个体内ITS序列的真实情况。由于同一个个体的不同单倍型在系统发育树上并不能聚成单系群,因此从同一个个体内的单倍型中选取一个来代表该个体的做法可能会影响系统发育关系重建及相关进化分析。虽然本研究中线叶龙胆ITS序列并未形成高支持率的支系结构,但不同个体间很少共享单倍型,而居群间共享的单倍型更少,随机取样仍可能给后续分析产生影响。尽管本研究对每个个体测序的单克隆数目有限,不足以覆盖全部的变异类型,但已充分说明线叶龙胆的 ITS序列存在高度的杂合性和丰富的遗传变异。因此,对于ITS序列存在高度杂合的物种,深入的克隆与测序工作是有必要的。

