多模态MRI观察颈椎源性疼痛患者全脑结构异常
杨 倩,张 明,王 渊
(西安交通大学第一附属医院医学影像科,陕西 西安 710061)
颈椎源性疼痛(cevical spondylotic pain, CSP)是由颈椎骨质增生、颈椎间盘退变等因素刺激邻近脊神经根或脊髓而引起的临床综合征,主要表现为颈肩部和上臂放射样疼痛,偶尔伴前臂麻木或无力[1]。CSP性质类似于慢性腰背痛,终将导致大脑结构及功能发生改变[2]。既往关于CSP的研究[3-4]多关注大脑功能改变。本研究采用基于体素的形态学(voxel based morphometry, VBM)技术和扩散张量成像(diffusion tensor imaging, DTI)观察CSP患者全脑灰质和白质结构改变,分析相应脑体积与临床特征的相关性,以期为探索CSP疼痛机制和潜在治疗靶点提供客观依据。
1 资料与方法
1.1 一般资料 收集2018年6月—2019年7月于西安交通大学第一附属医院就诊的慢性CSP患者31例(CSP组),男20例,女11例,年龄26~55岁,平均(41.2±9.3)岁;病程2~180个月,平均(40.74±8.09)个月;视觉模拟量表(visual analogue scale, VAS)评分1~8分,平均(4.48±1.93)分。纳入标准:①颈肩部疼痛,伴或不伴上臂放射性疼痛及前臂麻木,疼痛持续时间>2个月;②X线片提示颈椎骨质退行性变征象,未见感染性、肿瘤性或风湿性病变;颈椎MRI示颈椎间盘退变、膨出或突出,排除脊髓炎症、脊髓肿瘤、脊髓空洞征等器质性病变;③年龄25~55岁,右利手,视觉模拟量表(visual analogue scale, VAS)评分>3分。排除标准:①其他部位病变所致慢性疼痛史;②神经或精神疾病;③药物及酒精依赖史;④MR检查禁忌证。同期招募性别、年龄、受教育程度匹配的30名健康成人作为对照组,男20名,女10名,均为右利手。对2组受试者行情绪异常和认知障碍评分,包括汉密尔顿焦虑量表(Hamilton anxiety scale, HAMA)、汉密尔顿抑郁量表(Hamilton depression scale, HAMD)、蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)评分。本研究经院医学伦理委员会批准(批准号:2018伦审科字第G-3号),受试者或亲属均签署知情同意书。
1.2 仪器与方法 采用GE Signa HDxt 3.0 T超导型MRI仪,8通道正交头线圈,以橡胶垫固定受试者头部,予佩戴耳塞以降低噪音。先行常规全脑MR检查,而后采集全脑高分辨T1结构图像(3D-T1WI),采用快速扰相梯度回波序列,TR 10.9 ms,TE 4.9 ms,翻转角15°,FOV 256 mm×256 mm,矩阵256×256,层厚1 mm,层间隔0,层数140。之后采集轴位DTI,采用SE-EPI序列,TR 10 000 ms,TE 90.6 ms,FOV 240 mm×240 mm,矩阵 128×128,层厚 4 mm,层间隔0 mm,层数35,b值0、1 000 s/mm2,30个扩散方向。
1.3 图像分析
1.3.1 VBM数据处理与分析 以dcm2nii软件对3D-T1WI进行格式转换。采用Matlab 13.0和基于SPM 8软件将原始空间的3D结构像空间标准化为蒙特利尔神经科学研究所(Montreal Cognitive Assessment, MNI)制作的大脑结构平面图像,按照组织概率图(tissue probability maps, TPM)模板对标准化图像进行分割,获得灰质、白质和脑脊液图像。对灰质图像进行调制,使其体素值代表局部灰质体积,以8 mm半高全宽高斯核进行空间平滑。
1.3.2 DTI数据处理与分析 采用dcm2nii软件将DTI数据进行格式转换,以FSL软件进行涡电流校正,对齐到b=0的DTI并去除头皮组织,拟合扩散张量模型,计算扩散张量参数,包括各向异性分数(fractional anisotropy, FA)、平均扩散系数(mean diffusivity, MD)、轴向扩散系数(axial diffusivity, AD)及径向扩散系数(radial diffusivity, RD)。
1.4 统计学分析 采用SPSS 18.0统计分析软件。以±s表示符合正态分布的计量资料。采用χ2检验及t检验分别比较2组性别及年龄、情绪异常和认知障碍评分的差异。以两样本t检验比较组间脑灰质体积和白质参数的差异;设定体素水平P<0.001、簇水平P<0.05为组间差异具有统计学意义;采用Spearman相关分析观察差异有统计学意义的参数与疼痛水平(VAS评分)、情绪异常(HAMA和HAMD评分)及认知障碍(MoCA评分)的关系。P<0.05为差异有统计学意义。
表1 CSP组与对照组一般资料比较(±s)

表1 CSP组与对照组一般资料比较(±s)
组别男/女年龄(岁)HAMA评分HAMD评分MoCA评分CSP组20/1141.2±9.39.52±1.308.16±0.9025.94±2.72对照组20/1040.3±10.14.93±0.764.47±0.6926.80±1.73χ2/t值0.030.373.023.24-1.48P值0.840.71<0.01<0.010.15
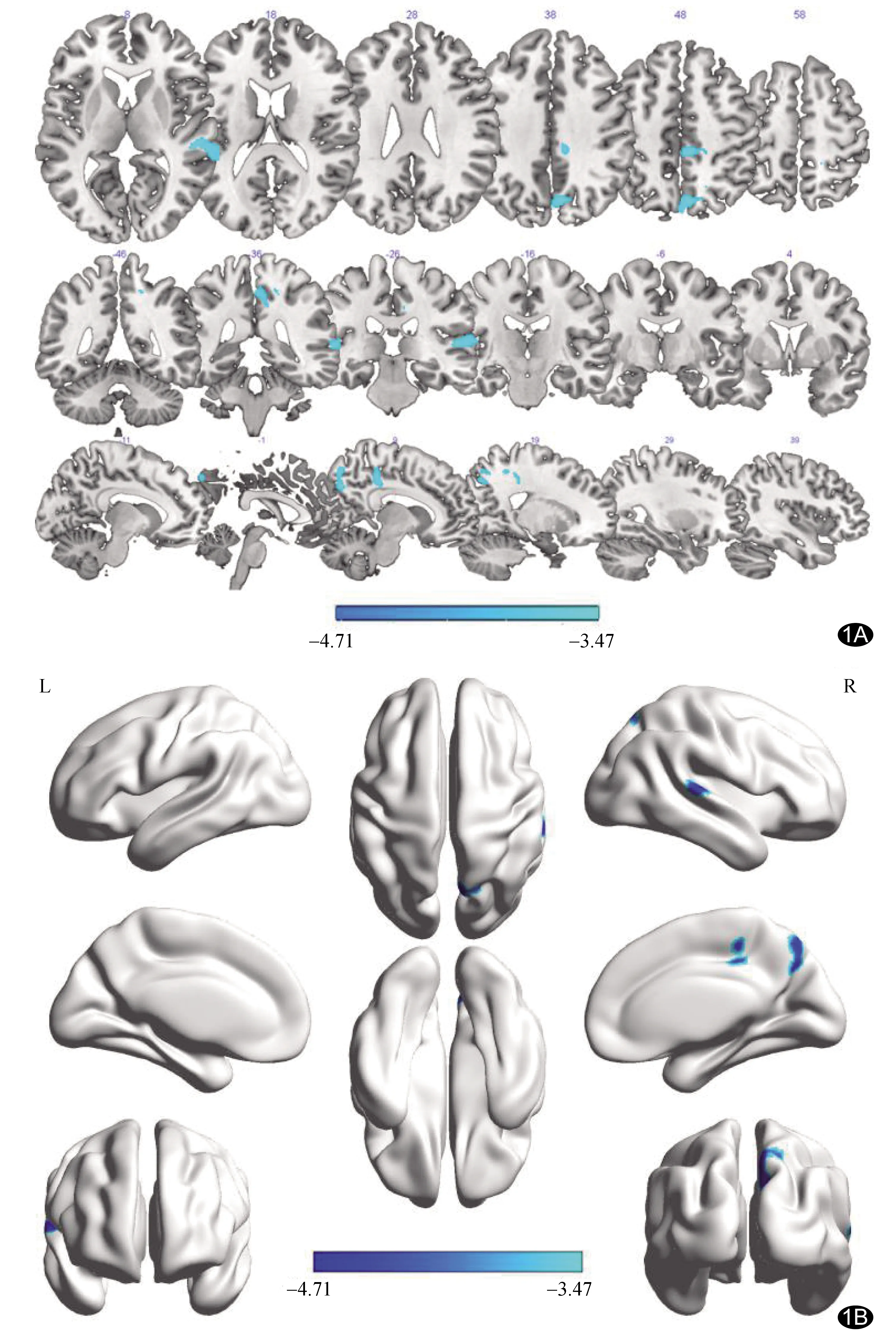
图1 VBM分析结果(蓝色代表CSP组体积减少脑区) A. 二维图像显示组间脑灰质体积差异; B. 三维图像组间脑灰质体积差异
2 结果
2.1 一般资料比较 2组性别、年龄及MoCA评分差异均无统计学意义(P均>0.05),HAMA和HAMD评分差异均有统计学意义(P均<0.05)。见表1。
2.2 脑灰质体积及脑白质参数比较 CSP组全脑总体积[1 412±114)cm3],白质体积[(515±56)cm3],脑脊液体积[(230±36)cm3],对照组分别为1 426±113)cm3、(502±52)cm3、(224±33)cm3,组间差异均无统计学意义(t=-0.68、0.67、0.57,P=0.37、0.48、0.50)。CSP组右侧楔前叶、右侧颞上回及右侧中扣带回灰质体积较对照组减少(图1)。CSP组左、右侧上纵束FA值(0.33±0.03、0.28±0.03,t=-3.12、-2.62,P均<0.05)相比对照组(0.37±0.05、0.31±0.04)减低(图2),而全脑MD、AD及RD值[(7.5±0.19×10-4)mm2/s、(11.6±0.24×10-4)mm2/s、(5.7±0.12×10-4)mm2/s]差异均无统计学意义[对照组分别为(7.4±0.17×10-4)mm2/s、(11.4±0.22×10-4)mm2/s、(5.6±0.10×10-4)mm2/s,t=1.07、1.10、1.25,P均>0.05]。
2.3 CSP组脑灰质体积异常及白质微结构异常脑区参数与临床指标的相关性 CSP组右侧楔前叶(rs=-0.397,P=0.045)、右侧颞上回(rs=-0.402,P=0.034)及右侧中扣带回(rs=-0.338,P=0.045)灰质体积均与VAS评分呈负相关,与HAMA、HAMD和MoCA评分均无明显相关(P均>0.05),见图3。CSP组左侧上纵束FA值与VAS评分呈负相关(rs=-0.460,P=0.014),见图4;其右侧上纵束FA值与VAS评分及双侧上纵束FA值与HAMA、HAMD和MoCA评分均无明显相关(P均>0.05)。
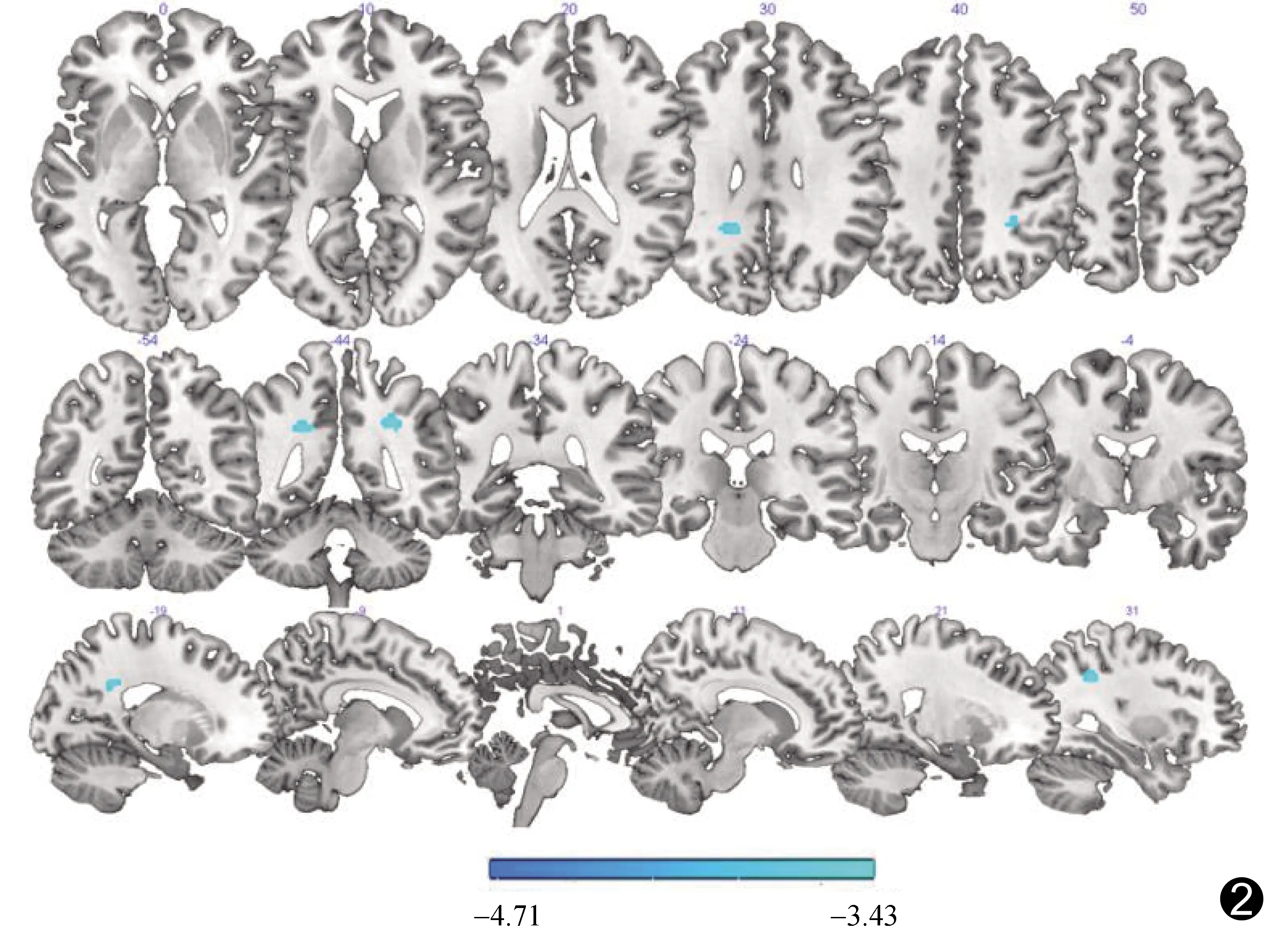
图2 CSP组FA值相比对照组减少脑区(蓝色)

图3 CSP患者体积减少脑区灰质与VAS评分相关性的散点图 A.右侧楔前叶; B.右侧颞上回; C.右侧中扣带回 图4 CSP患者左侧上纵束FA值与VAS评分相关性的散点图
3 讨论
VBM是一种自动识别全脑结构变化的后处理技术,可基于体素水平分析脑内结构异常。将全脑各项灰白质参数加以有机整合,有助于全面分析CSP脑结构层面改变,为评估病情和检测疗效提供影像学依据。本研究分析慢性CSP患者全脑结构水平是否存在可塑性改变,以及相应影像学指标与疼痛程度、情绪异常和认知障碍的相关性。
本研究结果显示,相比健康对照,慢性CSP患者右侧楔前叶、右侧颞上回和右侧中扣带回灰质体积不同程度减少,有关楔前叶结果与WOODWORTH等[5]的结论相似。楔前叶是默认网络的核心节点之一,参与心理活动、情感处理和对先前经历的回忆,有抵抗伤害刺激的作用[6]。经典疼痛矩阵是与疼痛感知、传导、处理及伴随情绪活动密切相关的脑区,相对离散而又互相影响,主要包括导水管周围灰质、丘脑、杏仁核、岛叶、前额叶皮质、扣带回前部及中部、第一及第二躯体感觉皮质等,共同构成复杂网络,是处理伤害感受性刺激的主要场所[7]。楔前叶虽不属于经典疼痛矩阵的关键脑区,但慢性疼痛时其结构可发生改变[8]。本研究发现楔前叶灰质体积与VAS评分呈负相关,提示强烈伤害性刺激对CSP患者的默认网络破坏更严重。
本研究结果显示CSP患者同时存在颞上回灰质体积减少,与TANG等[9]结果相符。椎间盘源性下腰痛所致脑结构异常包括颞上回体积萎缩[10]。颞上回与传出复制有关,主要监测预测感觉与实际感觉间的不匹配。有关慢性疼痛研究较少提及颞上回萎缩,可能源于对该区疼痛调节的解释有限。既往研究[8]指出,颞上回可能参与处理痛觉信息,提示CSP时伤害性传出抑制失败与该区灰质体积减少有关。颞上回灰质体积与疼痛严重程度呈负相关,表明该区体积萎缩可能导致患者对颈椎疼痛的感知存在偏差[7]。
CSP患者右侧中扣带回亦存在灰质体积萎缩现象,该现象也可见于三叉神经痛[8]、颞下颌关节紊乱综合征[11]患者。中扣带回是痛觉矩阵的核心脑区之一,参与多维调节痛觉信息,包括痛觉、负面影响和认知控制[12],同时与疼痛致恐惧回避、环境监测和运动定向有关[13],属于边缘叶的一部分,与疼痛经历中的有效处理有关[14]。IVO等[15]认为中扣带回萎缩将促进从急性疼痛过渡到慢性疼痛状态。本研究CSP组中扣带回灰质体积与VAS评分呈负相关,提示严重疼痛可能导致CSP患者在痛觉感知、情绪调节和逃避反应方面产生障碍。
DTI技术能在体显示组织内水分子扩散特征,评估脑白质微观结构变化。FA值反映白质髓鞘的完整性、致密性及平行性,FA值减低是脑白质纤维束变性的敏感指标[16];MD值可更客观地反映水分子的扩散程度,RD值升高常提示髓鞘完整性破坏及髓鞘脱失,AD值升高则提示反应性神经胶质增生[17]。本研究发现CSP组出现双侧上纵束FA值对称性减低,此亦可见于三叉神经痛患者[18]。上纵束是额叶、顶叶、颞叶和枕叶皮层的联合纤维系统,起源于额叶皮质,经过鳃盖,止于外侧裂后部;该处有许多神经元向枕叶皮质发出纤维辐射,而其他神经元于壳核周围向前下方旋转,向颞叶皮质发出纤维辐射[19]。WANG等[20]指出,上纵束是上行痛觉传导通路的重要组成部分,CSP患者双侧上纵束FA值均减低,推测痛觉传入神经纤维的髓鞘完整性破坏,但需结合神经解剖和神经生理学实验进行确认。本研究中CSP患者灰白质微结构与其他临床指标无明显相关,可能由于慢性颈肩痛所致情绪异常、认知障碍程度的累积效应尚不足。
综上所述,CSP患者右侧楔前叶、右侧颞上回及右侧中扣带回灰质体积减少,伴双侧上纵束FA值对称性减低;联合应用VBM技术及DTI可评估颈椎源性疼痛患者全脑灰白质微结构改变。

