HPA-1-6/17基因多态性与青岛市血小板减少症遗传易感性的关系分析
成枫 许宏 肖淑欣 赵洪国
免疫性血小板减少症(immune thrombocytopenia,ITP)又称为血小板减少性紫癜,是临床常见的出血性疾病之一,其治疗手段主要依赖激素治疗,但效果较差,且复发率高[1]。作为自身免疫性疾病,ITP发病机制可能与机体免疫功能紊乱有关。研究认为,机体免疫功能紊乱可导致产生血小板表面糖蛋白自身抗体,抗原抗体结合后,单核巨噬细胞系统激活,最终导致血小板被破坏,出现血小板减少[2]。随着分子生物学技术的发展,人们发现免疫遗传学在ITP发病中发挥重要作用。已有研究表明,ITP发病可能与血小板特异性抗原(human platelet alloangtigen,HPA)基因多态性有关[3]。HPA是血小板膜糖蛋白上的特异性抗原表位,至今已有34个HPA被确定,在临床上研究较多的为HPA-1~17bw,其中除了HPA-14bw多态性表现为3个碱基缺失,其他抗原均为单核苷酸多态性(SNP)[4]。本研究通过青岛市地区ITP患者与正常人群HPA1-6及HPA17抗原基因多态性,旨在研究其与当地人群ITP发生的关系。
资料与方法
1 临床资料 选取2013年~2016年青岛大学附属医院确诊收治的ITP患者1 2 6例为研究对象,其中男4 5例,女8 1例,年龄1 8~7 4岁,平均年龄(42.7±15.8)岁,患者家族三代以内为常驻青岛市区及周边区县汉族人群。纳入标准:①患者诊断符合ITP诊断标准[5];②患者未接受血小板输注治疗;③患者未使用免疫抑制剂或激素治疗,或已停止药物治疗1个月以上;④患者及家属签署知情同意书。排除标准:①资料不全,不配合治疗患者;②合并甲状腺疾病、淋巴系统增殖性疾病患者;③血栓性血小板减少紫癜患者,或是由药物引起的血小板减少患者;④白血病、结缔组织经等其他可引起血小板减少的疾病患者。选取我院同期健康体检者120例为对照组,其中男性46例,女性74例,年龄18~72岁,平均年龄(43.7±14.7)岁,家族三代以内均为常住青岛市区及周边区县地区人群。两组年龄、性别差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准。
ITP诊断标准[5]:多次诊断化验结果显示血小板减少;脾脏不肿大或轻度肿大;骨髓检查发现巨核细胞增多、有成熟障碍,同时满足以下任何一项患者:①可排除继发性血小板减少;②切脾治疗有效;③血小板相关免疫球蛋白(platele associated immunoglobulin,PAIg)增多;④PAC3(platele associated complement 3,PAC3)增多;⑤泼尼松治疗有效。
2 方法
2.1 样本采集 两组受试者均空腹采取肘静脉血5 mL,加入乙二胺四乙酸二钾(EDTA-2K)抗凝剂,充分混匀。–20℃保存待检。
2.2 基因组DNA提取 采用QIAamp DNA Blood Mini Kit试剂盒提取基因组DNA。操作步骤严格按照说明书进行。
2.3 PCR-SSP基因分型 根据GenBank序列信息和公开数据设计合成HPA1-6及HPA17基因分型引物,引物序列见表1。本研究选取人类生长激素(HGH)基因的保守片段为内参,PCR反应体系为27 μL,模板DNA 2 μL,Taq酶0.5 μL,含有基因分型引物及内参引物的混合扩增反应混合液24.5 μL,93 ℃变性3 min,93 ℃ 30 s,60 ℃ 30 s,40个循环,72 ℃延伸30 s。电泳凝胶成像记录。
2.4 结果判断 每孔均应出现内参条带,在相应电泳位置上出现特异性条带认为有相应等位基因,判为阳性;只有内参条带,则无等位基因,判为阴性;若两者均未出现则需要重新检测。
3 统计学处理 哈迪-温伯格(Hardy-Weinberg equilibrium,HWE)检验研究组和对照组等位基因和基因型频率以及各SNP位点基因型和基因分布,HWE平衡检验采用Fisher精确检验,χ2=∑[(检测值-预期值)2/预期值]。基因及基因型频率采用群体遗传基因计数法计算:假设等位基因a和b的频率分别为p和q,纯合子aa的频率为p2,bb的频率为q2,杂合子的频率为2pq,其中p2+q2+2pq=1。利用CLUMP软件对SNPs基因型、等位基因及单倍型在研究组和对照组人群分布频率进行显著性检验;P<0.05表示差异有统计学意义,且OR值处于95%置信区间内。

表1 合成HPA1-6及HPA17基因分型引物序列
结 果
1 HPA基因分型结果 ITP患者及正常人群HPA的PCR-SSP基因分型结果电泳图(两组各选1例),见图1。
2 HWE平衡检验 青岛市ITP患者及正常人群HPA基因多态性符合Hardy-Weinberg定律(P>0.05)。见表2。
3 两组HPA1-6及HPA17基因型频率比较 ITP组患者与正常人HPA1-2、HPA4-6、HPA17基因型频率差异无统计学意义(P>0.05);两组HPA-3基因型频率差异有统计学意义(P<0.05),与对照组比较,ITP组患者HPA-3 aa基因型频率显著降低(P<0.05),HPA-3 bb基因型频率显著升高(P<0.05)。见表3。
4 两组HPA1-6及HPA17基因频率比较 ITP组患者与正常人HPA1-2、HPA4-6、HPA17等位基因频率差异无统计学意义(P>0.05);两组HPA-3等位基因频率差异有统计学意义(P<0.05);ITP患者HPA-3a基因频率显著低于对照组(P<0.05),HPA-3b基因频率显著高于对照组(P<0.05)。见表4。
5 HPA1-6及HPA17基因多态性与ITP遗传易感性关系以发生ITP因变量,将HPA1-6、HP17基因多态性纳入Logistic回归分析,结果表明,HPA-3b与ITP遗传易感性有关(P<0.05)。见表5。
讨 论
ITP是一种免疫综合征,以外周血血小板减少、自发性皮肤黏膜出血为主要症状,目前尚无治疗该疾病的速效药物,患者可能需要经历较长的治疗周期,且会出现病情复发及药物并发症。HPA是定位于血小板膜糖蛋白上的特异性抗原表位,是重要的遗传学标记[6,7]。大量报道证明其基因多态性与ITP发病相关,因此针对HPA基因多态性寻找ITP易感基因[8,9],对于ITP疾病预测和及早介入治疗具有重要意义。
在已确定的34个HPA中,HPA1-5和HPA15为双等位基因表达。HPA基因多态性具有地域和种族异性,研究发现,HPA在ITP患者中较在正常人群表现出高度遗传多态性,基因型及等位基因频率分布与人群和地区分布有关。Refsum等[10,11]研究发现,亚洲人群中HPA-1基因主要为aa纯合子,其等位基因HPA-1b较为罕见,但在白种人中可检测到HPA1b/1b纯合子。在本研究中,未检测到HPA1b/1b纯合子,但检测到HPA-1a/1b杂合子,与车进等[12]研究结果一致。本研究对HPA1-6、HPA17系统等位基因概率分布进行Hardy-Weinberg平衡检验,发现均符合Hardy-Weinberg定律,表明本研究选取的青岛市人群ITP患者及正常人群样本具有一定代表性。

表2 HWE平衡检验

表3 两组HPA1-6及HPA17基因型频率比较
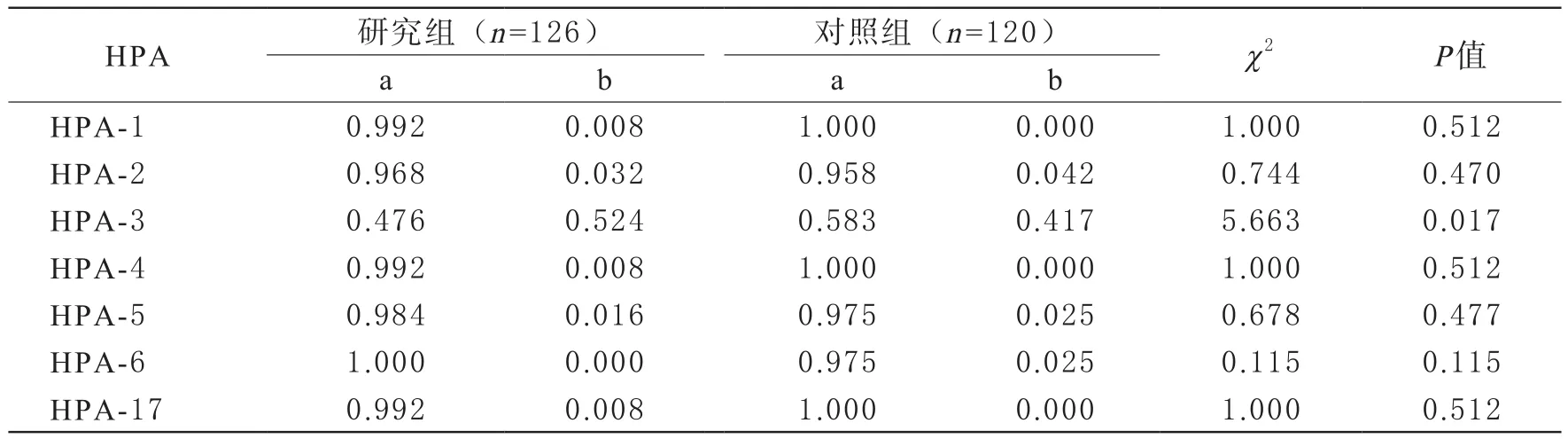
表4 两组HPA1-6及HPA17基因频率比较
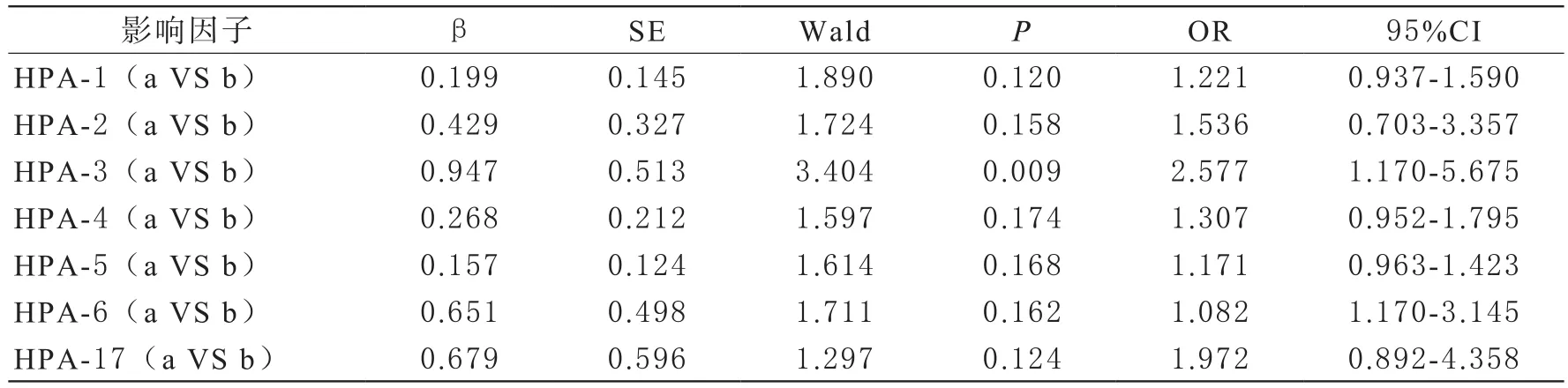
表5 HPA1-6及HPA17基因多态性与ITP遗传易感性关系
Carmo等[13]研究结果显示,巴西北部ITP患者中,HPA-5b等位基因频率较正常人显著升高,提示HPA-5b可能与当地人群血小板特异性抗原表位形成有关。孙学兰等[11]研究显示,河南省ITP患者HPA-3基因频率与正常人差异显著。本研究在ITP组患者与正常人中均未检测到HPA1-2、HPA4-6、HPA17基因bb纯合子,且基因型频率差异无统计学意义,而两组HPA-3具有高度遗传多态性,且与对照组比较,ITP组患者HPA-3 aa基因型频率显著降低,HPA-3 bb基因型频率显著升高,提示HPA-3 bb纯合子基因型突变可能与ITP发病有关。进一步统计分析发现,ITP组患者与正常人两组受试者HPA1-2、HPA4-6、HPA17等位基因频率差异无统计学意义,两组HPA-3基因频率差异有统计学意义,推测在青岛市人群中,HPA-3系统与ITP疾病发生有关,ITP患者HPA-3a基因频率显著低于对照组,HPA-3b基因频率显著高于对照组,携带HPA-3b等位基因可能是ITP发病的易感因素。Logistic回归分析结果表明,HPA-3b是ITP疾病发生的危险因素,进一步表明,HPA-3b等位基因可能是青岛市ITP患者的遗传易感基因。本研究中未发现HPA1-2、HPA4-6、HPA-17等位基因与ITP发病有关,与唐利娟等[14]研究结果一致,推测可能与地区特异性有关。在本研究中,虽然两组HPA-1、HPA-4、HPA-17基因型无显著差异,但在ITP患者中分别检测出2例HPA-1a/1b、2例HPA-4a/4b、1例HPA-5a/5b、1例HPA-17a/17b杂合子基因型,推测HPA-1b、HPA-4b、HPA-5b、HPA-17b可能与ITP患者发病有一定倾向性。
综上所述,HPA-3系统与ITP疾病发生有关,ITP患者HPA-3b基因频率显著高于对照组,可能是ITP发病的易感因素。本研究不足之处,本研究选取样本量较小,可能对研究结果造成一定偏倚,需要进一步扩大样本量深入研究。
利益冲突所有作者均声明不存在利益冲突

