羊草GST 基因的克隆及序列分析
邢磊,郭园艺,汪自庆*,麻鹏达*
(1.西北农林科技大学 理学院,陕西 杨陵712100;2.西北农林科技大学 生命科学学院,陕西 杨陵71200)
羊草(Leymus chinensis)是亚洲中部草原的建群种牧草,属多年旱生丛生禾草[1],在实际生产常见东北、吉生1-4 号、农牧1 号羊草等品种。羊草根系穿透能力强,具有良好的适应胁迫环境的抗逆特性。羊草根系穿透能力强,内部还有相关的植物形态适应盐碱胁迫,因此羊草具有良好的抗逆性,这也是羊草能在内蒙古、东北等高盐高碱的环境中生长的主要原因[2]。已有研究表明,在非生物胁迫条件下羊草基因能做出相应反应来适应逆境,尤其是一些酶类基因,当羊草受到胁迫时,这些酶基因可以调控羊草产生相关的活性物质进行防御反应[3]。目前,由于草场过度放牧以及不合理的利用等人为因素,各草场草地环境恶化,草种的质量迅速下降,生态环境遭到破坏,因此,高质量、抗逆性羊草研究迫在眉睫。而近年来关于羊草能够适应胁迫环境的抗逆基因报道较少,羊草对盐碱的耐受性及其适应不同逆境的分子机制的研究尚不明确[4]。因此,寻找羊草抗逆的相关基因,进一步培育抗旱耐盐碱的转基因作物,对我国草业发展具有重大意义。
谷 胱 甘 肽S 转 移 酶(Glutathione-S-transfer⁃ase,GST)是动植物及微生物体内参与生物转化代谢的重要酶类。所有真核物种都具有多种与细胞质膜相结合的GST 同工酶。目前,关于动物中GST 的研究多集中于能否有效清除体内有毒有害物质,以保护动物细胞免受氧化侵害,而植物中GST 的研究集中于能否有效解除除草剂和杀虫剂等的毒性,以及植物GST 的克隆和功能分析。根据核酸序列、蛋白质一级结构以及底物等性质的不同,GST 可以分为10 个亚类,即:Phi(F)、Tau(U)、Theta(T)、Zeta(Z)、Lambda(L)、DHAR、TCHQD、EFIG、Iota 和Hemerythrin。其中,植物所 特 有 的 是Phi、Tau、L ambda 和DHAR 类[5,6]。GST 蛋白通常由同源或异源二聚体构成,构成二聚体的每一个亚基都包含N 端和C 端两个结构域,用于连接结构域的为5~10 个氨基酸构成的可变区。其中N 端包含相对保守的GSH 特异结合位点(G 位点),相对比较保守。而C 端包含结合疏水底物的位点(H 位点),该位点可变性较大。多项研究表明,GST 基因在植物的生长发育、生命进程及抗逆中起着非常重要的作用,如:参与植物的初、次 级 代 谢 及 非 生 物 胁 迫、细 胞 信 号 转 导 等[5~9]。GST 蛋白能够跨膜运输,将植物自身次级代谢物运输到指定部位,用于抵抗外部胁迫[10]。在植物处于各种胁迫环境中时,如遭遇病原菌诱导、除草剂胁迫、盐胁迫和重金属胁迫等,GST 蛋白的两个亚基开始发挥作用,通过催化还原型谷胱甘肽的巯基与外源有毒有害物质的亲电或亲脂基团进行结合,形成水溶性的复合物,并将复合物排到细胞外,使用这种解毒方式来保护植物细胞免受环境中的生物及非生物胁迫伤害[11,12]。
基于目前对于羊草GST 基因抗逆的研究报道较少,且我国草业发展的需要,本研究以羊草GST基因的电子克隆序列作为参考,使用RT-PCR 技术和RACE 技术从羊草中克隆该基因,并采用生物信息学手段对其进行相关分析,进一步了解羊草GST 基因的生物学功能以及分析羊草抗逆分子机制,为我国转基因作物研究提供良好的基因资源[3]。
1 材料与方法
1.1 植物材料
选取大小均一,颗粒饱满的羊草种子,将其置于盛满蛭石的花盆中,于人工气候培养箱,25°C 恒温培养[13],箱内光强度为11 000~13 000 lx,光照周期为16 h·d-1,待羊草长出新苗后,每天坚持浇1次0.5 倍霍格兰营养液,待其长出4 叶停止培养,-80℃下保存,以备提取总RNA。
1.2 羊草总RNA 的提取及反转录
羊草总RNA 的提取按照RNA 提取试剂盒(天根生化科技有限公司,北京)操作进行,采用软件Nanodrop 2000 对提取的总RNA 的浓度及纯度进行检测,并采用1% 的琼脂糖凝胶电泳对总RNA 的纯度进一步检测。
总RNA 的反转录采用反转录试剂盒(普洛麦格生物技术有限公司,北京)进行,其操作步骤按试剂盒说明书进行。
1.3 RACE 和 全 长cDNA 克 隆
通过Genbank 检索,获得羊草GST 蛋白的EST 序 列(登 录 号:CD808535)。 与NCBI BLASTX 比对发现,其基因序列为羊草GST 基因的5'端。基于EST 序列,采用Primer Primer5.0 软件分别设计GST 基因的3'RACE 特异性引物。根据Clontech 公 司 的RACE 试 剂 盒(SMARTTMRACE cDNA Amplification Kit)说明书进行后续PCR 反应。使用DNAMAN 拼接EST 序列及通过RACE 得到目的基因5’端序列,由此得到羊草GST 蛋白的全长cDNA 序列。
1.4 序列拼接及基因阅读框分析
利用检索工具NCBI 中的BLAST 将羊草GST 蛋白5' RACE 的结果和原有EST 序列进行拼 接,并 采 用NCBI“ORF finder”在 线 程 序(http://www. ncbi. nlm. nih. gov/gorf/gorf. html)对所获得GST 基因序列的开放阅读框进行分析。
1.5 蛋白理化性质分析
利 用 ProtParam、Protscale、Netphos3.1 和NetOGlyc3.1 软件对羊草GST 蛋白进行理化性质、亲疏水性、磷酸化及糖基化位点预测分析,用SingalP4.1、TMHMM 和ScanProsite 软 件 对 羊 草GST 蛋白进行信号肽、跨膜结构域及保守结构域预测,用Psort Prediction 在线软件对羊草GST 蛋白进行亚细胞定位,使用COILS、PSIPRED、SOP⁃MA、Phyre2 和PyMol 软件对羊草GST 蛋白进行二级结构和三级结构预测。
1.6 系统发育树构建
利用NCBI 中的BLASTN,将羊草GST 基因与各种植物GST 基因进行序列比对,分析其序列的同源性。采用DNAMAN6.0 进行多序列比对,MEGA5.0 构建各植物GST 蛋白的系统发育进化树,设置重复1000 次,其他均为默认设置。
2 结果与分析
2.1 羊草GST 基因全长cDNA 的获得
通过5'RACE,获得长372 bp 的5'末端TA 克隆产物。将5'RACE 扩增序列与羊草GST 基因EST 序列进行拼接,得到羊草GST 基因全长序列,经测序长为833 bp。采用“ORF finder”分析得该羊草GST 蛋白具有654 bp 开放读码框,81 bp 的5'UTR和98 bp的3'UTR非编码区,得到的羊草GST基因编码具有217个氨基酸的蛋白质(图1)。

图1 羊草GST 的全长cDNA 序列以及编码的氨基酸序列Fig.1 The full-length cDNA sequence and deduced amino acid sequence of L.chinensis GST protein
2.2 羊草GST蛋白生物信息学分析
2.2.1 羊草GST 基因(LcGST)编码蛋白质的理化性质
利用ProtParam 在线分析工具分析LcGST 基因编码的蛋白质氨基酸序列的理化性质,结果显示,羊草GST 蛋白由碳、氢、氧、氮和硫5 种元素组成,其分子式为C1141H1763N297O306S8,相对分子质量为24.78 kDa,理论等电点为5.81,其值小于7,表明羊草LcGST 蛋白是一个弱酸性蛋白质(表1)。从氨基酸组成特点来看,GST 蛋白包含20 种常见氨基酸(表2),其中含量最高的为Leu(10.55%),其次为Glu(10.09%)和Val(10.09%),含量最低的为Asn(0.92%)和Thr(0.92%)。羊草GST 蛋白其他理化特性如表1 所示,其所带的电荷情况为负电荷残基数(Asp+Glu)为32,正电荷残基数(Arg+Lys)为28,脂溶性系数(AI)数值为90.74,不稳定系数(Instability index)数值为33.86。羊草GST 蛋白的总平均亲水性(Grand average of hy⁃dropathicity,GRAVY)为-0.161,表明羊草GST蛋白应该属于亲水性蛋白。根据Protscale 分析得到的亲/疏水信号图(图2)可知,GST 蛋白C 端含有疏水头部,N 端为亲水头部,中间氨基酸靠近C端部分表现为亲水性,靠近N 端部分表现为疏水性,其中以A29A30残基亲水性最强(-2.544),以A155残基疏水性最强(1.689)。整体看来,羊草GST 蛋白的亲/疏水信号图中,峰值分布在-0.5 以下的信号明显多于0.5 以上的信号,这个结果也进一步证明羊草GST 蛋白为亲水性蛋白。

表1 GST 基因编码的蛋白质理化性质分析Table 1 Physico−chemical properties of GST deduced proteins
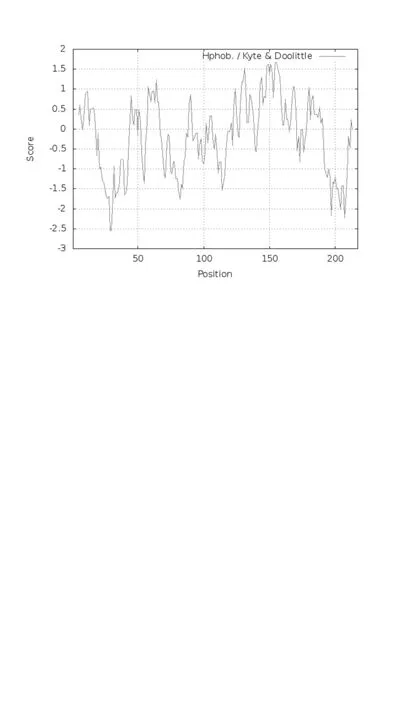
图2 羊草GST 蛋白的疏水性/亲水性预测Fig.2 Leymus chinensis GST protein Hydropathicity prediction
2.2.2 LcGST 基因编码蛋白质的修饰位点预测
利用NetPhos3.1 分析,得到LcGST 蛋白存在3 种磷酸化位点,分别为1 个丝氨酸(serine)位点、1个苏氨酸(threonine)位点和2 个酪氨酸(tyrosine)位点(系统预设的阈值之上)(图3)。根据NetO⁃Glyc3.1 进行糖基化位点分析,羊草LcGST 蛋白不存在潜在的糖基化修饰位点。
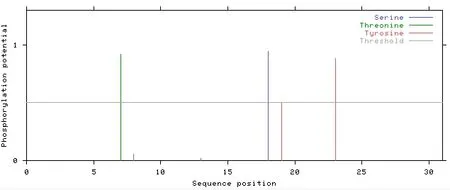
图3 羊草GST 蛋白的磷酸化修饰预测Fig.3 Phosphorylation prediction of L.chinens is GST protein
2.2.3 LcGST 基因编码蛋白质的信号肽、跨膜结构域及亚细胞定位预测
采用SignalP 4. 1 对羊草LcGST 蛋白的信号肽序列进行分析,结果(表明羊草LcGST 蛋白未发现有信号肽,并且不存在剪切位点。由此推测,羊草LcGST 蛋白为非分泌型蛋白,可能不进行蛋白质转运,直接在细胞质基质中起作用图4)。同时使用软件TMHMM 2. 0 对羊草LcGST 蛋白的跨膜结构域进行预测,结果表明,羊草LcGST 蛋白位于膜外,并不存在跨膜结构域,也并未发现膜内的氨基酸序列,非膜蛋白(图5)。采用Psort Prediction 对羊草LcGST 蛋白进行亚细胞定位预测,结果显示,羊草LcGST 蛋白通常定位于含有氧化酶体及过氧化物酶体的微体(Microbody),生命活动的主要场所细胞质(Cytoplasm),含有多种氧化酶的线粒体基质空间(Mitochondrial matrix space)以及叶绿体类囊体膜(Chloroplast thylakoid membrane)中,这也侧面表明羊草GST 蛋白极可能参与生物体脱毒(表2)。将信号肽预测结果和跨膜结构域预测结果及亚细胞定位综合来看,可以推测出羊草LcGST 蛋白在游离核糖体上合成蛋白多肽,然后由引导肽将蛋白质导向靶位点,之后大部分在微体和细胞质中发挥作用,而有少量在线粒体基质及叶绿体类囊体上发挥作用。
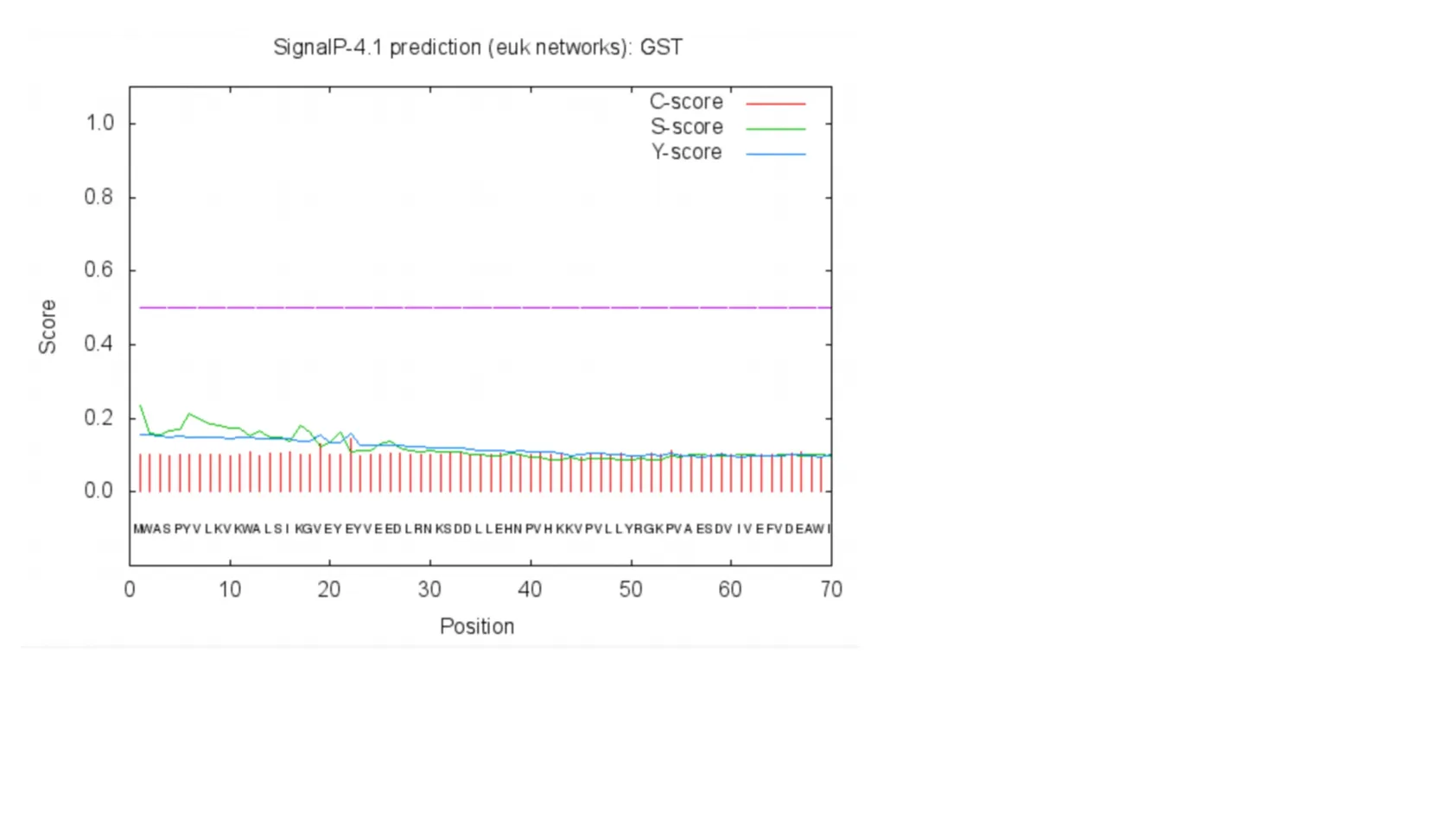
图4 羊草GST 蛋白的信号肽预测Fig.4 Prediction ofthe signal peptide for L.chinensis GST protein

图5 羊草GST 蛋白的跨膜结构域预测Fig.5 Prediction of the transmembrane domains in L.chinens is GST protein
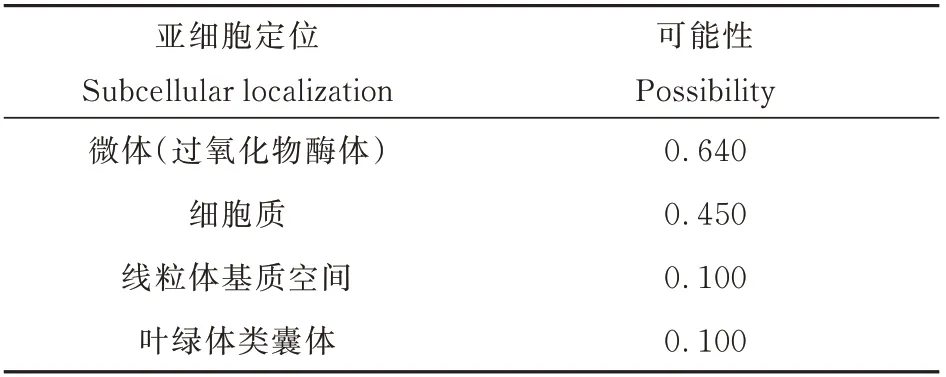
表2 基于PSPORT 预测羊草GST 蛋白的亚细胞定位Table 2 Subcellular location of GST based on PSPORT
2.2.4 LcGST 基因编码蛋白质的保守结构域预测
采用NCBI 在线分析工具CD Search 和在线软件InterPro 中检索的EBI 数据库分析LcGST 蛋白的功能位点和保守结构域,结果显示LcGST 蛋白含有2 个典型的GST 保守结构域,其中类硫氧还原蛋白超家族的GST-N-Tau 结构域存在于蛋白N 端,在此结构域中含有较为保守的谷胱甘肽特异结合的G 位点(图6,7)。而LcGST 蛋白的C端为GST-C 超级家族的GST-C-Tau 结构域,用于结合疏水底物的H 位点就存在于该结构域中,且该位点可变性较大。分析结果说明LcGST 蛋白属于Tau 类GST 蛋白。

图6 羊草GST 蛋白保守结构域预测Fig.6 Prediction of conserved domains in L.chinensis GST protein
2.2.5 LcGST 基因编码蛋白质的二级结构预测
利用Expasy 的Coils 对羊草LcGST 蛋白的卷曲螺旋结构进行分析发现羊草该蛋白没有明显的卷曲螺旋。再使用PSIPRED 和SOPMA 对羊草LcGST 蛋白的二级结构进行分析,分析结果(图8)显示,LcGST 蛋白中氨基酸残基组成以α-螺旋为主(58.99%),伴有少量的β-折叠(9.68%)。
2.2.6 LcGST 基因编码蛋白质的三级结构预测
利用Phyre2 同源建模软件模拟LcGST 蛋白的三维结构。预测得到与LcGST 蛋白相似度最高(100%)的模板为c4agsA,根据此模板对Lc⁃GST 蛋白的209 个氨基酸进行同源建模(图9),得到的模型覆盖度为96%。利用PyMOL 三级结构显示软件分析LcGST 蛋白的同源建模结果,并以二级结构标记颜色。

图7 LcGST 蛋白功能位点预测Fig.7 Prediction of functional sitesin LcGST protein

图8 LcGST 蛋白二级结构域预测Fig.8 Prediction of secondary structure in LcGST protein
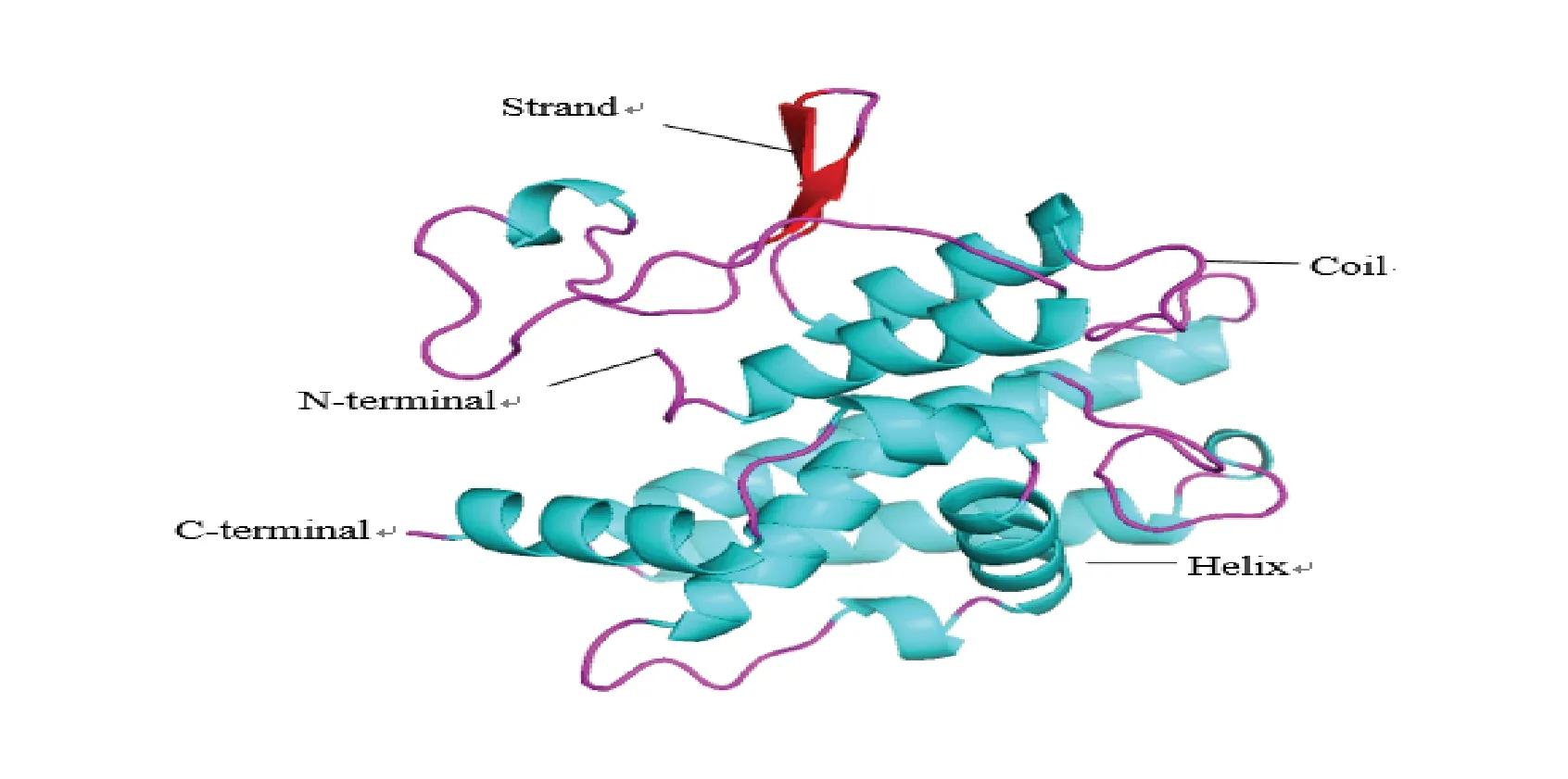
图9 羊草GST 蛋白的同源模建空间结构Fig.9 The model of steric structure of L.chinensis GST protein
2.2.7 LcGST 基因编码蛋白质的进化分析
以羊草GST 蛋白序列为探针,通过NCBI 中的BlastP 进行比对寻找,下载与探针蛋白相似性较高的蛋白序列,利用软件DNAMAN 将羊草Lc⁃GST 与其它植物GST 蛋白序列进行多序列比对(图10),得到的GST 蛋白序列比对的一致性只有60.25%,保守结构域较短,且其上氨基酸相似度较低。有其他研究表明[10],不同植物不同类型的GST 序列之间的差异还是比较大的。虽然不同GST 蛋白N 端和C 端有两个结构域的保守性相对较高,但不同类型的GST 氨基酸的序列的同源性很低,本研究的序列比对结果符合这一结论。利用软件MEGA6.0(邻近法)构建LcGST 蛋白与其它几种植物GST 蛋白的NJ 进化树(图11),结果表明,在进化关系中,羊草GST 蛋白与二穗短柄草最近,次之为日本稻和小米,而与菠萝和番茄进化关系最远。
3 讨论与结论
植物GSTs 拥有复杂的家族成员,并且功能各异,参与植物的多种生命历程和生长发育调控[5-6]。本研究的实验材料为优质的具有强抗寒抗旱耐盐碱的禾本科牧草—羊草,通过已知的EST 序列,采用RT-PCR 和RACE 技术等分子生物学手段对基因的同源区和全序列进行克隆,成功克隆出Lc⁃GST。并采用多种生物信息学软件对羊草GST 基因序列及蛋白序列进行了分析。结果表明,羊草的GST 蛋白为稳定的217 个氨基酸编码的弱酸性亲水蛋白,含有4 个磷酸化位点,不含糖基化位点。不含有信号肽结构和跨膜结构域,但拥有两个典型的GST-C-Tau 和GST-N-Tau 保守结构域,表明其属于Tau 类GST 蛋白。羊草GST 蛋白亚细胞定位于微体,细胞质,线粒体基质空间和叶绿体类囊体,其二级结构和三级结构以α 螺旋为主,伴以少量β 折叠。进化分析的结果则显示羊草GST蛋白与二穗短柄草的亲缘关系最近。
目前已发表的研究表明,胞质中存在大量的可溶性GST[14,15]。模式生物拟南芥GST 的基因组分析表明,目前发现仅两个phi 类和Lambda 类的GST 蛋白拥有一段定位序列,该序列能够使GST蛋白定位于质体和线粒体。除此之外的几乎所有GST 蛋白都不包含这些能够帮助自身定位的序列,基因组分析预测这些不包含定位序列的蛋白应该存在于胞质中[14],并且少量的GST 蛋白也在细胞核或细胞外发生表达。本研究中的羊草Lc⁃GST 蛋白属于Tau 类,与其他植物中的大多数GST 蛋白的亚细胞定位情况保持一致,虽有少部分定位于线粒体基质空间,但也不具有该段定位序列。本研究磷酸化预测表明羊草GST 蛋白具有4 个磷酸化位点,分别为1 个丝氨酸位点、1 个苏氨酸位点和2 个酪氨酸位点,说明羊草GST 有重要的生物学作用,其更精确的结构需要更先进的技术手段进行确认,其抗逆分子机制及其他生物学功能还需要进一步生物验证和分析。
采用生物信息学手段对羊草GST 基因进行分析的结果表明,该LcGST 蛋白具有保守GST 结构域。而在植物体内消耗的O2部分被转化成溶解氧(ROS),ROS 的浓度高低决定了其对植物体是否有益。高浓度的ROS 累积会对植物细胞造成氧化损伤甚至死亡。因此,ROS 过度积累后的清除对细胞正常生长具有重要意义。有研究表明[16],GST 作为一种重要的解毒酶,在植物面对逆境时,能够通过ROS 的清除对细胞的损伤进行修复。同时拟南芥GST 中有的参与类黄酮代谢[17],有的参与细胞信号转导[17],还有的对植物逆境,病原物侵染和植物激素有响应[19],有研究表明[20],将核桃Tau 类GST 基因转入酿酒酵母中,对酿酒酵母施以盐及低温胁迫,发现转基因酵母与对照相比展现出更强的生命力和存活率;毛白杨[21],水稻[22],大豆[23]等的GST 蛋白都有一定的抗逆活性。羊草GST 基因在植物体内的解毒作用是否通过消除ROS 来实现,还需要进一步生物验证。
本研究结果为羊草GST 基因的生物学功能的了解以及羊草抗逆分子机制的进一步研究奠定了良好的基础,同时也为GST 蛋白功能的进一步研究提供了一定的数据支撑。羊草GST 基因是否具有提高羊草抗逆胁迫的能力,我们还需做之后的表达分析及转基因试验来进一步佐证。

