miRNA-9 对胃癌细胞增殖和迁移的作用研究
周建萍,余猛进,毛振彪
1解放军海军军医大学(第二军医大学)第一附属医院急诊科,上海200433
2南通大学附属医院消化科,江苏 南通2260010
胃癌是人类最常见的癌症之一,2012 年胃癌新发病例近100 万例,居全球常见恶性肿瘤第五位。70%以上的胃癌病例发生在发展中国家,其中一半发生在东亚(主要是中国)。胃癌是全球男性和女性因癌症死亡的第三大死因,估测中国是世界上胃癌发病率和病死率最高的国家[1]。胃癌发病率随年龄增长而增长显著,发病高峰年龄为60~74 岁;然而,目前其在30 岁以下人群中越来越普遍。中国胃癌的发病率和病死率明显高于其他国家,预后普遍较差。2015 年,中国年龄标化后的胃癌发病率和病死率在所有肿瘤中居第二位。人口增长和老龄化导致大量新发病例,幽门螺杆菌感染可能会导致胃癌发生[2]。近几十年来,已报道大量的微小RNA(microRNA,miRNA)与胃癌有关。miRNA 主要通过抑制靶基因信使RNA(messenger RNA,mRNA)翻译或mRNA 降解参与肿瘤的发生发展[3]。最近的研究表明,miRNA可能作为潜在的致癌基因或抑癌基因在人类癌症中发挥重要作用[4]。miRNA 是由18~24 个核苷酸组成的单链非编码小分子RNA,结合在与之互补的mRNA 3'非编码区(untranslated region,UTR)或5'UTR,与蛋白质因子形成RNA 沉默复合物,导致mRNA 降解或翻译抑制,从而在转录后水平调节基因表达[5]。miRNA 调节细胞分化、增殖和凋亡,其异常表达促进细胞增殖,阻滞细胞周期,抑制细胞凋亡,诱导肿瘤血管生成[6]。真核生物miRNA 调节mRNA,大量证据表明人类癌症中miRNA 突变或欠表达,提示miRNA可能为肿瘤致癌基因或抑癌基因[7]。本研究使用miRNA-9 转染人胃癌细胞株,并分别采用CCK-8和Transwell 法检测胃癌细胞的增殖和迁移能力。
1 材料与方法
1.1 材料
人胃癌细胞株MKN-45 购自中国科学院上海细胞库;根据Geen Bank 提供的miRNA-9 序列,miRNA-9 质粒由上海吉玛公司合成。CCK-8 试剂盒购自beyotime 公司;胎牛血清购自杭州四季青公司;DMEM、RPM1640 培养基均购自Hyclone 公司;无内毒素的少量质粒抽提试剂盒购自Omega 公司;Lipofectamine 2000 试剂盒购自invitrogen 公司。
1.2 细胞培养及转染
常规培养传代,取传代2、3 次且生长良好的对数生长期细胞,以5×106/ml 接种到6 孔培养板无抗完全培养基培养24 h。预实验确定250 ml 无血清培养基稀释4.0 mg DNA,8 ml Lipofectamine 2000稀释250 ml无血清培养基,二者混合后总体积500 ml。将脂质体和DNA 混合物逐滴加入到每孔中,充分混匀。37 ℃5%CO2培养箱孵育6 h,更换培养基,MKN-45 细胞株加入混合物48 h,荧光显微镜下观察转染效率。
1.3 质粒抽提
重组质粒转化,摇菌,质粒小量抽提,制备质粒的过程即裂解细菌、分离、收集、纯化质粒的过程。先用强热或酸、碱等化学物质破坏细胞壁,使细菌染色体DNA 变性并缠绕附着在细胞碎片上或被切断成不同大小的线性片断。外界条件恢复正常时,线状染色体DNA 片段难以复性,而质粒DNA 双链又恢复原状,重新形成天然的超螺旋分子,溶解在液相中,再通过树脂吸附等方法将其分离。使用无内毒素的少量质粒抽提试剂盒获得,具体操作步骤按照说明书进行。
1.4 CCK-8 检测细胞增殖
实验分为4 组:miRNA-9 类似物组、miRNA-9抑制物组、阴性对照组、空白对照组(MKN-45 细胞加新鲜的DMEM培养基)。取MKN-45细胞株对数生长期细胞,调整细胞密度为5×105/ml 接种至6 孔板,次日长满,分别将miRNA-9类似物、miRNA-9抑制物、阴性对照质粒按照Lipofectamine 2000 说明书转染MKN-45 细胞株。12 h 后胰酶消化,调整细胞密度为2×103/ml 细胞悬液接种至96 孔板,无抗完全培养液定容至每孔100 ml,于37 ℃5%CO2培养箱培养。调零组为无抗完全培养液,每组设6 个复孔,分别在24、48、72 h 测定吸光度,测定前避光加CCK-8 每孔10 ml,37 ℃5%CO2培养2 h,终止培养,酶联免疫检测仪测定450 nm 波长下的吸光度,去掉极端值,实验重复3 次,取均值。
1.5 Transwell 法检测细胞迁移
制备细胞悬液,调整细胞密度1×105/ml。取MKN-45 细胞悬液200 ml 接种于Transwell 小室。24 孔板下室加入600 ml 含20%磷酸盐缓冲液(phosphate buffered saline,PBS)的培养基,常规培养24 h。结果统计使用直接计数法,取出Transwell小室,弃去孔中培养液,用PBS 清洗2 遍,甲醇固定30 min,将小室适当风干,0.1%结晶紫染色固定20 min,棉签轻轻擦掉小室上层未迁移细胞,PBS 清洗3遍。100 倍倒置显微镜下随机选取5 个视野观察细胞。实验重复3 次,取均值。
1.6 统计学分析
采用SPSS 19.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用重复测量方差分析,以P﹤0.05为差异有统计学意义。
2 结果
2.1 miRNA-9 质粒转染胃癌细胞株MKN-45 的效率测定
使 用Lipofectamine 2000 转 染,转 染48 h 后MKN-45 细胞株转染效率达到90%(图1),细胞损伤最低,转染时间过久,易出现细胞凋亡。
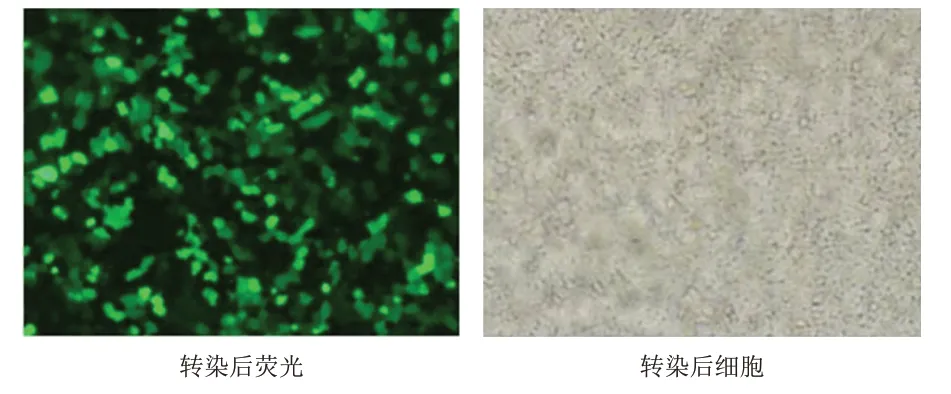
图1 阴性对照质粒转染胃癌MKN-45细胞株(×100)
2.2 质粒检测
质粒DNA 浓度和纯度测定吸光度值A260∶A280=1.8~1.9,如高于此范围,说明有残余蛋白质存在,低于此范围提示混有RNA。2%琼脂糖凝胶电泳,质粒DNA 以3 种形式存在,即环状DNA、线状DNA、超螺旋DNA。miRNA-9 质粒分子量为5702 bp,质粒电泳说明提取质粒符合实验要求。
2.3 miRNA-9 对MKN-45 细胞增殖的影响
转染48、72 h 时计算细胞增殖率,miRNA-9 类似物组细胞增殖率分别为(60.233±4.366)%、(114.063±1.730)%,miRNA-9 抑制物组细胞增殖率分别为(22.216±5.583)%、(59.637±8.542)%。结果显示miRNA-9 类似物组细胞增殖率高于阴性对照组和空白对照组(P﹤0.05)。(表1)
表1 不同时间点各组MKN-45 细胞的增殖率(%±s)
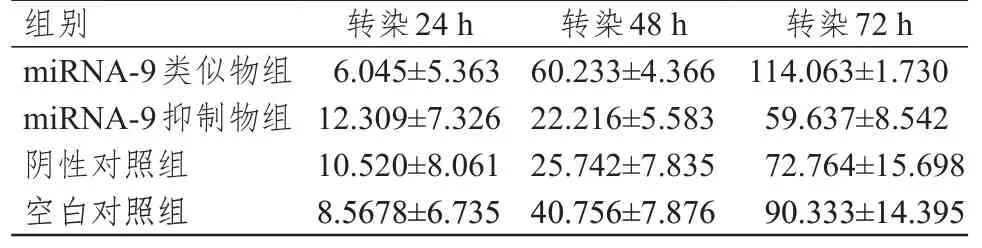
表1 不同时间点各组MKN-45 细胞的增殖率(%±s)
组别miRNA-9类似物组miRNA-9抑制物组阴性对照组空白对照组转染24 h 6.045±5.363 12.309±7.326 10.520±8.061 8.5678±6.735转染48 h 60.233±4.366 22.216±5.583 25.742±7.835 40.756±7.876转染72 h 114.063±1.730 59.637±8.542 72.764±15.698 90.333±14.395
2.4 miRNA-9 对MKN-45 细胞迁移的影响
分别计数转染48 h 后各组穿过滤膜的细胞数,结果显示miRNA-9 类似物组穿膜细胞数为(1052±71)个,miRNA-9 抑制物组为(276±32)个,阴性对照组为(595±42)个,空白对照组为(613±35)个,miRNA-9 类似物组穿膜细胞数较空白对照组、阴性对照组增多。(图2)

图2 Transwell迁移实验观察各组MKN-45细胞的迁移能力(结晶紫染色,×100)
3 讨论
癌症是由致癌基因、抑癌基因和miRNA 改变而引起的[8]。肿瘤相关基因的异常调节、基因增加或缺失、异常的蛋白质翻译导致致癌基因过表达和抑癌基因下调[9]。miRNA 的异常表达促进细胞增殖,抑制细胞凋亡,诱导肿瘤血管生成;miRNA存在于不同肿瘤亚型,如结肠癌、胃癌等。胃癌组织通过miRNA 簇抑制细胞周期[10]。本研究以miRNA-9 为研究对象,研究焦点集中在预测靶基因和相关的miRNA。
miRNA-9 有3 种亚型,即miRNA-9-1、miRNA-9-2、miRNA-9-3;根据Gene Bank 可知它们都有CpG 岛,其成熟体序列一样,功能相似。在胃癌组织中发现其DNA 高度甲基化导致表达降低[11]。Tsai 等[12]研究表明,miRNA-9 是胃癌的抑癌基因,5-Aza-dC 去甲基化处理增加了miRNA-9 的表达,可抑制胃癌细胞增殖、迁移和浸润。Wan 等[13]发现miRNA-9 在人胃腺癌组织中表达降低,miRNA-9过表达明显抑制人胃癌细胞株和裸鼠肿瘤生长,miRNA-9 抑制核因子κB(nuclear factor of kappa B,NF-κB)mRNA 和蛋白表达,提示其作为肿瘤抑癌基因发挥作用。
本研究发现,转染miRNA-9 后,miRNA-9 对MKN-45 胃癌细胞的生物学行为有显著影响。CCK-8 和Transwell 检测显示,过表达miRNA-9 可促进胃癌细胞的增殖和迁移能力,而下调miRNA-9则降低胃癌细胞的增殖和迁移能力,表明miRNA-9在MKN-45 细胞中起致癌基因的作用。miRNA-9表达在其他肿瘤中上调,表明其作用可能与致癌基因类似。在结肠癌细胞中,miRNA-9 抑制E-钙黏蛋白表达,抑制miRNA-9 可恢复E-钙黏蛋白活性;在E-钙黏蛋白表达降低的结肠癌标本中,miRNA-9 表达显著增加[14]。此外,miRNA-9 上调乳腺癌细胞中的E-钙黏蛋白表达,增加细胞迁移和侵袭性。miRNA-9 介导的E-钙黏蛋白下调导致血管内皮生长因子(vascular endothlial growth factor,VEGF)表达上调和肿瘤血管生成。此外,在miRNA-9 过表达的乳腺癌小鼠模型中发现肺转移,在高度恶性细胞中抑制miRNA-9 可以抑制转移[15]。本研究结果与以上结论一致。Gao 等[16]认为miRNA-9 在胃癌组织和细胞系中的表达均低于癌旁组织和未分化胃上皮细胞,体内和体外实验表明过表达miRNA-9 可抑制胃癌细胞和组织的增殖。目前发现很多未分化胃癌病例,存在胃上皮细胞内miRNA-9 基因突变,因此推测miRNA-9 起双重作用,也许取决于目标靶基因及肿瘤类型。将来将建立动物模型,进一步研究miRNA-9 和靶基因的相关性。

