胃癌患者术中腹腔冲洗液对脱落胃癌细胞增殖能力的影响△
雷璐敏,许欣琳
解放军总医院第四医学中心手术室,北京1000480
国际癌症研究机构(International Agency for Research on Cancer,IARC)数据显示,胃癌发病率居恶性肿瘤第5 位,病死率居第3 位。胃癌是中国常见的恶性肿瘤,其发病和死亡例数均约占全世界的50%[1-2]。随着人口老龄化的加剧,预测中国胃癌的总发病例数还将逐年增加,疾病负担呈上升趋势[2]。手术是治疗胃癌最直接、最有效的方法之一,然而,手术操作、用物使用等环节往往会提高肿瘤细胞医源性播散的概率,而医源性播散是肿瘤术后复发的一个重要原因[3-5],术后复发给患者带来巨大疾病创伤和负担。因此,避免和减少手术中各环节造成的医源性播散意义重大。临床实践中,在胃癌手术结束关闭腹腔前,采用腹腔冲洗液杀灭游离的胃癌细胞尤为重要,成为预防复发的最后一道防线。目前临床对腹腔冲洗液灭瘤效果的研究多是通过显微镜观察胃癌细胞形态学变化而间接判断胃癌细胞是否具有种植、播散的能力。但是具有完整细胞形态的胃癌细胞是否一定具备种植、播散的能力值得进一步的探讨研究。因此本研究通过精确的细胞噻唑蓝(methyl thiazolyl tetrazolium,MTT)检测法探讨不同腹腔冲洗液在不同温度、不同作用时间点对胃癌细胞增殖活力的影响效果,现报道如下。
1 材料与方法
1.1 材料
选取胃癌细胞株MGC-803。试剂:蒸馏水、0.5%碘伏、特级胎牛血清、胰蛋白酶、苯酚红、磷酸盐缓冲液(phosphate buffered saline)、RPMI1640、MTT。仪器:倒置相差显微镜、正置荧光显微镜、CO2培养箱、酶标仪、离心机、气浴恒温箱、培养瓶、96 孔板、滤器。
1.2 MTT 检测原理
哺乳动物活细胞线粒体中的琥珀酸脱氢酶可将黄绿色的MTT 降解生成蓝紫色的甲瓒结晶并沉积在细胞中,而死细胞无此功能[6]。二甲基亚矾(DMSO)可将细胞中的甲瓒溶解成紫色,用酶标仪在490 nm 波长处测定甲瓒的含量可定量测定细胞活力。
1.3 实验方法
1.3.1 分组 实验分为对照组、蒸馏水组和碘伏组,每组8 个孔。对照组给予RPMI1640 培养液,蒸馏水组给予蒸馏水,碘伏组给予0.5%碘伏。
1.3.2 细胞培养 细胞复苏:取冻存管,放入37 ℃水浴中使冻存细胞融解。将融解的细胞悬液转移到离心管中,加入新鲜的培养基离心两次,最终移至细胞培养瓶中并加入含10%胎牛血清的RPMI1640 培养液,置于37 ℃的CO2培养箱中培养,次日换液,传代1次后即可进行实验。细胞传代:用含10%胎牛血清的RPMI1640 培养液培养细胞,培养条件为37 ℃、5%CO2,饱和湿度,每1~2 天换液1次。收集对数生长期细胞,调整细胞悬液浓度并铺板,使待测细胞密度为1000/孔。37 ℃、5%CO2孵育12 h直至细胞单层铺满孔底(96孔平底板)。
1.3.3 干预方法 分组加药,观察对照组、蒸馏水组、碘伏组在常温(37 ℃)和高温(43 ℃)下1、5、10、15、20、25、30 min 不同时间点细胞活力的变化。分组加药后放置在恒温箱中,确保每组在各个时间点温度保持恒定状态。在倒置显微镜下观察细胞形态并拍摄记录,随后进行MTT 测定。
1.3.4 MTT 法测定细胞活力 每孔加入20 μl MTT溶液(5 mg/ml,即0.5%MTT),继续孵育4 h。孵育完毕后,终止培养,吸去孔内培养液。每孔加入150 μl DMSO,低速振荡10 min,使结晶物充分溶解。用酶标仪在490 nm 处测量各孔的光密度(optical density,OD)值。细胞活力=(加药孔OD 值-加药空白孔OD 值)/(对照孔OD 值-对照空白孔OD 值)。
1.4 统计学方法
采用SPSS 17.0 统计软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析,多组间两两比较采用LSD-t 检验,以P﹤0.05 为差异有统计学意义。
2 结果
2.1 常温下各时间点对照组细胞活力的比较
常温下各时间点对照组细胞OD 值比较,差异无统计学意义(P﹥0.05),均一性较好。(表1)
表1 常温下各时间点对照组细胞的OD 值(±s)
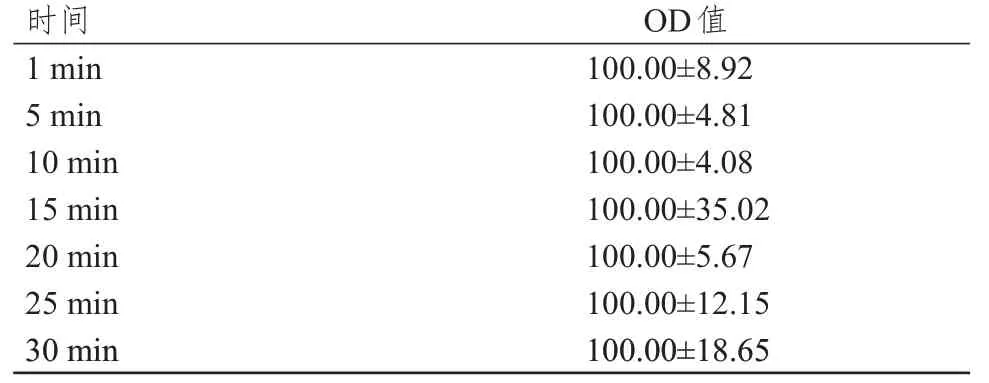
表1 常温下各时间点对照组细胞的OD 值(±s)
时间1 min 5 min 10 min 15 min 20 min 25 min OD值100.00±8.92 100.00±4.81 100.00±4.08 100.00±35.02 100.00±5.67 100.00±12.15 30 min 100.00±18.65
2.2 不同温度不同时间点各组细胞活力的比较
除37 ℃1 min 外,常温和高温各时间点蒸馏水组细胞OD 值均明显低于对照组,差异均有统计学意义(P﹤0.01);常温和高温各时间点碘伏组细胞OD 值均明显低于对照组,差异均有统计学意义(P﹤0.01);除37 ℃30 min 外,常温和高温各时间点碘伏组细胞OD 值均明显低于蒸馏水组,差异均有统计学意义(P﹤0.01)。43 ℃1 min 及25 min 时对照组细胞OD 值均明显高于37 ℃,差异均有统计学意义(P﹤0.01);蒸馏水组43 ℃1、5、10、20 min 时细胞OD 值均明显低于37 ℃,15、25、30 min 时细胞OD 值均明显高于37 ℃,差异均有统计学意义(P﹤0.01);碘伏组43 ℃1、10、15、25 min 时细胞OD 值均明显低于37 ℃,5、20、30 min 时细胞OD 值均明显高于37 ℃,差异均有统计学意义(P﹤0.01)。(表2)
3 讨论
3.1 蒸馏水不同作用时间对胃癌细胞增殖活力的影响效果比较
研究报道,蒸馏水灌洗所形成的低渗作用可以使肿瘤细胞失去活性[7-8]。在本实验中,蒸馏水对胃癌细胞增殖活力有明显的抑制作用。在37 ℃作用下,随时间的延长,胃癌细胞的生长趋势明显减弱,说明蒸馏水的低渗作用在较短的时间1 min 内就能达到破坏胃癌细胞形态的作用,但要达到100%细胞生长抑制的目标,还需要较长的作用时间。因此,蒸馏水对肿瘤细胞的生长抑制作用是有一定时效性的。在43 ℃作用下,各个时间点的细胞生长抑制率均优于常温37 ℃,这与陈峻青等[9]的腹腔温热低渗液灭活肿瘤细胞的报道结果相同,即使浸泡时间延长到30 min,也不能达到100%肿瘤细胞灭活率。本实验结果和Huguet 和Keeling[10]研究结果近似相近,其研究蒸馏水对结直肠癌手术过程中腹腔脱落肿瘤细胞的杀伤作用,发现蒸馏水作用于肿瘤细胞14 min 可以引起细胞裂解,30 min 才能达到完全灭活的效果。有研究者观察不同作用时间蒸馏水对肿瘤细胞的灭活率,结果显示15 s 时肿瘤细胞灭活率﹥10%,随着时间的延长,肿瘤细胞灭活率逐渐升高,1 min 肿瘤灭活率﹥45%,5 min 肿瘤灭活率﹥95%,10 min 后肿瘤灭活率趋于稳定[11]。通过上述3 个类似研究不难发现不同学者认为温热蒸馏水确实对肿瘤细胞有杀伤效力,并且优于常温蒸馏水,但达到100%肿瘤灭活率的浸泡时间从10 min 到30 min 不等,存在一定的争议,分析原因可能与实验样本的选取有关,不同肿瘤细胞由于其生物特性的不同,对蒸馏水的反应时间不同,另外与实验方法、观察指标也有关系。本实验发现43 ℃蒸馏水作用于胃癌细胞,确实能够达到抑制胃癌细胞生长的目的,但抑制效果并没有达到100%,但能够发现蒸馏水灭活肿瘤细胞需要一定的时间,并且随时间的延长胃癌细胞生长活力明显降低。
表2 不同温度不同时间各组细胞OD 值的比较(±s)

表2 不同温度不同时间各组细胞OD 值的比较(±s)
注:a与同时间本组43 ℃比较,P<0.01;b与同时间同温度对照组比较,P<0.01;c与同时间同温度蒸馏水组比较,P<0.01
蒸馏水组37 ℃99.31±19.73a 71.64±10.01a b 54.41±5.99a b 50.75±15.94a b 62.71±9.68a b 22.30±4.29a b 4.67±1.04a b碘伏组37 ℃4.95±1.22a b c 2.52±0.22a b c 2.84±0.71a b c 5.49±0.86a b c 3.13±0.77a b c 4.23±0.85a b c 1.89±0.30a b对照组37 ℃100.00±8.92a 100.00±4.81 100.00±4.08 100.00±35.02 100.00±5.67 100.00±12.15a 100.00±18.65时间1 min 5 min 10 min 15 min 20 min 25 min 30 min 43 ℃17.32±3.13 48.75±9.05b 34.83±6.77b 68.34±15.94b 55.39±9.59b 47.79±11.40b 50.87±7.39b 43 ℃3.81±0.85b c 3.30±0.76b c 2.05±0.69b c 3.13±0.57b c 3.30±0.58b c 2.98±0.69b c 3.34±0.51b c 43 ℃161.55±16.58 91.07±17.93 86.67±9.26 112.73±10.25 91.27±6.77 120.62±19.25 111.46±8.10
3.2 碘伏不同作用时间对胃癌细胞增殖活力的影响效果比较
本研究结果表明37 ℃和43 ℃时碘伏对胃癌细胞增殖活力抑制作用均较明显。随着时间的延长,细胞活力降低,当作用时间达到10 min,胃癌细胞的增殖活力明显降低。这与赵菊梅等[12]的实验结果一致,碘伏在人体安全使用浓度范围内对胃癌细胞有较明显的抑制作用。但并不像Favoulet等[13]实验中提到的能使肿瘤细胞全部死亡,分析原因为所选的肿瘤细胞种属不同,碘伏的作用效果会有所差异。但是本研究中高温碘伏组在作用时间超过10 min 后,细胞活力有所提高,分析其原因:一是碘伏主要是通过破坏细胞蛋白质产生不可逆的凝固作用达到杀灭胃癌细胞的目的,蛋白质凝固需要一定的时间,一旦完成蛋白质凝固作用,即使延长作用时间细胞活力变化不大;二是高温可能对碘伏有一定的蒸发作用,随着时间的延长,导致碘伏对胃癌细胞增殖活力抑制作用较前降低。
3.3 蒸馏水与碘伏对胃癌细胞活力的影响效果比较
在本研究中,两种腹腔冲洗液对胃癌细胞生长均有不同程度的抑制作用,在实验设计的7 个不同作用时间点,碘伏对胃癌细胞生长的抑制效果均远远高于蒸馏水,提示碘伏通过破坏胃癌细胞蛋白质,使其发生不可逆凝固所需时间远远短于蒸馏水低渗作用,说明碘伏的胃癌细胞生长抑制效果优于蒸馏水,能有效预防胃癌细胞的种植及播散。蒸馏水与碘伏都能达到抑制胃癌细胞生长的目的,但值得注意的是,本实验结果显示两种腹腔冲洗液在30 min 的作用时间内都不能达到100%抑制细胞生长的目的。
术中腹腔冲洗是减少胃癌腹腔游离肿瘤细胞种植转移的重要措施。因此,选择科学的腹腔冲洗液至关重要[14]。综上所述,蒸馏水和碘伏作为腹腔冲洗液可以抑制术中脱落的胃癌细胞的生长活力,减小其增殖的可能,从而避免胃癌细胞种植播散导致的术后肿瘤复发。蒸馏水抑制细胞生长所需时间较长不适用于临床手术过程中术野冲洗,会带来一系列的手术并发症,如麻醉时间延长、切口暴露时间延长、患者手术不耐受等一系列问题。应用43 ℃、0.5%碘伏在10 min 的作用时间下,胃癌细胞生长活力控制在10%以下,虽没有达到零生长,但较为理想。临床应用时,应注意使用碘伏腹腔冲洗时的温度、浓度和作用时间。本研究为科学选择腹腔冲洗液,减少胃癌腹腔游离肿瘤细胞种植转移提供了科学依据。

