Ag+-SPE/GC测定食物中trans C16:1,trans C18:1,trans C18:2和共轭亚油酸的含量
张 妞 范亚苇 于化泓 邓泽元 李 静
(南昌大学食品科学与技术国家重点实验室 南昌330047)
反式脂肪酸对人类健康的影响受到国内外的关注。临床研究和流行病学表明:大量摄入反式脂肪酸(TFAs)会增加低密度脂蛋白胆固醇(LDL-C)的水平,降低高密度脂蛋白胆固醇(HDL-C)的水平,增加脂蛋白(a)和血浆甘油三酯的水平,从而增加冠状动脉心脏疾病(CHD)的风险[1-2]。TFAs 每日摄入量为5 g 时,缺血性心脏病的风险将增加25%[3]。TFAs 摄入促进炎症,增加体重指数,提高C反应蛋白,引起内皮功能障碍,同时与II 型糖尿病、心脏病、肥胖、癌症、高血压的发生有密切联系[5-6]。伊朗食品和食品标准委员会建议,食用油中TFAs 的总量不得超过10%;丹麦等国家要求食用油脂TFAs 低于总脂肪含量2%[7];2015年6月16日,美国食品和药品管理局宣布,将在3年内完全禁止在食品中使用人造脂肪,以降低心脏疾病发病率。近30年来,我国居民的膳食结构逐渐“西化”,含TFAs 的“洋快餐”,人造奶油、蛋糕、炸薯条和炸薯片年销量以7%~9%的速度增长。由于早期对TFAs 缺乏监管,与其相关的疾病发病率逐年递增。
大量研究研究表明,不同来源和不同异构体的TFAs 对人体健康的影响不同。在一项队列研究[8]中发现9t C16:1与皮肤皱褶厚度和皮下脂肪呈负相关;Mozaffarian等[9-11]报道9t C16:1可降低血脂,升高高密度脂蛋白胆固醇,降低甘油三酯水平,降低糖尿病、心血管疾病的发病率。本课题组刘小如等[12]报道9t C16:1水平在健康人群血浆红细胞膜中高于冠心病患者。烘烤煎炸的氢化油中9t C18:1可能会增加心血管疾病的发病率,而反刍动物中11t C18:1则通过硬脂酰辅酶A 去饱和酶1 转化为CLA,可以降低癌症和心血管疾病的发生率。有研究[13]报道牛肉中的10t C18:1可以诱导脂质基因的表达并且可以降低人肝癌细胞(HepG2)的细胞活力。Harvey等[14-15]报道trans C18:2及其异构体与心源性猝死有很强的相关性,可诱导促炎症反应和内皮细胞功能障碍。几项动物实验研究报道CLA 对动脉粥样硬化和脑血管疾病有改善作用[16-17],其中,9c11t CLA 的调节作用,部分解释了11t C18:1和9t C18:1对内皮细胞损伤的不同机制[18]。调查食物中trans C16:1(反式十六碳烯酸),trans C18:1(反式十八碳烯酸),trans C18:2(反式十八碳二烯酸)和CLA 的膳食来源及其异构体的组成和含量,为研究不同来源的TFAs 对人体健康的影响提供科学依据。
本研究利用银离子固相萃取结合气相色谱仪分离并定量国内TFAs 主要来源的反刍动物油脂、食用油和煎炸油中trans C16:1,trans C18:1,trans C18:2和CLA 异构体的组成和含量,探讨其在人类膳食中的暴露剂量,为进一步研究人类膳食脂质中trans C16:1,trans C18:1,trans C18:2和CLA 含量与健康的关系提供相关科学理论依据。
1 材料与方法
1.1 材料与试剂
葵花油、花生油、玉米油、茶籽油、芝麻油、牛肉、羊肉、牛奶、牛奶粉、牛奶酪、羊奶、羊奶粉、羊奶奶酪,购于南昌市天虹超市。
脂肪酸标品(GLC463 标样),美国Nu-Chek-Prep 公司;正己烷、乙酸甲酯、甲醇钠-甲醇(色谱级),美国天地试剂公司;氯仿、甲醇、草酸,乙腈、甲醇钠、异丙醇等均为国产分析纯级。
1.2 仪器与设备
FA2204B 电子天平,上海精科天美科学仪器有限公司;TDL-5-A 低速大容量离心机,上海安亭科学仪器厂;DF101B 数显集热式搅拌器,金坛市大地自动化仪器厂;6890N 型气相色谱仪(配有FID 检测器和自动进样器),美国Agilent 公司;Ag+-SPE(750 mg/6 mL),德国Sigma 公司
1.3 方法
1.3.1 样品的预处理 分别取葵花油、花生油、玉米油、茶籽油、菜籽油、芝麻油50 mL,倒入陶瓷坩埚中,放在电炉上加热,用水银温度计测量其温度。当温度分别到270 ℃时,开始计时,加热2 h 后,分别倒出油样5 mL,冷却至室温,在-20℃下保存。牛奶和羊奶直接4 ℃保存,牛肉和羊肉则洗净,搅碎后4 ℃保存。牛奶粉、羊奶粉、牛奶酪和羊奶酪用60 ℃水按1∶7(样品:水)的比例溶解备用。
1.3.2 样品脂质的提取 脂质的提取参考Folch等[19]方法,通过氯仿、甲醇、水3种溶剂提取油脂。分别取1 g 牛肉、羊肉或1 mL 牛奶,羊奶和油放入50 mL 大试管中,加入2 mL 水,5 mL 甲醇和2.5 mL 氯仿,振荡2 min,再加入2.5 mL 水和2.5 mL 氯仿,涡流混匀,离心,取下层有机相,用氮气吹干,得到粗油脂。
1.3.3 脂肪酸的甲酯化脂肪酸的甲酯化采用碱法甲酯化方法,取2 mg 提取的脂肪溶于1.5 mL 正己烷,加入40 μL 乙酸甲酯溶液和100 μL 甲醇钠-甲醇溶液,涡流混匀1 min,37 ℃反应20 min后,置于冰箱-20 ℃冷冻10 min,取出后立即加入60 μL 草酸-乙酸乙酯溶液,离心(4 200 r/min,5 min),吸取上层液过无水硫酸钠柱,氮气吹干。
1.3.4 Ag+-SPE 对样品预分离[20]将上述得到的脂肪酸甲酯,用银离子固相萃取柱(750 mg/6 mL)分离出反式单不饱和脂肪酸甲酯和CLA。使用前,先分别依次加入4 mL 丙酮和4 mL 正己烷淋洗,活化固相萃取柱;将1~2 mg脂肪酸甲酯溶于1 mL 正己烷,上样,分别用6 mL 正己烷-丙酮(99∶1,体积比)洗脱出饱和脂肪酸甲酯;6 mL 正己烷-丙酮(96∶4,体积比)洗脱出反式单不饱和脂肪酸甲酯和t/t 共轭亚油酸甲酯;6 mL 正己烷-丙酮(96∶10,体积比)洗脱出顺式单不饱和脂肪酸甲酯和c/c 共轭亚油酸甲酯;6 mL 正己烷-丙酮(0∶100,体积比)洗脱出二烯脂肪酸甲酯,分别收集洗脱液,氮气吹干,加入适当体积的正己烷溶解,气相色谱分析。
1.3.5 GC 检测条件 色谱柱:CP-Sil88 熔融石英毛细管柱(100 m×0.25 mm×0.2μm)。
分析经过Ag+-SPE 预分离后的脂肪酸顺反异构体。GC 程序升温的时间为110.33 min:45 ℃保持4 min,以13 ℃/min 升至150 ℃,保持47 min,再以4 ℃/min 升至215 ℃,保持35 min;FID 温度250 ℃,进样口温度250 ℃;载气(H2)流速30 mL/min,火焰离子化检测器为40 mL/min;净化空气流速300 mL/min 和补充气体(N2)流速30 mL/min;进样体积1 μL。
分析样品中总的脂肪酸成分。气相色谱程序升温的时间为86 min:45 ℃保持4 min,以13 ℃/min 的升温速率将温度升至175 ℃,保持27 min后再以4 ℃/min 的升温速率升至215 ℃,保持35 min。脂肪酸定性分析参照463 标样图谱确定,定量分析采用内标法。
1.3.6 统计方法 Excel 对数据进行分析处理,所有试验均重复3 次;SPSS 22.0 对数据进行分析,检测结果用Mean±SD 表示并且用单因素方差分析比较均值,P<0.05 为差异显著。
2 结果与分析
2.1 反刍动物油脂、食用油和煎炸油中trans C16:1 的组成和含量
表1 为反刍动物油脂、食用油和煎炸油trans C16:1异构体含量,在反刍动物油脂中检测到5~7种trans C16:1异构体,在食用油和煎炸油中检测到1~2种trans C16:1异构体。反刍动物油脂中总trans C16:1的含量(平均值为5.21 mg/g脂肪,3.07~7.96 mg/g脂肪)显著高于食用油和煎炸油总trans C16:1的含量(平均值为0.77 mg/g脂肪,0.27~1.18 mg/g脂肪)(P<0.05)。其中,9t C16:1含量最高(平均值为2.49,1.45~4.03 mg/g脂肪),其次为12t C16:1(平均值为0.77 mg/g脂肪,0.21~2.32 mg/g脂肪),6t-7t C16:1(平均值为0.56 mg/g脂肪,0.29~1.00 mg/g脂肪),10t C16:1(平均值为0.46 mg/g脂肪,0.10~2.15 mg/g脂肪),8t C16:1(平均值为0.43 mg/g脂肪,0.26~0.65 mg/g脂肪),11t C16:1(平均值为0.28 mg/g脂肪,0.14~0.40 mg/g脂肪)和13t C16:1(平均值为0.15 mg/g脂肪,0.12~0.23 mg/g脂肪)。
在反刍动物食品中,羊肉的trans C16:1含量最高,达到7.96 mg/g脂肪,其次是牛奶粉(6.38 mg/g脂肪),牛肉(6.08 mg/g脂肪);食用油和煎炸油中总trans C16:1的含量没有显著性差异,只检测到了6t-7t C16:1(0.29~1.0 mg/g脂肪)和12t C16:1(0.17~0.4 mg/g脂肪)。煎炸之后,茶籽油和芝麻油中6t-7t C16:1的含量显著增加(P<0.05)。
2.2 反刍动物油脂、食用油和煎炸油中trans C18:1 异构体的含量
表2 为反刍动物油脂、食用油和煎炸油中trans C18:1异构体的含量,在反刍动物油脂中检测到8~10种trans C18:1异构体,在食用油和煎炸油中检测到2~7种trans C18:1异构体。除煎炸葵花油(14.84 mg/g脂肪)外,反刍动物油脂中总trans C18:1含量(平均值18.02 mg/g脂肪,11.96~28.25 mg/g脂肪)高于食用油和煎炸油中总trans C18:1含量(平均值为7.43 mg/g脂肪,5.00~10.33 mg/g脂肪)。其中,11t C18:1的含量最高(平均值为4.24 mg/g脂肪,0.41~11.65 mg/g脂肪),其次为10t C18:1(平均值为2.40 mg/g脂肪,0.64~9.12 mg/g脂肪),9t C18:1(平均值为2.30 mg/g脂肪,0.29~6.56 mg/g脂肪),13t/14t C18:1(平均值为2.18 mg/g脂肪,0.17~3.85 mg/g脂肪),16t C18:1(平均值为1.18 mg/g脂肪,0.91~1.51 mg/g脂肪),6t-8t C18:1(平均值为1.11 mg/g脂肪,0.07~2.87 mg/g脂肪),12t C18:1(平均值为1.00 mg/g脂肪,0.19~1.73 mg/g脂肪),15t C18:1(平均值为0.79 mg/g脂肪,0.11~1.33 mg/g脂肪),4t C18:1(平均值为0.34 mg/g脂肪,0.05~1.97 mg/g脂肪),5t C18:1(平均值为0.17 mg/g脂肪,0.04~0.45 mg/g脂肪)。
在反刍动物食品中,羊肉中的trans C18:1的含量最高,达到28.25 mg/g脂肪,其次是羊肉(25.87 mg/g脂肪),羊奶(22.6 mg/g脂肪);食用油和煎炸油trans C18:1的含量没有显著性差异。煎炸之后,葵花油中6t-8t C18:1,9t C18:1,10t C18:1和11t C18:1的含量显著增加(P<0.05);花生油中的4t C18:1,5t C18:1,6t-8t C18:1,10t C18:1和11t C18:1的含量显著增加(P<0.05);玉米油中9t C18:1,10t C18:1,11t C18:1,12t C18:1和13-14t C18:1的含量显著增加(P<0.05);芝麻油中9t C18:1和11t C18:1的含量显著增加(P<0.05)。
2.3 反刍动物油脂、食用油和煎炸油中trans C18:2 和CLA 异构体的含量
表3 为反刍动物油脂、食用油和煎炸油trans C18:2和CLA 异构体含量的测定结果,在反刍动物油脂中共检测到5~6种trans C18:2和5~6种CLA,在食用油和煎炸油共检测到2~4种trans C18:2和3~6种CLA。食用油和煎炸油中总trans
C18:2的含量(平均值为6.91 mg/g脂肪,1.97~13.83 m/g脂肪)高于反刍动物油脂(平均值为4.39 mg/g脂肪,3.78~6.06 mg/g脂肪);其中,9t12c C18:2含量最高(平均值为2.17 mg/g脂肪,0.76~6.81 mg/g脂肪),其次是9c12t C18:2(平均值为2.10 mg/g脂肪,0.51~6.60 mg/g脂肪),9t12t C18:2(平均值为1.05 mg/g脂肪,0.31~1.71 mg/g脂肪),17cyclo(平均值为0.87 mg/g脂肪,0.42 ~2.03 mg/g脂肪),8c12t C18:2(平均值为0.49 mg/g脂肪,0.32~0.66 mg/g脂肪)。
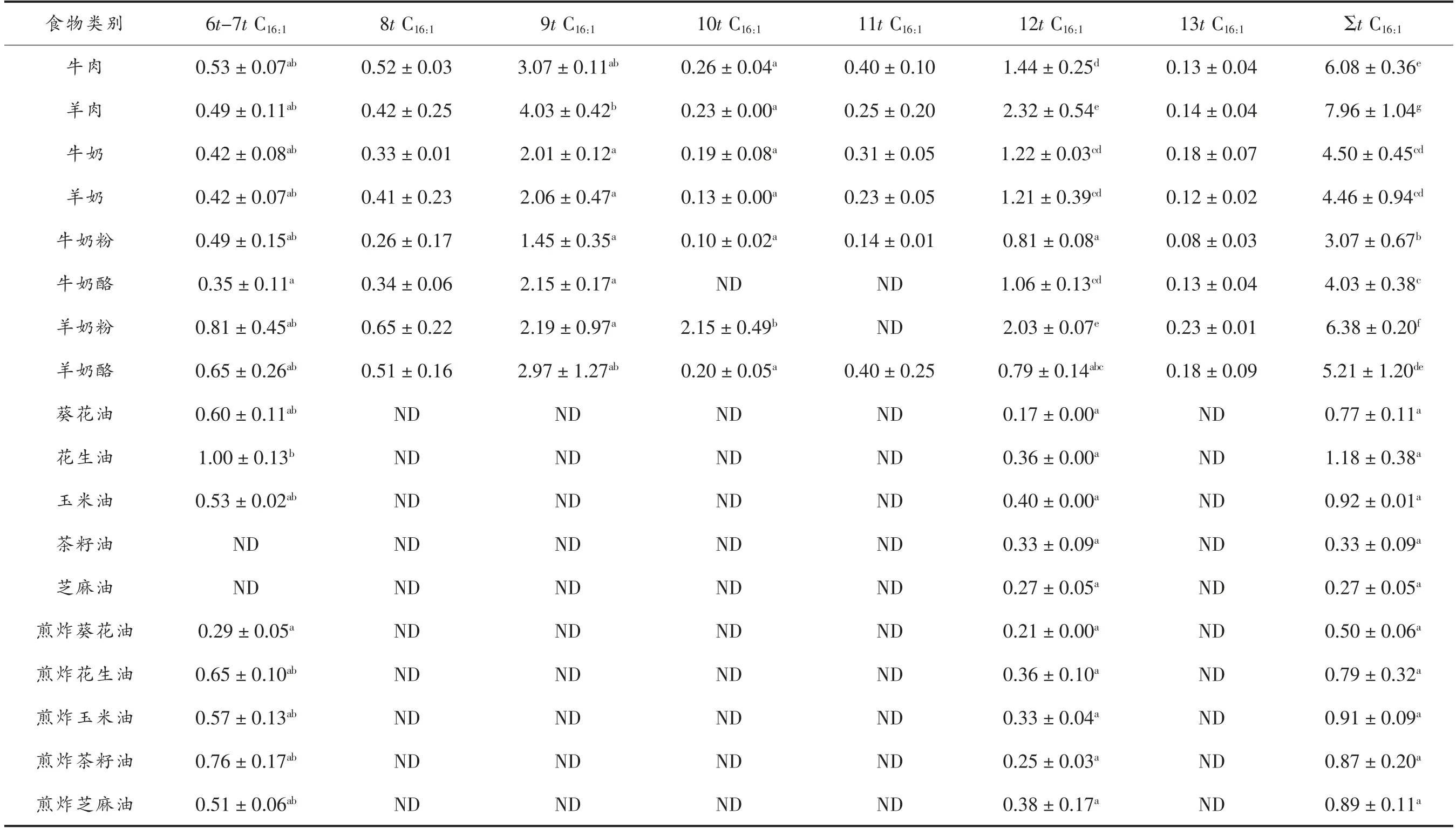
表1 反刍动物油脂、食用油和煎炸油中trans C16:1 异构体的含量(mg/g脂肪)Table 1 Fatty acids compositions of trans C16:1 isomers in ruminant animals fat,edible oils and frying oils(mg/g fat)
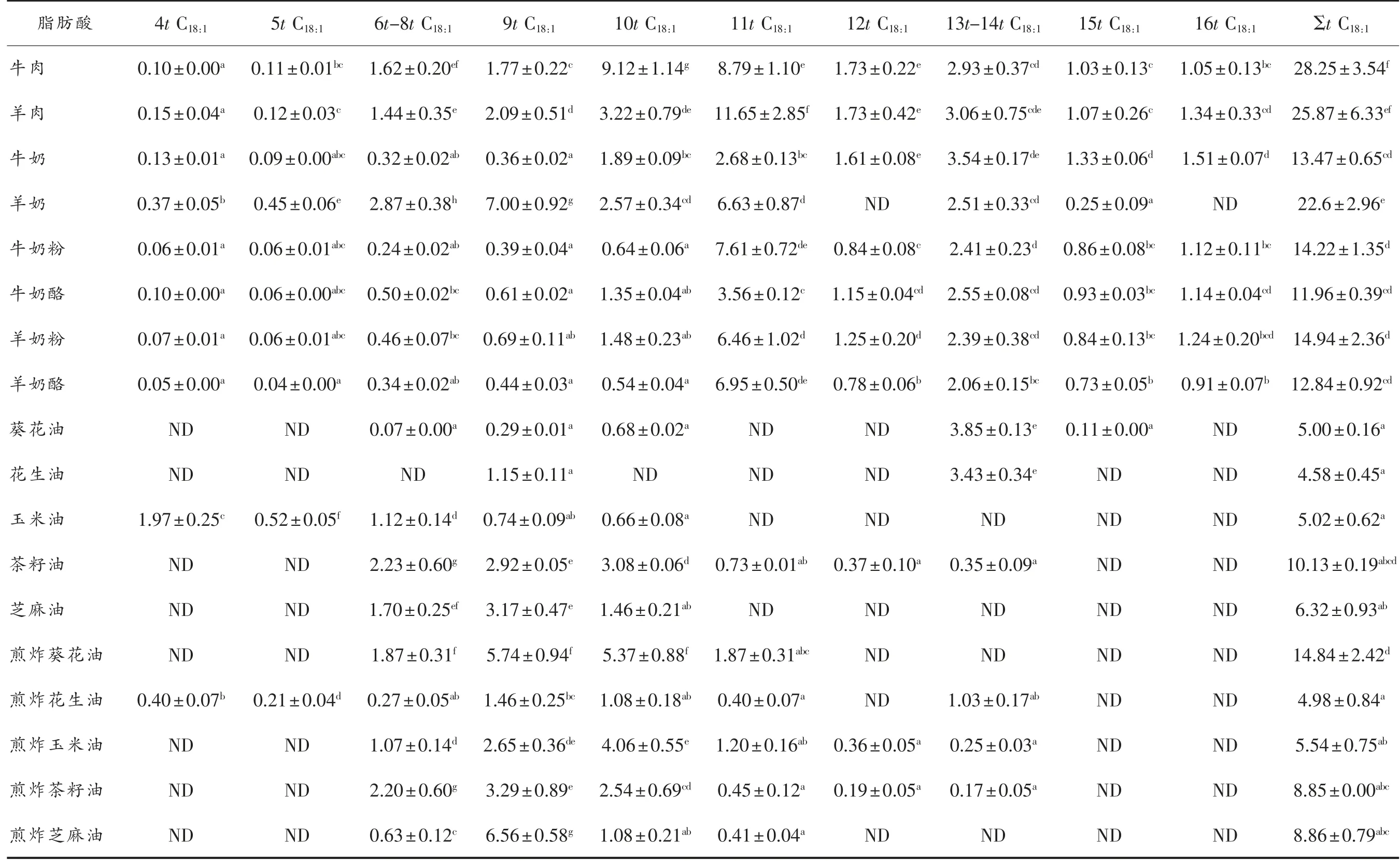
表2 反刍动物油脂、食用油和煎炸油中trans C18:1 异构体的含量(mg/g脂肪)Table 2 Fatty acids compositions of trans C18:1 isomers in ruminant animals fat,edible oils and frying oils(mg/g fat)
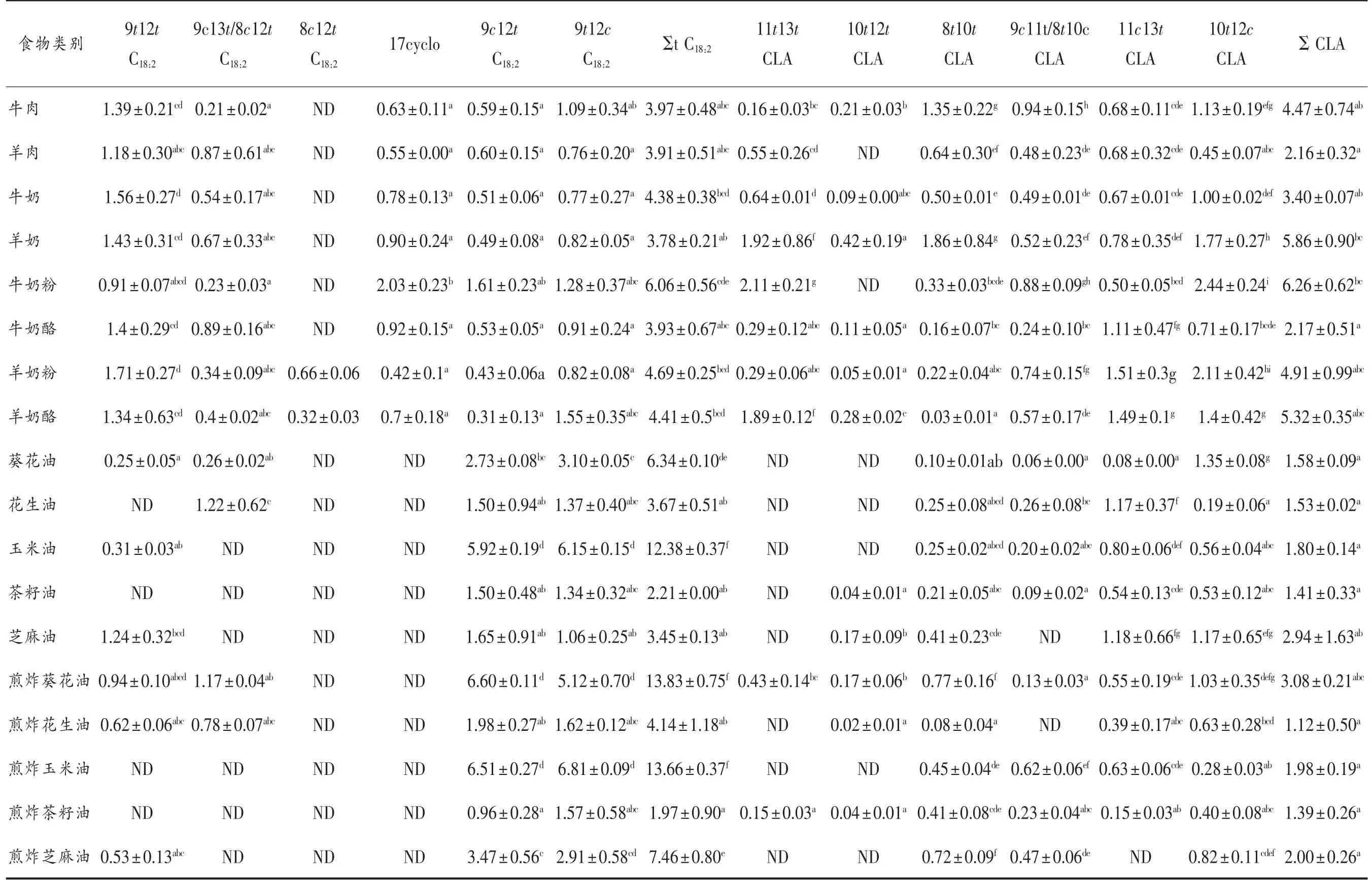
表3 反刍动物油脂、食用油和煎炸油中trans C18:2 和CLA 异构体的含量(mg/g脂肪)Table 3 Fatty acids compositions of trans C18:2 and CLA isomersin ruminant animals fat,edible oils and frying oils(mg/g fat)
在反刍动物油脂中,牛奶粉中的trans C18:2的含量最高,达到6.06 mg/g脂肪,其次是羊奶粉(4.69 mg/g脂肪);食用油和煎炸油中,煎炸葵花油的trans C18:2的含量最高,达到13.83 mg/g脂肪,其次是煎炸玉米油(13.66 mg/g脂肪)和玉米油(12.38 mg/g脂肪)。煎炸之后,葵花油和芝麻油中的9t12c C18:2和9c12t C18:2的含量显著增加(P<0.05)。
反刍动物油脂中CLA 的含量(平均值为4.32 mg/g脂肪,2.16~6.26 mg/g脂肪)显著高于食用油和煎炸油中CLA 的含量(平均值为1.88 mg/g脂肪,1.41~3.08 mg/g脂肪)(P<0.05);其中10t12c C18:2的含量最高(平均值为1.00 mg/g脂肪,0.40~2.44 mg/g脂肪),其次是11t13t C18:2(平均值 为0.98 mg/g脂肪,0.15~2.11 mg/g脂肪),11c13t C18:2(平均值为0.76 mg/g脂肪,0.15~1.51 mg/g脂肪),9c11t/8t10c C18:2(平均值为0.52 mg/g脂肪,0.06~0.94 mg/g脂肪),8t10t C18:2(平均值为0.49 mg/g脂肪,0.03~1.86 mg/g脂肪),10t12t C18:2(平均值为0.15 mg/g脂肪,0.02~0.42 mg/g脂肪)。
在反刍动物油脂中,牛奶粉中的CLA 的含量最高,达到6.26 mg/g脂肪,其次是羊奶(5.86 mg/g脂肪);食用油和煎炸油中总CLA 的含量没有显著差异。煎炸之后,葵花油中除10t12c C18:2外的其它异构体的含量均显著增加(P<0.05);花生油中 的10t12c C18:2和10t12t C18:2的含量显著增加(P<0.05);玉米油中9c11t/8t10c C18:2的含量显著增加(P<0.05);茶籽油中11t13t C18:2的含量显著增加(P<0.05);芝麻油中8t10t C18:2和9c11t/8t10c C18:2的含量显著增加(P<0.05)。
3 讨论
trans C16:1主要存在于反刍动物脂质中,占总脂肪酸的0.36%~0.85%,其中,9t C16:1(1.45~4.03 mg/g脂肪)是主要异构体,占总trans C16:1的34.33%~57.00%;食用油中的trans C16:1极其微量,占总脂肪酸的0.03%~0.14%。牛奶脂质trans C16:1的含量与Kramer等[20]的研究结果 一致,牛肉脂质中trans C16:1的含量高于丹麦居民食用牛肉的含量[21],而羊肉中含量与之一致,可能与动物种类和采取部分以及放养季节有关;主要异构体9t C16:1的含量也与研究报道一致[22]。trans C16:1主要来源于反刍动物脂质,反刍动物中trans C18:1通过β 氧化可形成trans C16:1异构体,其次饲料中的7t10t13t C16:3经过生物氢化也可以合成trans C16:1异构体[23-25]。研究报道[23,26-27]9t C16:1可以降低2 型糖尿病和冠状动脉疾病的发生率,降低甘油三脂,升高高密度脂蛋白胆固醇,减少代谢调节异常,并抑制肝脏脂肪重生。
trans C18:1是反刍动物中一类重要的脂肪酸,占总脂肪酸的1.84%~3.88%,与Wolff等[28]结果一致,其中,11t C18:1是主要的异构体,占总trans C18:1的19.85%~54.00%;而食用油和煎炸油中trans C18:1分别占总脂肪酸0.72%~0.90%和0.79%~1.03%,其中,9t C18:1是主要的异构体,分别占食用油和煎炸油中总trans C18:1的5.80%~50.16%和29.32%~74.04%;煎炸之后,由高于活化能的热能作用下,食用油中的多不饱和脂肪酸异构化,trans C18:1的含量增加。大量研究证明[29-30]反刍动物具有大量异构化酶和还原酶,其脂质中的trans C18:1是由饲料中的不饱和脂肪酸(油酸、亚油酸等)在反刍动物瘤胃内经微生物(丁酸弧菌等)的生物氢化作用产生,经血液循环传递到乳脂和自身脂肪中。氢化油中9t C18:1与心血管疾病和动脉粥样硬化呈正相关。有研究报道反刍动物油脂中主要异构体是11t C18:1可改善脂质代谢紊乱,而9t C18:1则会诱发心血管疾病的发生[31]。本课题组比较了相同浓度的11t C18:1和9t C18:1对内皮细胞的影响,发现两者均会诱导内皮细胞炎症,但是11t C18:1对内皮细胞的损伤明显低于9t C18:1[18]。
trans C18:2的主要来源是煎炸油,占总脂肪酸的0.28%~1.84%,其中,葵花油和芝麻油经煎炸后trans C18:2的含量显著增加,分别达到13.83 mg/g脂肪和7.46 mg/g脂肪,与杨波涛等[32-33]报道一致。食用油中的亚油酸在高温煎炸下会发生异构化,全顺式亚油酸会转化为反式亚油酸。反刍动物脂质由微生物作用产生少量的trans C18:2,占总脂肪酸的0.44%~0.91%。研究显示[34]trans C18:2相对于trans C18:1具有更强的促人脐静脉平滑肌细胞增殖的作用;红细胞膜中的trans C18:2的水平和院外心脏骤停呈正相关[35]。
CLA 的主要来源是反刍动物油脂,占总脂肪酸的0.48%~0.94%,其中羊奶CLA 的含量与Alonso等[36]研究一致,食用油和煎炸油中含有微量的CLA,占总脂肪酸的0.16%~0.33%,芝麻油中含有相对较高的CLA(2.94 mg/g脂肪),占总脂肪酸的0.13%。在反刍动物瘤胃中亚油酸和亚麻酸通过异构化和生物脱氢反应生成CLA,11t C18:1在动物细胞内经Δ-9 脱氢酶的脱氢作用也能形成CLA,可以增强免疫力,抗动脉粥样硬化,抗癌[37-39]。
4 结论
本研究是以反刍动物油脂、食用油和煎炸油为研究对象,结合Ag+-SPE 和GC 色谱2种升温程序测定食物中trans C16:1,trans C18:1,trans C18:2和CLA 异构体的含量。结果发现,样品中共检测出23种反式脂肪酸,其中7种trans C16:1,10种trans C18:1,6种trans C18:2和6种CLA 异构体。
反刍动物油脂中trans C16:1,trans C18:1和CLA显著高于食用油和煎炸油,而煎炸油中trans C18:2含量较高。反刍动x物油脂中9t C16:1,11t C18:1,9t12t C18:2是主要TFAs异构体,10t12c C18:2是主要的CLA 异构体;而食用油和煎炸油中12t C16:1,9t C18:1,9t12c C18:2,9c12t C18:2为主要的TFAs 异构 体,10t12c C18:2和11c13t C18:2是CLA的主要异构体。可见,反刍动物油脂和食用油、煎炸油中主要TFAs 异构体不同,而不同来源的TFAs 的组成和含量的差别,是不同来源TFAs 对人体健康影响的差异原因之一。对比食用油煎炸前后,茶籽油脂肪酸组成变化最小,而大部分煎炸油比未煎炸油中trans C18:2,trans C18:1的含量显著增加,由此可见茶籽油适合煎炸,富含多不饱和脂肪酸的食用油经煎炸后会产生较多的trans C18:2,而trans C18:2比trans C18:1对人体健康存在更大的潜在隐患,因此对煎炸油品质的控制应引起高度重视。

