酶法改性对米糠蛋白凝胶硬度及功能性质的影响
于殿宇 张 欣 邹丹阳 唐月 刘文质 任嘉嘉 王立琦 杜 晶*
(1 东北农业大学 哈尔滨150030 2 哈尔滨商业大学 哈尔滨150028 3 中机康元粮油装备(北京)有限公司 北京100083)
米糠蛋白是一种营养价值很高的植物源蛋白质,其必需氨基酸组成齐全[1-2],并且必需氨基酸的比例较为平衡,接近FAO/WHO 推荐模式[3-5]。因米糠蛋白与牛乳中酪蛋白的生物效价非常接近,故消化率相对较高[6]。另外,米糠蛋白具有过敏性低的优点,可大力开发并将其应用到的婴幼儿食品中[7-8]。米糠蛋白还具有良好的溶解性、乳化性、起泡性及持油性等一系列功能性质,具有非常可观的开发潜力[9-10],可作为理想的食用蛋白质资源加以开发利用[11]。米糠为稻米加工中的副产品,目前我国米糠的年产量达1000 万吨以上。米糠蛋白质含量占总质量的12%~15%,生物效价为2.0~2.5,其营养价值远优于酪蛋白,可与鸡蛋蛋白相媲美[12-16]。鉴于此,米糠蛋白作为天然优质蛋白质值得大力开发和利用。
米糠蛋白是一种优质的天然植物蛋白质资源,其组成成分和功能性质会影响米糠食品的感官和质构等特性[17-18]。蛋白质改性可通过对蛋白质结构进行一定修饰,从而改善其蛋白质产品在贮藏过程中的物理化学性质[19-21]。蛋白质改性方法主要包括:物理改性、化学改性、基因工程改性及生物酶改性等[22]。酶法改性是最常用的改性方法,其最大的优点是不会导致蛋白质中营养成分损失,也很少产生毒理学方面的问题[23]。转谷氨酰胺酶(Transglutaminase,TG)是催化转酰基反应和催化同一种蛋白质或者不同种蛋白质分子之间交联、聚合形成新共价键的一种聚合酶[24],而改变共价键的数目和强度都会使蛋白质的凝胶性能发生改变。使用该酶对蛋白质改性的途径包括胺的导入、交联及脱胺,这3种途径不仅提高了蛋白质的营养效价,还改善了食品的功能特性,延长了货价期,减少食品中的过敏源。
本试验研究了转谷氨酰胺酶(TG)改性后米糠蛋白的凝胶硬度、溶解性、乳化性和乳化稳定性、起泡性和泡沫稳定性等功能性质的变化情况,探讨蛋白质质量分数、加酶量及改性时间等对米糠蛋白凝胶硬度的影响,为今后改善植物蛋白品质提供一定的理论参考依据。
1 材料与方法
1.1 材料与试剂
米糠,黑龙江省北大荒农业股份有限公司。经碱溶酸沉提取米糠蛋白,经测定蛋白质含量为92.5%。转谷氨酰胺酶(TG,酶活力100 U/g)、磷酸二氢钾、磷酸氢二钾、盐酸等均为分析纯级,中国化学试剂网。
1.2 仪器与设备
TA.XT Plus 物性测试仪,英国Stable Micro Systems 公司;AL2044 型电子天平,上海衡平仪器仪表厂;752 型紫外可见分光光度计,上海佑科仪器有限公司;PHS-3C 精密pH 计,上海大普仪器;FW100 高速万能粉碎机,上海顶帅仪器有限公司;LXJ-ⅡB 离心机,上海安亭仪器厂;C-18F 电磁炉,广东银港科技股份有限公司;电热恒温水浴锅,江苏金坛市环宇科学仪器厂;BCD-257SL 型冰箱,中国海尔集团;DHG-9070A 型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;S-3400N扫描电镜,日本Hitachi 公司。
1.3 试验方法
1.3.1 TG 改性米糠蛋白的制备 称取一定质量米糠蛋白,加入不同含量TG 后,加入100 mL pH为8 的磷酸缓冲液,于45 ℃条件下水浴1~5 h,水浴结束后置于3 000 r/min 的离心机中离心15 min,冻干后储存备用。
1.3.2 响应面优化试验 在蛋白质质量分数、改性时间及加酶量为试验单因素的基础上,以酶改性后米糠蛋白的硬度为响应值,进行响应面优化试验。采用Design Expert 8.0.6 统计软件,设计及分析响应面试验,试验因素水平表见表1。
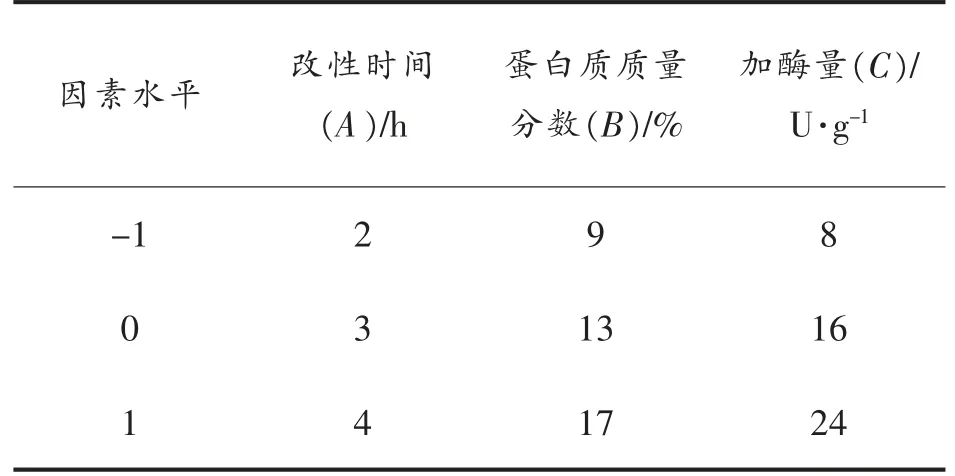
表1 响应面影响因素及水平Table 1 Influence factors and levels of response surface
1.3.3 TG 改性米糠蛋白凝胶硬度测定 运行模式:TPA,测前速度:2.0 mm/s,测试速度:0.8 mm/s,下压距离:50%,测后速度:0.8 mm/s,数据采集速率:200 pps。试验重复3 次。凝胶硬度为第一次挤压变形时产生的最大刺破力(g)。
1.3.4 TG 改性米糠蛋白功能性质的测定
1.3.4.1 持水力测定 称取0.5 g 改性后米糠蛋白,溶于9.5 mL 蒸馏水中,用玻璃棒搅拌均匀,置于室温下30 min,于3 000 r/min 条件下离心10 min,称量下沉物质量m,持水力(Water binding capability,WBC)根据式(1)计算:

式中,m——下沉物质量,g;0.5——米糠蛋白质量,g;WBC——持水力,g/g。
1.3.4.2 溶解性测定[25]称取0.25 g 改性后米糠蛋白溶于10 mL 蒸馏水中,置于磁力搅拌机中均匀搅拌1 h,于3 000 r/min 条件下离心10 min,采用凯氏定氮法测定上清液中的蛋白质含量。
1.3.4.3 乳化性及乳化稳定性 参照Ali等[26]的方法,采用pH 为8 的磷酸缓冲液配制质量分数为0.6%的蛋白质溶液。量取24 mL 蛋白质溶液加入8 mL 一级大豆油,在剪切乳化仪中高速均质(10 000 r/min)1 min 制成乳状液状态,立即用移液管量取1 mL 乳状液与9 mL SDS(0.1%)溶液混匀,并用0.1% SDS 溶液作为空白对照,采用分光光度计在波长500 nm 处测定吸光值(A0)。乳状液静置20 min 后,再次取样测定。乳化活力(EA)以刚开始的吸光值A0表示,乳化稳定指数(ESI)根据式(2)计算:

式中,A0——初始乳化液的吸光值;Δt——20 min;ΔA——20 min 后的吸光度与A0之差。
1.3.4.4 起泡性及泡沫稳定性[27]将改性的米糠蛋白配置成质量分数为1%的蛋白溶液,取100 mL 蛋白溶液在组织捣碎机中高速搅打(10 000 r/min)2 min 后,迅速倒入200 mL 量筒中,记录泡沫体积V1,静置10 min 后再次测量泡沫体积V2,起泡性和泡沫稳定性分别按式(3)和式(4)计算:
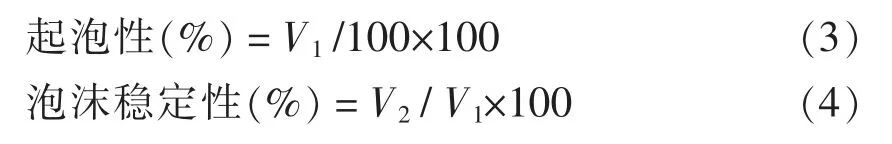
式中,V1——静置前泡沫体积,mL;V2——静置后泡沫体积,mL。
1.4 扫描电子显微镜的测定
将酶改性前后的冻干米糠蛋白样品用导电双面胶布均匀分散并固定在样品台上,采用Hitachi E-1010 离子溅射仪镀金,在加速电压为5.0 kV的条件下用扫描电子显微镜对样品的微观形态进行观察。
1.5 数据处理
试验指标均重复测定3 次,试验结果取平均值和标准误差值,数据采用Origin 7.5 与Design Expert 8.0.6 进行分析和绘制。采用SPSS 22.0 进行ANOVA 单因素方差分析,采用Ducan 检验(P<0.05)检验数据的差异显著性。
2 结果与分析
2.1 酶改性条件对米糠蛋白凝胶硬度的影响
2.1.1 米糠蛋白质质量分数对米糠凝胶硬度的影响 在加酶量19 U/g,改性时间3 h 的条件下,研究米糠蛋白质质量分数对米糠蛋白凝胶硬度的影响。由图1可知,当米糠蛋白质量分数在5%~13%范围内,凝胶硬度不断增大,在蛋白质质量分数为13%~21%范围内,凝胶硬度呈下降的趋势,在蛋白质质量分数为13%时凝胶效果最佳。蛋白质质量分数为5%时,硬度为0 不成凝胶,这是可能是由于蛋白质质量分数较低时,蛋白质分子之间的接触几率较低,因而不能形成凝胶。在一般情况下,当蛋白质质量分数较低时,蛋白质与溶剂之间的相互作用高于蛋白质与蛋白质分子之间的相互作用,蛋白质与溶剂的作用占据了主导优势,因此体系形成凝胶的难度较大。然而当蛋白质质量分数相对较高时,酶的相对浓度较低,导致蛋白分子与酶分子的碰撞几率降低,反应速度降低,凝胶硬度也随之降低[28]。
2.1.2 TG 加酶量对米糠凝胶硬度的影响 在米糠蛋白质质量分数为13%,改性时间为3 h 的条件下,研究加酶量对米糠蛋白硬度的影响。
由图2可知,加酶量在0~16 U/g 范围内,凝胶硬度随着加酶量的增加而增加。而当加酶量在16~32 U/g 范围内,凝胶硬度随着加酶量的增加而逐渐降低,这是因为当底物质量分数一定时,加酶量会存在一个临界值[29]。当酶添加量小于16 U/g时,由于酶的添加量过少,不能够结合所有的底物,网状结构形成不完全,导致凝胶硬度较低。加酶量过高反而会破坏体系中底物与酶的动态平衡,使得凝胶硬度降低。
2.1.3 改性时间对米糠蛋白凝胶硬度的影响 在加酶量为19 U/g,米糠蛋白质质量分数为13%的条件下,研究改性时间对米糠蛋白硬度的影响。
由图3可知,改性时间在1~3 h 范围内,米糠蛋白的凝胶硬度随着时间的增加而增大,改性时间为3 h 时,凝胶硬度达到最大值,这可能是由于作用时间的增加,酶与蛋白质底物持续反应,交联的复合产物不断增多,进而提高凝胶硬度。当改性时间继续增加,凝胶硬度呈下降趋势,推测可能是由于过长时间的改性导致蛋白质凝胶网络中疏水基团发生变化,氢键以及非共价键断裂,使得凝胶硬度降低。
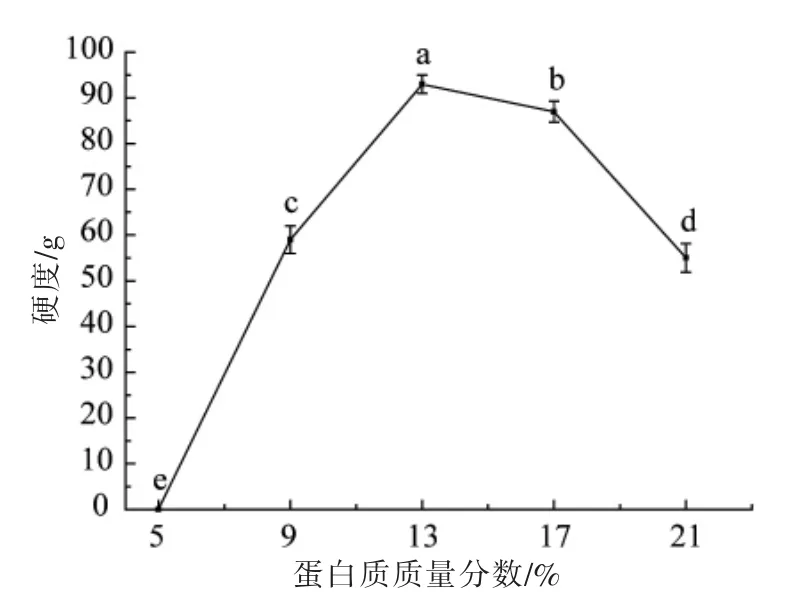
图1 米糠蛋白质质量分数对米糠蛋白凝胶硬度的影响Fig.1 Effects of protein mass fraction on gel hardness of rice bran protein
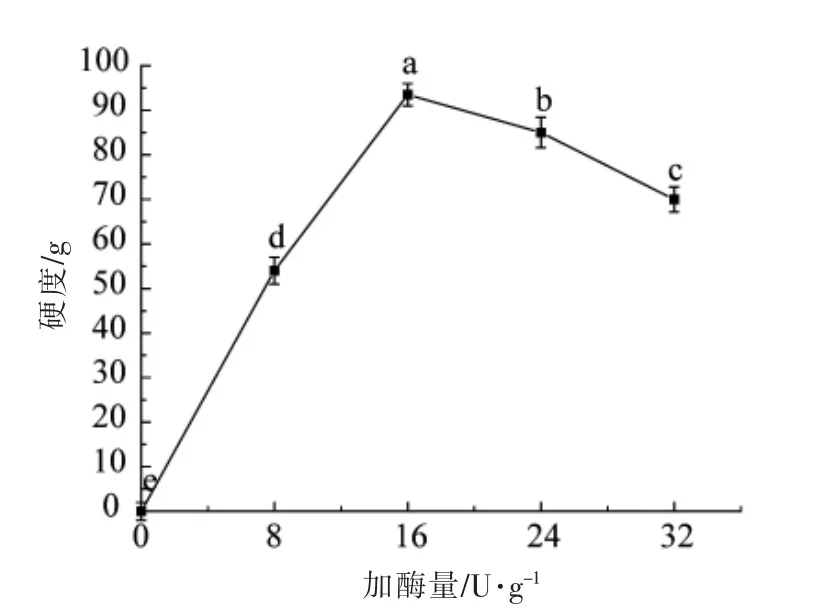
图2 TG 加酶量对米糠蛋白凝胶硬度的影响Fig.2 Effects of enzyme addition on firmness of rice bran protein gel
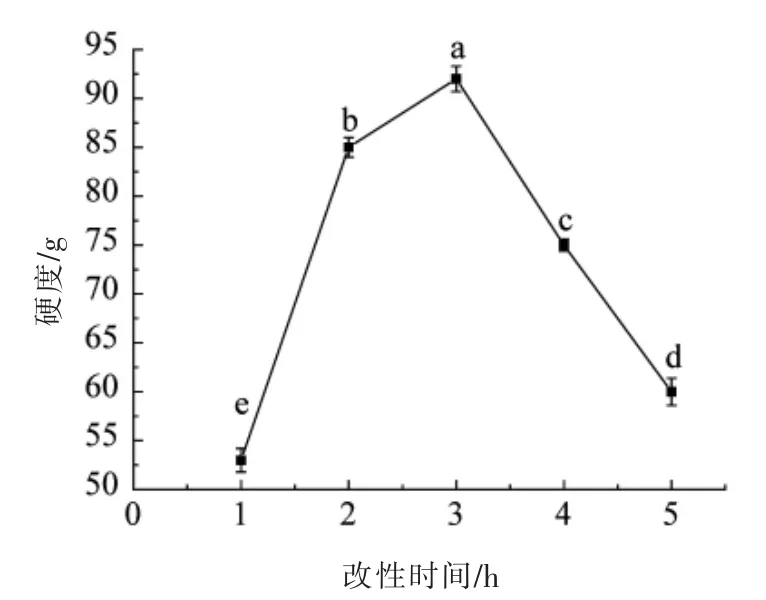
图3 改性时间对米糠蛋白凝胶硬度的影响Fig.3 Effects of modification time on hardness of rice bran protein gel
2.2 响应面分析结果
2.2.1 响应面法的试验结果及方差分析 采用Design Expert 8.0.6 对表2 中的试验数据回归拟合,得到硬度R 与自变量改性时间(A)、蛋白质质质量分数(B)、加酶量(C)的二次回归编码方程模型为:
R=+90.32+4.91A+0.44B+12.38C-11.70AB+0.88AC-18.06-15.46B2-13.48C2
由于二次回归编码方程模型在响应面设计中的各个因素均经过无量纲性编码处理,且各因素间一次项、交互项与平方项的回归系数均不相关,故可以根据编码方程中各个回归系数的绝对值大小直接比较各因素对响应值的影响程度,依次为:加酶量(C)>改性时间(A)>蛋白质质量分数(B)。
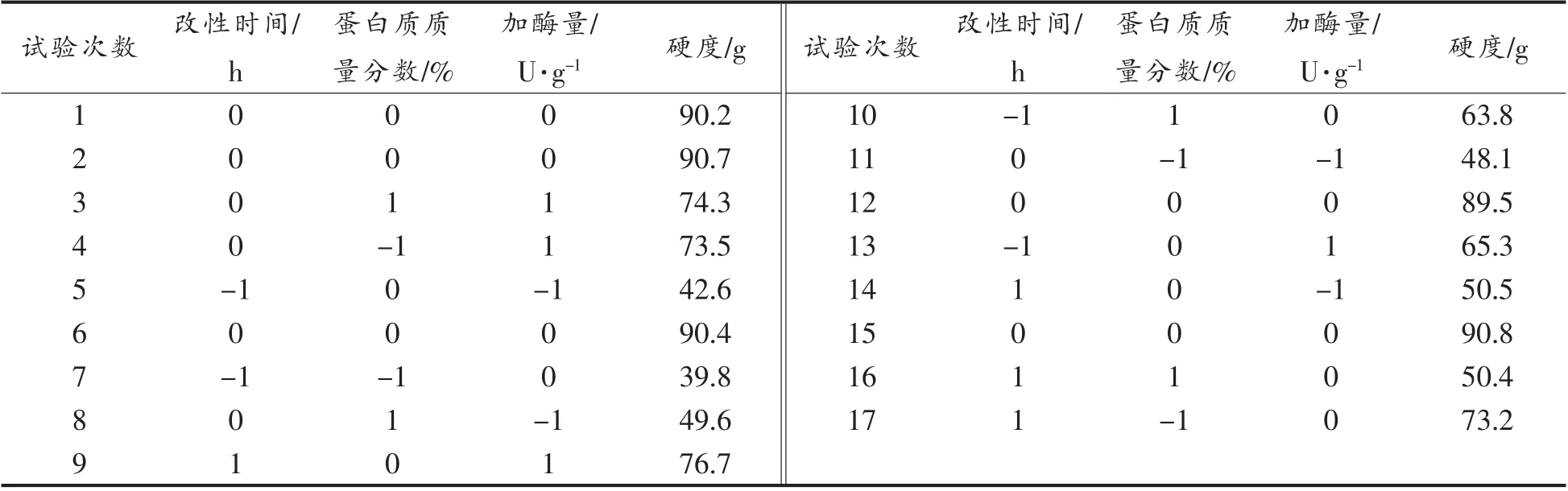
表2 响应面试验设计方案及结果Table 2 Respone plane test plan design and results
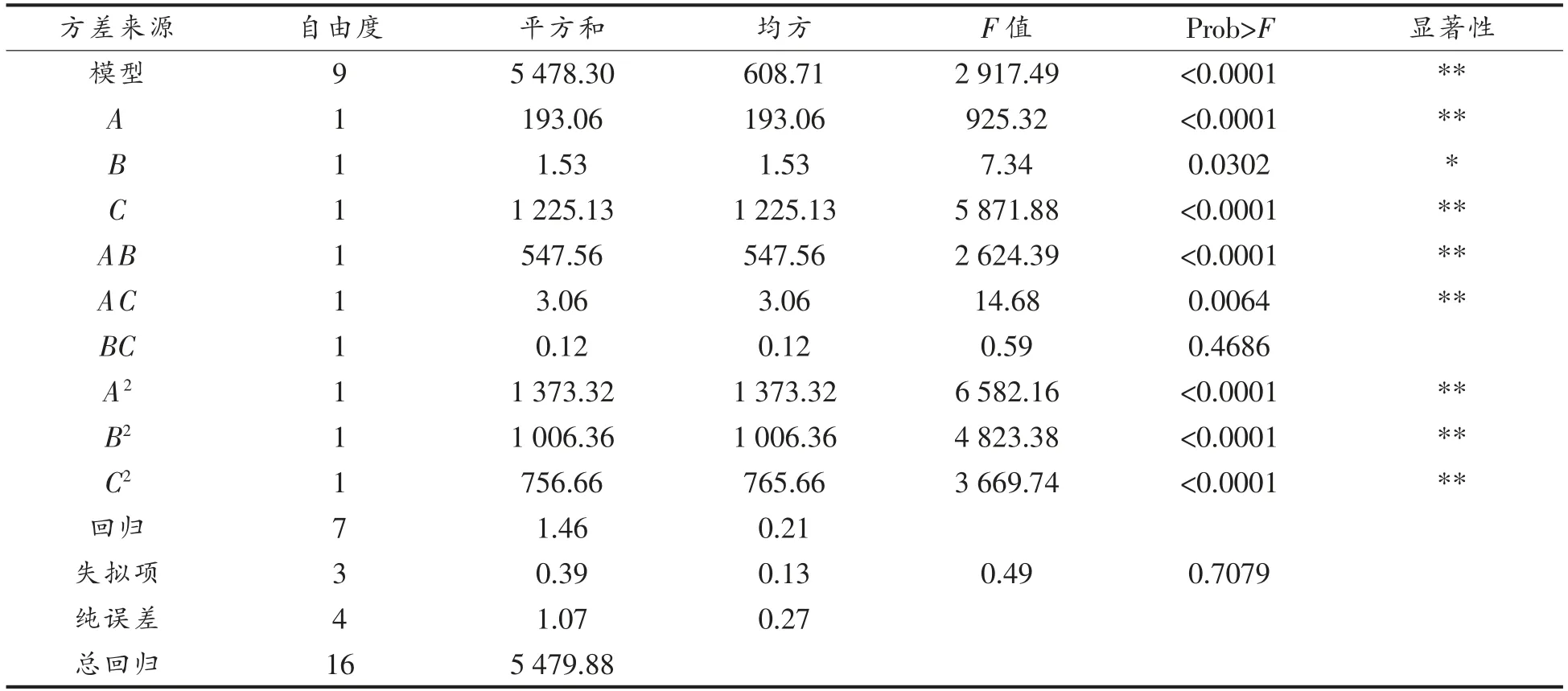
表3 方差分析结果Table 3 The test results of variance analysis
由表3可知,回归方程的因变量与自变量之间存在明显的线性关系,该模型回归显著(P<0.0001),失拟项不显著(P>0.05),由表3可知失拟项P 值为0.7079,大于0.05 表明失拟项不显著,模型P<0.0001,小于0.05 表明模型显著,并且模型中的参数A,B,C,AB,AC,A2,B2,C2均显著。模型相关系数R2=0.9997,表明模型拟合度较好,能较好地反映各因素与相应值变化的关系。
2.2.2 最优条件的求证及验证 采用软件Design Expert 8.0.6 得到酶改性米糠蛋白的最佳工艺条件为改性时间3.2 h,蛋白质质量分数12.8%,加酶量19.7 U/g,预测最佳凝胶硬度的理论值为93.58 g。对优化条件进行验证试验,重复3 次,凝胶的硬度可达到93.54 g,预测值与理论值基本一致,表明响应面优化得到的最佳工艺条件真实可靠。
2.3 改性前、后米糠蛋白功能性质的研究分析
在最佳改性条件下,即加酶量19.7 U/g,改性时间3 h,蛋白质质量分数为13%,得到酶改性前后米糠蛋白功能性质。
由表4可知,经酶改性处理后米糠蛋白持水力增加了162%,推测是由于肽链中谷氨酰胺残基的γ 一羧酰胺基和赖氨酸残基的ε-氨基分别作为酰基的供体和受体,在一定条件下形成蛋白质分子内以及分子间的ε-(γ-谷氨酰)赖氨酸异肽键[30],使蛋白质分子产生交联,形成了更多水的结合位点,留住更多的水分,使得酶改性后米糠蛋白的持水性显著提高。
酶改性后米糠蛋白的溶解度有一定程度的提高,然而改善效果不明显,溶解度增加约31.1%。这可能是由于蛋白质分子交联使分子质量增大,并且交联后可能会导致内部的疏水基团暴露在蛋白质分子表面,从而使得溶解度下降;TG 使谷氨酰胺和天冬酰胺转化为谷氨酸和天冬氨酸,使得电离出的离子团增多,导致米糠蛋白溶解度增加[31]。
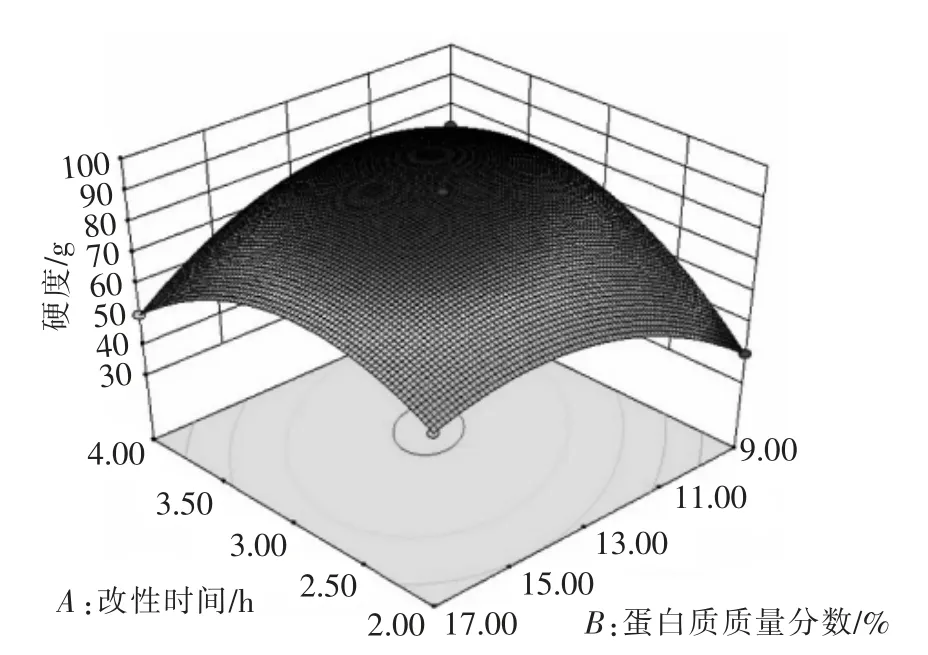
图4 蛋白质质量分数和酶改性时间对米糠蛋白凝胶硬度的影响Fig.4 Effects of protein mass fraction and enzyme modification time on gel hardness of rice bran protein
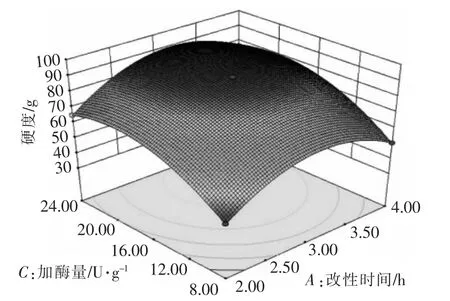
图5 加酶量和酶改性时间对米糖蛋白凝胶硬度的影响Fig.5 Effects of enzyme addition and enzyme modification time on gel hardness of rice bran protein
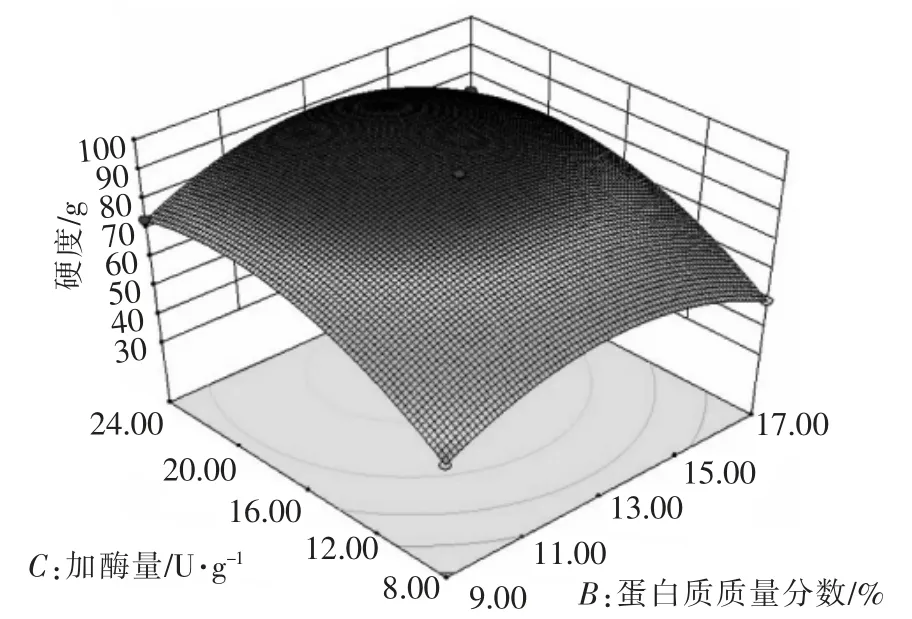
图6 加酶量和蛋白质质量分数对米糖蛋白凝胶硬度的影响Fig.6 Effects of enzyme addition and protein mass fraction on gel hardness of rice bran protein
酶改性后的米糠蛋白的乳化性提高了52.7%,乳化稳定性提高了25.4%。已有报道指出蛋白质的构象对蛋白质的乳化性有着至关重要的作用[32]。TG 酶水解使得蛋白质构象发生改变,影响蛋白质的疏水作用,使原本包埋于蛋白质内部的疏水性残基暴露,进而提高了蛋白质在油、水界面的吸附能力。并且由于酶改性后蛋白质分子中净电荷数量增加,增大了静电斥力,使得油滴更难以聚合,最终提高了蛋白质的乳化性和乳化稳定性。酶改性后米糠蛋白的起泡性提高了33.3%,稳定性略微提高了7.2%。蛋白质的起泡能力与静电相互作用、疏水相互作用以及二硫键的稳定性有关,酶解可能使得蛋白质的二级结构与三级结构部分展开,破坏了疏水相互作用和离子键,降低了表面张力,导致气、水界面更容易吸附空气中的泡沫,从而增加泡沫稳定性[33]。疏水性的增加同时也可以增强起泡能力[34],使得蛋白质在气、水界面快速吸附,进而提高起泡能力和泡沫稳定性。

表4 改性对米糠蛋白功能性质的影响Table 4 Effects of modification on functional properties of rice bran protein powder
酶改性后米糠蛋白的持油性提高了114%,这可能是由于酶处理导致蛋白质结构展开,更多疏水基团暴露,使得更多油相被截留,导致持油性显著提高。
2.4 不同加酶量对米糠蛋白结构的影响
于蛋白质质量分数为12.8%,改性时间为3.2 h,TG 酶添加量分为0,16,20,24 U/g 的条件下酶改性后的米糠蛋白扫描电镜图如图7所示。
向米糠蛋白中添加TG 会使蛋白的空间结构发生改变,这种酶改性作用会导致蛋白质内部或蛋白质分子间的共价键或非共价键断裂,并对蛋白质的次级键产生一定影响,导致蛋白质的空间结构被破坏。扫描电子显微镜(SEM)可以直观的观察到米糠蛋白经过酶改性后其空间微观结构的变化情况,图7a是米糠蛋白酶改性前的SEM 图,与图7b,7c,7d 对比可以明显看出,改性前的米糠蛋白结构较为紧密,随着加酶量增加至16 U/g 时(图7b),米糠蛋白呈现出与海绵类似的结构,空洞明显变多、变大,之前较紧密的片层结构间出现了一些较大的空洞。当加酶量增加到20 U/g 时(图7c),米糠蛋白海绵状结构变得更加紧密,孔洞结构变小。当加酶量增加至24 U/g 时(图7d),米糠蛋白酶改性效果不理想,结构变化不显著。因此,酶添加量20 U/g 的条件下米糠蛋白酶改性效果较好。
3 结论
经TG 改性后的米糠蛋白质的持水力显著提高,溶解度略微增加,乳化性和乳化稳定性得到了一定程度提高,起泡性提高而起泡稳定性略微提高,持油性明显提高。由扫描电子显微镜观察酶改性前、后米糠蛋白的微观结构,可以看出改性后的孔洞结构变多,由原来紧密的结构变为类似海绵结构,说明酶改性可有效改善米糠蛋白的结构。

