时差成像系统在选择高发育潜能未成熟卵母细胞体外成熟受精胚胎中的应用
狄春光 王丽萍 王慧 王功发 王毅 朱琴
时差成像系统(time-lapse imaging system,TLI)为非侵入胚胎评估系统,通过对常规体外受精(in vitro fertilization,IVF)周期中培养过程中的胚胎连续观察,获得胚胎发育的时间参数,从而准确评估其发育潜能[1]。TLI克服了传统评估方法对胚胎发育观察不够全面、缺少可量化指标等缺点。胚胎暴露于大量光源中不利于胚胎的发育,而TLI对胚胎的总光源暴露量明显低于IVF实验室传统倒置显微镜观察所需[2]。研究表明采用TLI观察胚胎不会对胚胎发育产生不利影响,是安全的[3-5]。已有研究者利用TLI与传统的形态学评估方法结合,建立了一系列较为科学的胚胎评估体系用于挑选最具妊娠潜能的胚胎,以改善临床妊娠结局[6-7]。未成熟卵母细胞体外成熟(in vitro maturation,IVM)是一项新的辅助生殖技术,用于治疗难治性多囊卵巢综合征不孕和诱导排卵周期中卵巢反应不良的患者。因IVM技术在体外进行,卵母细胞生长的微环境发生改变会导致其成熟机制也发生改变,进而会影响后续胚胎的发育潜能,有研究表明未成熟卵母细胞IVM后形成胚胎(IVM胚胎)发育潜能较正常胚胎发育潜能差[8]。目前,IVM胚胎的临床妊娠率为35%~40%,低于正常胚胎妊娠率[9]。因此,如何提高IVM胚胎的临床妊娠率是一个迫切需要解决的问题。目前国内外利用TLI评估正常IVF周期胚胎发育潜能提高临床妊娠率的研究不少,但利用TLI选择高发育潜能的IVM胚胎的报道不多。本研究旨在探讨如何利用TLI选择高发育潜能的IVM胚胎,现报道如下。
1 对象和方法
1.1 对象 收集2016年2月至2019年5月在嘉兴市妇幼保健院生殖中心接受体外受精-胚胎移植治疗患者的525枚未成熟卵母细胞进行IVM;同时收集周期中正常成熟卵母细胞207枚,进行体外培养。IVM成熟卵细胞及正常成熟卵细胞均行卵细胞浆内单精子注射(intracytoplasmic sperm injection,ICSI),受精所用精子均来自患者丈夫,受精后的胚胎在TLI系统中观测培养。排除艾滋、梅毒、乙型病毒性肝炎抗原阳性患者。本研究经医院医学伦理委员会批准,所有纳入对象均签署知情同意书。
1.2 方法
1.2.1 IVM培养液准备 G-2 plus胚胎培养液(瑞典Vitrolife公司),75 U/L促卵泡生成素和150 U/L人绒毛膜促性腺激素(瑞士 Serono公司),0.2 μg/ml 17β-雌二醇(美国Sigma公司)。
1.2.2 未成熟卵母细胞收集和培养 患者按本中心常规方案进行促排卵,在阴道超声引导下取卵。ICSI前拆除卵母细胞周围的大部分颗粒细胞,经倒置显微镜观察卵母细胞的成熟程度,未成熟卵母细胞(GV期或MI期)为本研究观察对象。将未成熟卵母细胞移入IVM培养皿中培养24~40 h,如果卵细胞成熟则行ICSI,受精卵在TLI观测下培养。
1.2.3 TLI使用和胚胎培养 研究使用Primo Vision(瑞典 Vitrolife公司)的TLI,图像采集1次/5 min,共连续培养6 d。所有胚胎均采用9孔培养皿(瑞典Vitrolife公司),卵裂期胚胎培养液为37℃6% CO2平衡过夜的G-1 plus胚胎培养液(瑞典Vitrolife公司)。囊胚培养为37℃ 6% CO2平衡过夜的G-2 plus胚胎培养液(瑞典Vitrolife公司)培养液,培养过程中均有Primo Vision成像系统采集图像,并作胚胎发育的时间参数与卵裂模式分析。
1.2.4 胚胎发育时间参数和卵裂模式设定 将ICSI受精时间记为“0”点,原核消失时间标记为PND(pronuclear disappearance),发育至2细胞时间为 t2,发育至3细胞时间为t3,以此类推为 t4、t5。2细胞发育至 3细胞所需时间为cc2,3细胞发育至4细胞所需时间为 s2。各时间点的命名方法参照Ciray标准。胚胎的卵裂模式包括正常卵裂及异常卵裂,其中异常卵裂模式包括不均、非轴性卵裂、大碎片、非二倍性卵裂、发育阻滞、非对称卵裂、卵裂球碎裂及卵裂球融合。
1.2.5 胚胎评估标准 卵裂期胚胎评估参考 Peter标准,囊胚期胚胎评估参考Gardner标准。优质胚胎:细胞数7~12个,碎片≤20%;D3可利用胚胎:细胞数≥4个,碎片≤30%。
1.3 统计学处理 采用SPSS 25.0统计软件。计数资料以频数和构成比表示,组间比较采用χ2检验。用四分位数法对时间参数进行分类分析,以囊胚形成率为结局,计算各参数的优势时间段。采用logistic回归分析时间参数与囊胚形成率的关系。P<0.05为差异有统计学意义。
2 结果
2.1 IVM胚胎与正常胚胎培养结果比较 402枚未成熟卵母细胞进行IVM,共有315枚成熟,成熟率为78.4%;该315枚成熟卵细胞进行ICSI后进一步行TLI动态观察及囊胚培养。IVM胚胎D3可利用胚胎率、D3优胚率、囊胚形成率均低于正常胚胎(均 P<0.05),非二倍性卵裂率大于正常胚胎(P<0.05),见表1。
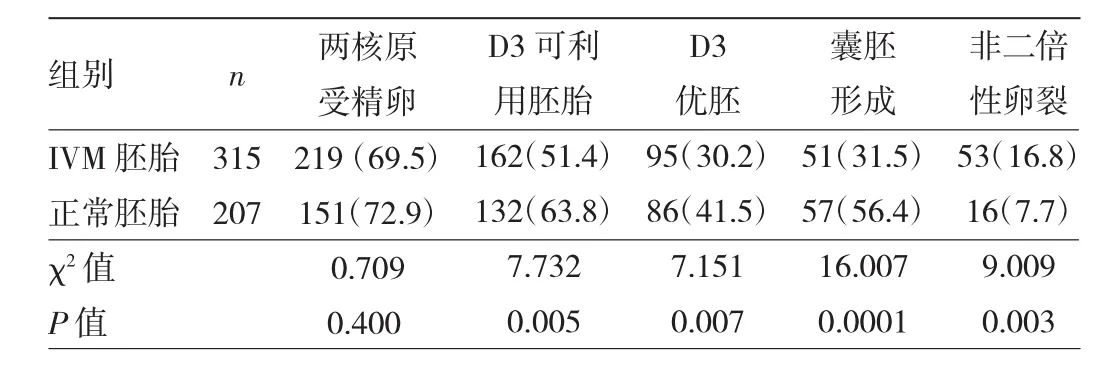
表1 IVM胚胎与正常胚胎培养结果比较[例(%)]
2.2 时间参数与胚胎发育潜能的关系 用四分位数法对 IVM 胚胎各时间参数(PND、t2、t3、t4、t5、cc2 和 s2)进行分段统计,根据时间参数各段的囊胚形成率,将连续2段拥有囊胚形成率的时间定义为该时间参数的优势时间段。优势时间段:PND 为(18.08~25.25)h,t2 为(20.74~27.89)h;t3 为<29.75 h,(29.75~36.36)h;t4为<31.97 h,(31.97~37.53)h,t5 为 (37.50~52.68)h,cc2 为(5.05~12.02)h,s2 为≥1.03 h,见表 2。通过 logistic回归分析,显示 t5(OR=1.029,95% CI:1.011~1.048)与形成囊胚最具相关性,见表3。
2.3 t5优势时间段内胚胎的囊胚形成能力验证结果 用后期收集的123枚未成熟卵母细胞形成的IVM胚胎时间参数与囊胚形成率的关系验证t5的预测价值。123枚未成熟卵细胞经IVM成熟92枚,受精后得到D3可移植胚胎43枚,经囊胚培养形成13枚囊胚,其中在t5优势时间段内D3可移植胚胎15枚形成囊胚9枚,囊胚形成率为60.0%,显著高于非t5优势时间段内囊胚形成率为14.3%(P<0.05),证实t5优势时间段具有预测性。
3 讨论
人类辅助生殖技术的成功目标是获得健康的胎儿,对于难治性多囊卵巢综合征不孕和诱导排卵周期中卵巢的反应不良的患者,IVM技术是治疗此类患者最为有效的措施。但IVM后卵母细胞形成胚胎发育能力较差的问题始终困扰着大家,胚胎发育是一个连续的动态过程,胚胎发育过程中任何非时间顺序相关的不正常事件都会导致胚胎发育异常,如胚胎直接从1细胞卵裂为3细胞、卵裂球多核化、胚胎空泡化、碎片化等。TLI技术对胚胎不间断地连续观察,可连续获取胚胎发育全过程的动态影像,可对胚胎发育进行更加全面和细致的记录。以上所提到的异常事件及与胚胎发育潜能密切相关的生物学特征,如原核的形成及消失、卵裂时间等都可以帮助胚胎学家对胚胎发育有更深的理解,通过对胚胎发育相关时间参数的分析,可以更好的预测发育潜能高的胚胎。本研究中通过TLI对胚胎发育进行动态观察,将胚胎的卵裂模式及时间参数相结合,筛选发育潜能更高的胚胎进行移植,提高IVM后胚胎移植的临床妊娠率。
正常体外受精周期中,胚胎发育中异常卵裂事件中非二倍性卵裂胚胎的囊胚形成率和种植率都非常低,Athayde等[10]报道其囊胚形成率为11.7%,种植率更低只有3.7%,非二倍性卵裂胚胎发育潜能差可能与其具有较高的染色体异常发生率有关[11]。IVM卵细胞的成熟包括细胞核成熟和细胞质成熟,它受多种因素影响,如培养时间、激素、颗粒细胞等,有研究发现适当延长IVM时间可促进卵母细胞的成熟过程,提高卵母细胞的核成熟率,促性腺激素可促进未成熟卵母细胞核和细胞质的成熟,利于胚胎的后期发育[12]。未成熟卵母细胞在不成熟的IVM培养条件下,受各种因素影响,其细胞核和细胞质的成熟肯定不如体内成熟的卵细胞同步,因此其细胞核发育异常的可能性高于体内成熟的卵细胞。本研究结果发现在IVM胚胎非二倍性卵裂胚胎发生率为正常胚胎的2倍多,笔者认为这可能与IVM卵细胞核成熟异常有关,另外胚胎发育停滞的发生率也高于正常胚胎,这可能同样与IVM卵细胞核成熟异常有关。Qi等[13]报道胚胎发育停滞往往伴有染色体异常,这从侧面证实了笔者的推测。

表2 四分位数法分析囊胚形成情况

表3 logistic回归分析时间参数与胚胎发育潜能的关系
人类的合子基因组激活发生4~8细胞阶段,基因组的激活对桑椹胚、囊胚至关重要,因此笔者推测4~8细胞阶段的时间参数对预测胚胎发育潜能至关重要。在本研究中通过对IVM后卵母细胞胚胎时间参数与是否形成囊胚作单因素和多因素logistic回归分析,发现t5与胚胎发育潜能最具相关性。另有研究同样表明t5可以作为胚胎发育潜能的预测性参数[4,14]。Meseguer等[15]对285例ICSI周期患者胚胎的卵裂时间、卵裂球大小和多核等作了详细的回顾性分析,总共移植了522枚胚胎,结果显示 t5(ICSI后 48.8~56.6 h)、s2(≤0.76 h)、cc2(≤11.9 h)这三个时间参数可以作为囊胚形成潜能的预测性参数。因此如果筛选t5优势时间段内的胚胎在发育第3天进行移植,能加大获得妊娠的可能性。但由于各中心的促排卵方案、培养环境及人员操作等差异可能造成各中心提取的共性参数有所不同。因此,各生殖中心应该根据自己最适合的共性参数挑选优质胚胎进行移植。

