基于非靶向代谢组学分析放牧与舍饲条件下彭波半细毛羊代谢特征
田发益,刘贵芳,武俊喜
(1.西藏农牧学院 生物技术中心,西藏 林芝 860000;2.中国科学院 地理科学与资源研究所 生态系统网络观测与模拟重点实验室,北京 100101)
藏系绵羊是西藏畜牧业的主要支柱,也是特殊地域长期自然选择的习服动物。在长期自然选择和适应进化下,形成了耐粗饲、适应性强、抗缺氧的特殊体能。据2018年西藏统计年鉴资料统计[1],2017年,西藏全年羊存栏数1 087万只,绵羊存栏数700万只。全年羊总体出栏数397.19万只,年出栏率35.14%。同时,项目组对西藏羊的体质量进行统计分析,发现1岁以上茨盖母羊平均体质量(25.7±2.2)kg,2岁以上西藏母绵羊平均体质量(26.0±1.6)kg,2岁以上西藏公绵羊平均体质量(38.2±0.6)kg。藏系绵羊的出栏时间一般为2年或2年以上,饲草转化率低,生产性能低下。
彭波半细毛羊是20世纪90年代利用当地藏羊为母本,新疆细毛羊、茨盖半细毛羊为父本进行级进杂交,再导入适量茨盖半细毛羊血液后,横交固定、培育的毛肉兼用半细毛羊新品种。彭波半细毛羊主要饲养于拉萨地区林周县。据2019林周县统计,全县现有彭波半细毛羊存栏总数4.3万只,其生产性能优于藏系绵羊,适应高原环境的一个培育品种。
现代养殖业中,精准配方和精准补饲是养殖业的关键。代谢组学提供了研究的新方法,通过分析和判断羊饲养过程中养分变化对机体代谢的影响程度,调整补饲料或优化配方,以提高养殖效率,减少代谢性疾病的发生。代谢组学主要研究小分子代谢物整体数量、种类及变化规律[2]。研究方法一般有LC-MS、GC-MS和NMR,分析的代谢产物一般为小分子物(MW<1 000),并将该变化特征与代谢通路和生物学事件或过程相联系(常用的数据库有HMDB、KEGG、UMBBD、Biocyc、Metacye、Lipid Search、BioSilico和Metcore等)[3],分析其机理和代谢特征。营养代谢组学可以定量、大范围地研究有机体营养调控时出现的动态代谢应答,可准确和深入地掌握营养、环境等因素与生产性能间产生的相互作用。
试验通过非靶向代谢组学法,分析放牧环境和全舍饲环境下,彭波半细毛羊血清中代谢物的差异情况,分析这些代谢物与之关联的代谢通路,找出原因,进行饲草料合理搭配和补饲,扶正各代谢通路,提高羊的养殖效率。
1 材料与方法
1.1 试验设计、饲养管理试验用彭波半细毛羊均来自于西藏自治区拉萨市林周县白朗村养羊合作社。研究区拉萨市林周县白朗村(N29°50′~E91°5′)是西藏河谷地带典型的半农半牧村,属于高原温带季风半干旱气候区,年平均气温在2.4~8.2℃,年降雨量300 ~500 mm,集中在6-9月份,日温差较大。白朗村天然草地占该村总面积的80%以上。白朗村养羊合作社共饲养600多只羊,属科研院所与村合作示范基地。舍饲组和放牧组各选用2岁左右的母羊10只,平均体质量为(23.77±2.34) kg,每组2个重复,每个重复5只。
放牧组,采用西藏常规全天放牧方式,每天晚上羊群混喂约50 g/只玉米粉和适量盐。
舍饲组,饲用饲料为课题组研发的全价TMR“草饼干”(表1),TMR“草饼干”规格为32 mm×32 mm 的长方体,且固化成型,长短从3 ~5 cm不等。每只羊每天按规定分2次饲喂,总量为1.43 kg,根据采食情况,上下20%左右浮动,自由饮水。
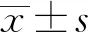
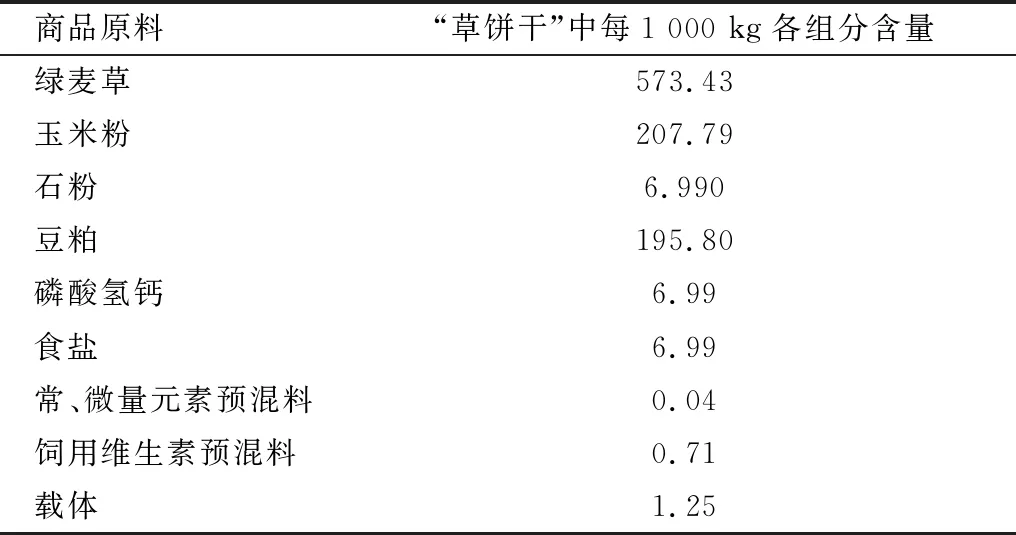
表1 “草饼干”主要养分含量 kg
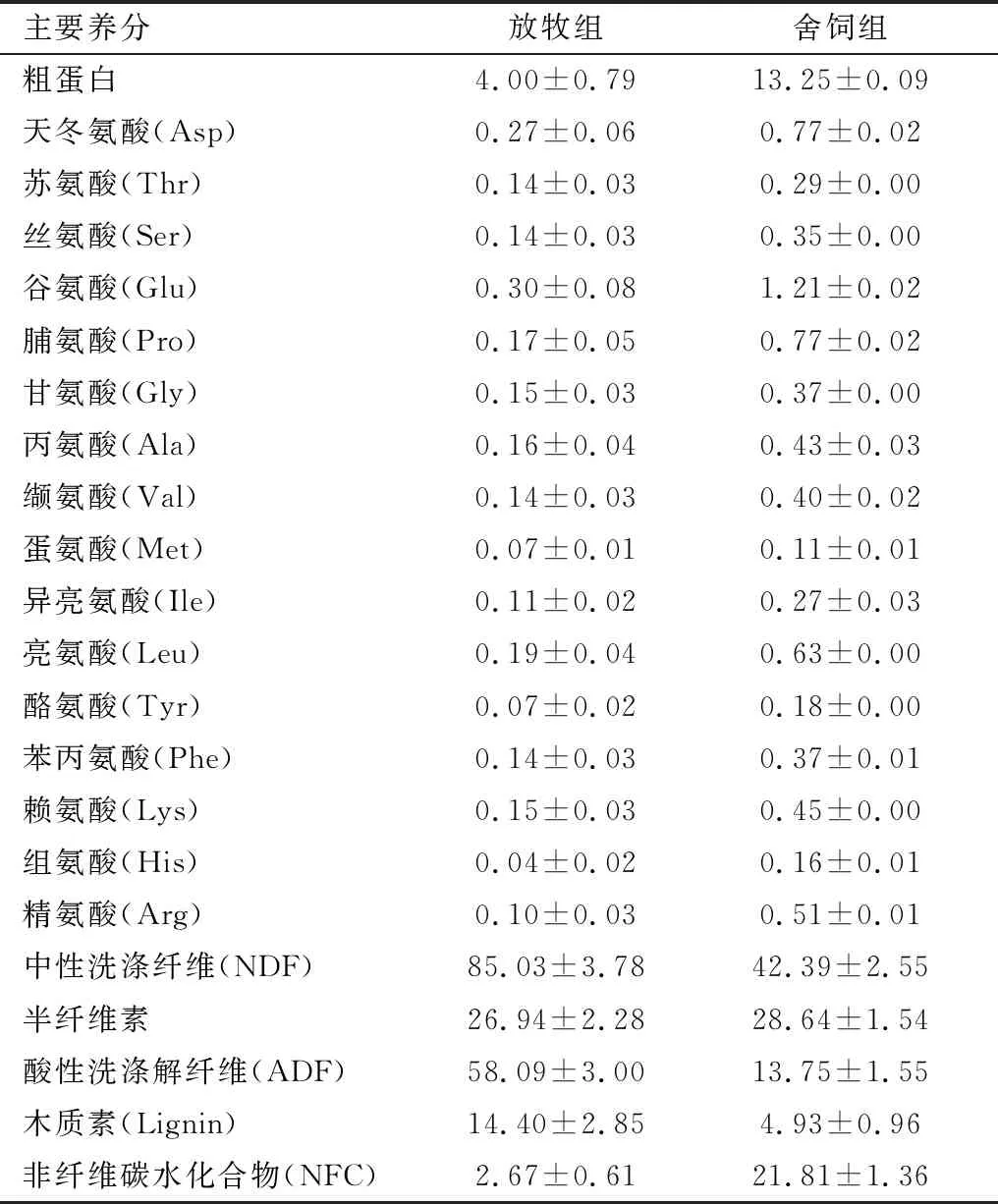
表2 舍饲组和放牧组饲草中主要养分含量(风干物质基础) %
1.2 仪器与试剂正缬氨酸、正亮氨酸、甲醇、N,O-双(三甲基硅)三氟乙酰胺(含1%三甲基氯硅烷)、甲氧胺盐酸盐和无水吡淀均购自西格玛奥德里奇公司。
1.3 试验羊血清采集试验始于2018年青藏高原牧草发青季6月份,严格按要求进行饲喂5个月后进行采样分析。采样时,放牧组和舍饲组各随机选取2个重复中的彭波半细毛羊5只,于饲喂前或放牧前,抽取羊颈静脉血,1 000×g离心15 min,抽取血清,速置于干冰环境下贮存。样品于当天由铁路送往青海西宁,再从西宁托运至上海派森诺生物科技有限公司进行非靶向代谢组学测定分析。
1.4 样品处理代谢物提取与衍生物制备:于冰水浴解冻血清样本,涡旋振荡,取100 μL与400 μL冰冷甲醇(含内标5 mg/L的正亮氨酸)混合,涡旋振荡60 s,-20℃静置过夜,4℃ 14 000×g离心15 min。取70 μL上清液,在氮气下挥干。向干燥物中加入50 μL 20 mg/L盐酸甲氧胺吡啶溶液,涡旋振荡30 s,37℃孵育90 min。加入50 μL BSTFA (含1% TMCS),70℃衍生60 min,得到三甲基硅烷化衍生血清样本。按QC样本制备方法,从所有血清样本中取相同体积样本混合并等分,并在每批样本分析测试时按相同方法制备和分析QC样本。
1.5 GC-MS检测GC-MS设定:载气为高纯(纯度大于99.999%)氦气,流速1 mL/min。采用梯度升温程序对样本进行分离分析。梯度升温程序为:起始60℃维持1 min,以15℃/min升到240℃,继续以40℃/min升至320℃并维持4 min。以无分流模式进样1 μL,溶剂延迟时间设定为5.4 min。进样口、传输线和电子碰撞(EI)电离源温度分别设定为250,260,230℃。EI能量设定为70 eV。采用全扫描方式对质荷比(m/z)范围为50~600的数据进行采集。
1.6 数据处理和统计分析对GC-MS原始数据进行变量(保留时间-质荷比)和积分面积的Excel数据文件,再对Excel中峰面积数据进行面积百分比归一化处理。得到数据文件导入到瑞典Umetrics AB公司SIMCA软件(版本14.1)进行多维统计分析如主成分分析(PCA)、偏最小二乘方-判别分析(PLS-DA)和正交过滤偏最小二乘方-判别分析(OPLS-DA)。分析前首先对数据进行默认的平均中心化(mean-centered)和UV(unit variance)格式化处理,然后自动计算最优主成分数和建立最优模型。为了避免模型过拟合,采用SIMCA软件默认的7-循环交叉验证计算主成分的最优数。模型质量评价参数为R2X或R2Y和Q2值。
结合OPLS-DA模型的变量投影重要性(Variable importance in the projection,VIP)>1和单维统计分析的P<0.05相结合的方法筛选差异性代谢物。倍数变化(Log2FC)计算方法为放牧组(T组)和舍饲组(X组)两组数据均值之比的对数(以2为底),正值表示该物质在T组中的水平高于X组,负值则相反。
用模型质量参数R2X(X模型的解释率),R2Y(Y观察量即组间差异的解释率),Q2(预测率)来表示模型质量,一般来说,值大于0.5,即表示模型质量较好。由SIMCA-P(14.1版本)自动进行模型构建,当模型过拟合时,不再计算新主成分,此时的所有主成分就是有效的主成分,建立的模型即为有效模型(非过拟合的)。
2 结果
2.1 代谢物的差异性分析采用 OPLS-DA模型第一主成分的VIP值(阈值>1)结合单维检验的P值(阈值<0.05)寻找差异性表达代谢物。本试验共筛选并定性到24个差异性物质,其中13个物质下降,11个物质上升。差异性代谢物数据如表3所示(P<0.05)。Log2FC(T/X)正值,表示X组饲代谢物浓度>T组;若为负值,则表示T组代谢物浓度>X组。VIP值即变量投影重要性,从OPLS-DA模型获得。Log2 FC为倍数变化值,T和X组归一化的峰面积均值之比的对数值(以2为底),正号表示该物质在T组中的平均信号响应值或浓度值大于X组,负号则表示该物质在T组中的平均信号响应值或浓度值小于X组。

表3 T和X组差异性代谢物
2.2 对比和检验分析主成分分析(PCA)见图1A。采用SIMCA(版本14.1)软件对彭波半细毛羊血清样本进行主成分分析,建立含3个有效主成分的PCA模型,模型累积解释率R2X=0.627。一般来说,R2X>0.5表示该模型可靠。血清PCA得分如图1所示:横坐标表示第1主成分即PC1,用t[1]表示;纵坐标表示第2主成分即PC2,用t[2]表示。PCA得分图显示T与X组分别分布于得分图的上方和下方,证明两组之间有分离,说明T和X组样本之间有代谢差异。
偏最小二乘方-判别分析(PLS-DA)见图1B。本项目建立含2个有效主成分的PLS-DA模型,R2X=0.283,R2Y=0.926,Q2=0.071 6。对模型的参数值(看R2Y和Q2值)进行分析,表明当前模型可靠。置换检验(Permutation test,图1D)表明当前模型质量较差(Q2最右侧点Y轴值小于大多数左侧点的Y轴值)。因PLS-DA是监督性方法,模型必须非过拟合才有效,Permutation test主要用于检测表征模型是否过拟合。本项目结果表明当前的PLS-DA模型不存在过拟合现象(即零假设不成立),Q2斜线与Y轴切割点值小于0表示当前模型非过拟合,本试验值为-0.030 6,因此PLS-DA模型有效。
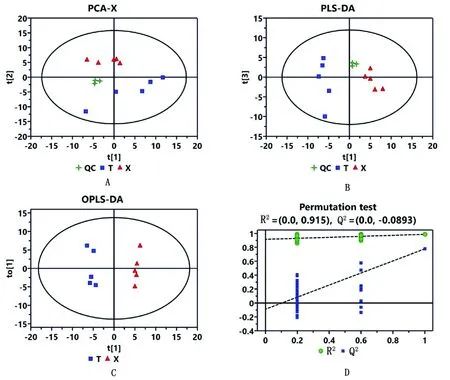
图1 样本和QC样本得分图 A.主成分分析;B.偏最小二乘方-判别分析PLS-DA;C.偏最小二乘方-判别分析OPLS-DA;D.置换检验
正交偏最小二乘方-判别分析(OPLS-DA)(图1C)。采用SIMCA(版本14.1)软件对样本自动建立含1个主成分和1个正交成分的OPLS-DA模型,模型主要质量参数为R2X=0.479,R2Y=0.987,Q2=0.889,表明当前模型可对T组和X组两组样本进行有效区分。
2.3 相关性矩阵与热图分析为了表征各差异性代谢物之间的(浓度)相关性,对这些代谢物的定量信息进行皮尔森相关性(Pearson Correlation)分析(基于R平台,版本3.3.0),如图2所示,每一行和每一列都表示差异性代谢物,方块大小和颜色深浅跟差异性代谢物之间的相关性有关。红色表示差异性代谢物之间呈正相关,绿色表示差异性代谢物之间呈负相关。颜色越深,方块越大,相关性越大。
为了表示两组样本的差异性代谢物之间的关系,对这些代谢物差异性物质的定量信息进行heatmap分析(R平台,版本3.3.0),如图3所示,每行表示差异性代谢物,每列表示样本编号,左侧的树状结构表示差异性代谢物之间相似度聚类关系。红色表示差异性代谢物在样本中的浓度是上升的,绿色表示差异性代谢物在样本中的浓度是下降的。
2.4 KEGG通路分析通过对代谢物元素和代谢通路进行联系(表4),并对某一代谢通路中涉及的代谢物进行统计分析,即通过原数据的差异显著性分析(RawP),共发现有8类代谢通路在T和X组间表达差异显著(P<0.05);采用Holm-Bonferroni法分析,即两两差异性比对的形式,发现仅有缬氨酸(Valine)、亮氨酸(leucine)和异亮氨酸(isoleucine)生物合成代谢通路差异显著。采用FDR分析,两组间差异显著的也为缬氨酸、亮氨酸和异亮氨酸生物合成代谢通路。采用通路拓扑分析计算分析,影响两组的代谢通路仍为缬氨酸、亮氨酸和异亮氨酸生物合成代谢通路。
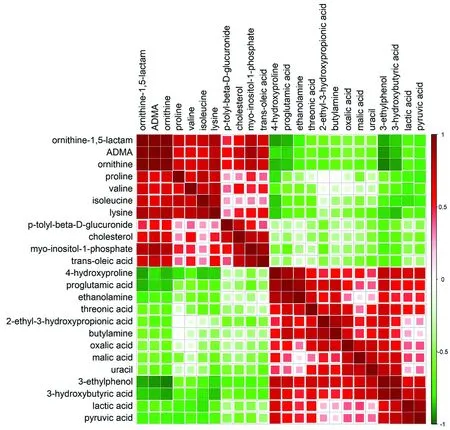
图2 T和X组差异性代谢物的相关性矩阵图

表4 T和X组的代谢通路差异性结果
采用在线软件Metabo Analyst(版本4.0 http://www.metaboanalyst.ca/)对差异性代谢物进行代谢途径分析,代谢组学绘图(图4)。图4中体现显著变化的代谢通路。由于羊代谢涉及到肠道菌群,故必需氨基酸合成途径也包含在内。纵坐标P表示代谢通路富集分析中该通路中代谢物与分类不相关的可能性,P值越大表示该途径代谢物与分类相关的可能性越小,P值越小表示该途径代谢物与两组相关的可能性越大。为了便于绘图的直观效果,纵坐标用其对数的负数表示,因此,P越小,-log(P) 越大。图中,纵坐标越大的点表示该通路与分组越相关。颜色越红相关性越大。横坐标(pathway impact value)值基于路径拓扑分析,表示该通路对放牧组与舍饲组差异发生的重要性,圆圈越大,重要性越大。
从表5可知,T和X组中,因饲草料的变化而影响的代谢通路主要有:缬氨酸、亮氨酸和异亮氨酸的生物合成,精氨酸和脯氨酸代谢,丙酮酸代谢,糖酵解和糖质新生。这些代谢通路中,主要涉及氨基酸代谢和能量代谢。

图4 T和X组差异性代谢途径富集分析

表5 T与X组间差异性代谢产物参与的代谢通路
3 讨论
3.1 缬氨酸、亮氨酸和异亮氨酸生物合成(支链氨基酸)缬氨酸、亮氨酸和异亮氨酸在疏水脂质链上都具有分支的甲基集团[4]。在本次试验中,根据KEGG数据库检索分析,与支链氨基酸代谢相关的代谢物有3种,两个测试组中差异显著,这些代谢物为丙酮酸、异亮氨酸和缬氨酸。丙酮酸是糖酵解的产物,血液中乳酸与丙酮酸具有一定的比例,经测定,血清中的比例约为4∶1(血清及血清蛋白)。支链氨基酸生物合成途径中有4个公共酶系,分别为乙酰羟酸合成酶AHAS、乙酰羟酸异构还原酶AHAIR、二羟酸脱水酶DHAD和支链氨基酸转氨酶TAs及各自独特的合成酶系[5]。放牧组中缬氨酸和异量亮酸均显著高于舍饲组,但丙酮酸含量舍饲组高于放牧组。支链氨基酸的合成是一系列酶相互作用的结果,受许多因素的反馈抑制。支链氨基酸在细胞内外差别特别大,血清中过量的支链氨基酸进入细胞内,对细胞产生毒害作用,影响整体的发酵产酸水平[6]。说明适当的蛋白饲料水平可促进糖酵解和降低支链氨基酸进入细胞内对细胞的伤害,同时适当的氨基酸比例有利于机体自身蛋白质的合成。
3.2 氨酰tRNA生物合成本研究结果显示影响氨酰tRNA生物合成的代谢物主要有赖氨酸、异亮氨酸、缬氨酸和脯氨酸4种,放牧组均显著高于舍饲组。氨酰tRNA的合成,受氨酰tRNA合成酶(aminoacyl-tRNA synthetases,aaRS)作为催化特定氨基酸与tRNA结合的关键酶,通过催化氨基酸与相应tRNA的氨酰化,以保证遗传信息翻译的准确性,在生物体内具有重要作用[7]。aaRS对不同底物的选择性以及催化方式都存在较大差别[8],但催化反应在本质上是一致的[9],不合理的氨基酸比例或抑制剂对蛋白质的形成是有影响的。此4类氨基酸在放牧组羊血清中的高含量,说明其他氨基酸的摄入量不足,很大程度上也影响了细胞合成自身蛋白的翻译能力;另一方面,也说明此4类氨基酸的摄入量足够或通过瘤胃微生物的转化量足量,可在进行饲料补饲过程适当减少添加量。
3.3 泛酸盐和CoA生物合成CoA是体内70多种酶反应通路的辅助因子,是体内重要的酰基载体,主要是参与糖代谢、脂肪酸合成与氧化、血红素的合成、丙酮酸的降解、氨基酸分解代谢、乙酰胆碱合成与乙酰化等反应过程[10-11]。缬氨酸含量的升高(放牧组),说明泛酸盐和CoA的生物合成受到影响,即能量和物质的累积也受到了影响,影响泛酸盐和CoA生物合成的主要代谢物有缬氨酸和尿嘧淀,放牧组血清中缬氨酸含量高于舍饲组,而舍饲组尿嘧淀含量较高于放牧组。尽管尿嘧淀舍饲组中的含量(0.548 8±0.057 0)mmol/L相对于放牧(0.480 5±0.020 0)mmol/L较高,但值差异不大,不影响泛酸盐和CoA的生物合成。说明合理的蛋白饲料,有利于营养物质的沉积,加速物质的新陈代谢。
3.4 精氨酸和脯氨酸代谢检测中发现影响精氨酸和脯氨酸代谢的物质主要有脯氨酸、丙酮酸和鸟氨酸3种。小肠是精氨酸和脯氨酸合成的重要场所。精氨酸、脯氨酸和谷氨酰胺同属于精氨酸家族氨基酸,在动物机体内可相互转化,上述氨基酸及其代谢产物在机体内可发挥多种生理功能[12]。精氨酸是调控脂肪酸氧化分解为水和CO2的关键基因表达,加速脂肪代谢,促进脂肪分解[13]。同时,精氨酸代谢产生的鸟氨酸会转化成多胺和NO。多胺(腐胺、亚精胺、精胺、尸胺)是一类普遍存在的阳离子胺,参与包括胃肠道在内的多种组织的细胞增殖和分化[14]。脯氨酸和鸟氨酸在放牧组血清总含量较高,说明精氨酸和脯氨酸代谢通路中,某一反应酶或底物受到抑制,或此反应体系中某些反应底物的不足。精氨酸和脯氨酸平衡的打破,影响了肠道上皮的正常功能,也会弱化部分信号传导和代谢的正常进行。
3.5 丁酸甲酯代谢放牧与舍饲组变异较大的代谢物有2种,分别为丙酮酸和3-羟基丁酸,均表现为舍饲组高于放牧组。3-羟基丁酸是脂肪降解旁路过程中形成丁酸甲酯的中间产物,与丙氨酸、天冬氨酸、谷氨酸、精氨酸和脯氨酸转化为丁酸甲酯相关,同时也与维生素B6代谢相关,降解产物为酮体、丁烷、丙酮酸盐、丁醇等产物。β-羟基-β-丁酸甲酯(HMB) 是亮氨酸的代谢中间产物,可调控肌肉蛋白质的合成和分解代谢,并能维持细胞膜的完整性[15]。说明舍饲羊随着脂肪的沉积和高蛋白的摄入,这些物质的分解供能也在不断加强。
3.6 丙酮酸代谢和糖酵解和糖质新生代谢在丙酮酸代谢和醣酵解与糖异生代谢通路中,舍饲组乳酸和丙酮酸盐含量均高于放牧组。丙酮酸是糖酵解的最终产物,在机体的胞浆中还原成乳酸,在线粒体内生成乙酰CoA,再进行三羧酸循环。因此,丙酮酸通过乙酰CoA和三羧酸循环实现3大营养物质之间的相互转化,是重要的代谢产物。乙酰辅酶A(acetyl-A)是一种别构剂,是激活糖异生的丙酮酸羧化酶,抑制糖有氧氧化中丙酮酸脱氢酶复合体的活性,促进糖异生作用[16]。当机体能量足够时,三羧酸循环被抑制,CoA堆积,抑制了丙酮酸脱氢酶复合体的活性。同时,丙酮酸羧化酶被激活,加速了糖异生过程,多余的丙酮酸生成葡萄糖[17]。健康动物机体中的乳酸堆积一般有过劳运动、消化道摄取等。但当能量供应充足,糖酵解速率超过有氧氧化速率,或糖异生受阻等因素,会在体内堆积过量乳酸。结果可知,在舍饲组中加入过多的能量饲料,不利于羊的饲料转化,造成家畜代谢障碍。
3.7 谷胱甘肽代谢γ-谷氨酰基循环完成GSH和谷氨酸的相互转换,而γ-氨基丁酸是一种重要的神经递质,由L-谷氨酸脱羧而产生。谷胱甘肽(GSH)存在于几乎身体的每一个细胞,其半胱氨酸上的巯基为其活性基团(-SH)。GSH具有解毒、参与生物转化和保持正常的免疫系统的功能。因此,谷氨酸受体根据其生化属性及功能被分为两种类型—代谢型和离子型[18]。代谢型谷氨酸受体属于G蛋白偶联受体(G protein-coupled receptors,GPCRs),影响许多细胞内参与调控神经兴奋、突触形成及神经变性的第二信使系统。同时,代谢型谷氨酸受体也是中枢神经系统疾病的病理标志之一[19]。但舍饲组中多聚谷氨酸含量的升高,不代表病理反应,其机理还不清楚。
分析中,影响谷胱甘肽代谢的代谢物主要有多聚谷氨酸,舍饲组显著高于放牧组;鸟氨酸在放牧组体内显著高于舍饲组。精氨酸酶催化,水解生成尿素和鸟氨酸[20]。鸟氨酸的代谢产物,多胺广泛参与体细胞的增殖、分化、凋亡等重要的生理过程。体内多胺的合成、降解及摄取均受到严格调控,当多胺的代谢出现紊乱,相继会引起多种病疾[21-23]。从放牧组血清中鸟氨酸含量的相对堆积,可能会引起调节因子多胺的分泌量不足,不利于家畜的生长发育。
本研究通过对西藏彭波半细毛羊血清非靶向代谢组学的研究,自然状态放牧组和舍饲组存在主要差异的代谢通路有:放牧组代谢物堆积引起的缬氨酸、亮氨酸和异亮氨酸生物合成、氨酰tRNA生物合成、泛酸盐和CoA生物合成、精氨酸和脯氨酸循环代谢出现阻滞或障碍,影响机体蛋白质合成。舍饲组中因能量饲料供给过剩,出现丁酸甲酯代谢、丙酮酸代谢和醣酵解与糖异生代谢循环中的代谢物堆积,在饲料配方中,应降低能量饲料的比例。谷胱甘肽代谢通路中,放牧组鸟氨酸血清含量极高,鸟氨酸代谢会产生多胺等神经递质,鸟氨酸代谢紊乱,影响体细胞的增殖、分化、凋亡等重要的生理过程。

