黔北麻羊CTSB、CTSD基因的克隆、生物信息学分析及在不同组织中的表达
周志楠,陈 祥,敖 叶,洪 磊,韦仕南
(1.贵州大学 动物科学学院 高原山地动物遗传育种与繁殖教育部重点实验室/贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025)
组织蛋白酶(cathepsin,CTS)是一种主要定位于溶酶体中的酶类,参与人体和动物的各种生理代谢过程,并被广泛应用于各个生物领域[1]。根据蛋白酶水解机制,主要分为半胱氨酸蛋白酶(cysteine protease)、丝氨酸蛋白酶(serine protease)和天冬氨酸蛋白酶(aspartic protease)等几个大类[2]。
其中,组织蛋白酶B(cathepsin B,CTSB)由组织蛋白酶B1和B2构成,从肝脏溶酶体中分离得到,是一种半胱氨酸蛋白酶。在细胞内蛋白质分解代谢中起重要作用,也可能涉及抗原加工等其他生理过程[3],还有证据表明CTSB与一些慢性疾病与癌症有关[4]。其结构最早在鼠中被确定[5],但随着研究的深入,发现其mRNA也在不同动物的卵巢、肝脏、脑、脂肪和子宫等多个组织中广泛表达,近期研究显示CTSB能对卵巢的发育起到促进作用,并可以提高卵母细胞和卵丘细胞体外成熟的质量[6]。组织蛋白酶D(cathepsin D,CTSD)是研究最为广泛的组织蛋白酶之一,隶属于天冬氨酸蛋白酶,1958年首次在鱼肌中被发现[7]。它是一种酸性的组织蛋白酶,在细胞凋亡、卵巢的生长发育等生理过程中也具有十分重要的作用[8-9]。此外CTSD还被证实与癌症等疾病密切相关[10]。同时,还有研究发现CTSD基因能在猪卵巢颗粒细胞、间质细胞、人体组织、鸡乳、猪脾和牛肝等多个细胞或组织中表达[11-12],其蛋白功能也最先在两栖动物中被发现[13],目前CTSB和CTSD基因已在多种动物中得到克隆和测序验证。
黔北麻羊主产于贵州北部的仁怀、习水两地,属短毛型皮肉兼用山羊,是当地优良品种,具有耐粗饲、抗病力强、适应性广和繁殖力高等特点。于2009年获批为新遗传资源,具有重要的研究价值和发展潜力。近年来黔北麻羊的研究集中在肉质、生长性能、繁殖性状与基因多态、表达等方面[14-16],但有关组织蛋白酶在黔北麻羊上的克隆与表达研究尚未见报道。本研究通过qRT-PCR技术检测分析CTSB、CTSD基因在单、多羔黔北麻羊不同组织中的表达差异,克隆出黔北麻羊CTSB、CTSD基因完整的编码序列进行生物信息学分析,以期为后续进一步探讨CTSB、CTSD基因功能奠定基础。
1 材料与方法
1.1 试验材料黔北麻羊由贵州省习水县富兴牧业有限公司提供,分别选取成年产单羔、多羔的黔北麻羊母羊进行屠宰并放血,黔北麻羊屠宰方法及其注意事项依据贵州省地方标准《羊屠宰操作规程》(DB22/T 2740-2017)进行,屠宰前准备液氮、酒精棉球、带线圈沙袋、乳胶手套、一次性塑料手套、口罩、121℃高温高压灭菌后的剪刀、镊子与锡箔纸,屠宰后分别采集产单羔、多羔黔北麻羊母羊的下丘脑、垂体、子宫、输卵管和卵巢5个性腺组织,共10份组织样品并使用灭菌的锡箔纸包住采集的组织后贴好标签置于液氮中运回实验室,转移至-80℃冰箱进行保存。
1.2 试验试剂TRIzol@Reagent RNA提取试剂盒、荧光定量试剂UltraSYBR Mixture、胶回收试剂盒购自康为世纪生物科技有限公司(北京);StarScript Ⅱ逆转录试剂盒(Genstar,美国);液氮(-196℃)、三氯甲烷、0.5% TAE缓冲液、异丙醇、75%乙醇、西班牙琼脂糖和氨苄青霉素(三水)均购自艾瑞特(鼎国)生物有限公司(贵州);pMD19-T克隆载体、DNA Marker购自宝生物工程有限公司(大连);T4DNA连接酶和LB Broth培养基购自生工生物工程技术服务有限公司(上海)。
1.3 引物的设计与合成根据NCBI-GenBank数据库中发布的山羊(goat) Capra hircus CTSB、CTSD基因mRNA外显子拼接序列(登录号:NM_001314245.1、XM_018043344.1);利用Primer Premier 5.064软件分别设计荧光定量引物、CDS区克隆扩增引物,引物序列、退火温度(表1)。以β-actin为内参基因。引物送至上海生工生物工程技术服务股份有限公司合成。

表1 引物详细信息
1.4 组织总RNA的提取与cDNA第1链的合成采用Trizol法提取组织总RNA,单、多羔黔北麻羊下丘脑、垂体、子宫、输卵管和卵巢等10个性腺组织样品总RNA提取后,采用2%琼脂糖凝胶电泳检测组织总RNA的纯度、特异性和完整性,使用超微量分光光度测定仪测定组织总RNA的浓度和纯度,观察光密度比值(D260/D280)以及图像是否合理,将峰图单一、曲线平滑、D260/D2800比值在1.8~2.0区间内的组织总RNA于-80℃冰箱中保存。用于后续逆转录试验。采用GenStar的StarScript Ⅱ First-strand cDNA试剂盒将提取的组织总RNA逆转录合成cDNA第1链。逆转录体系为20 μL,其中包括RNA模板1 μL、50 μmol/L Oligo dT Primer 1 μL、DEPC-ddH2O 7 μL、2× Reaction mix 10 μL、StarScript Ⅱ RT mix 1 μL。PCR反应条件为42℃孵育30~50 min,85℃孵育5 min,产物于-20℃ 冰箱保存。
1.5 实时荧光定量PCR以逆转录所得到的cDNA第1链为模板结合SYBR Green Ⅰ嵌合荧光法进行实时荧光定量PCR反应,检测产单、多羔黔北麻羊下丘脑、垂体、子宫、输卵管和卵巢等性腺组织中的表达差异。实时荧光定量PCR反应体系为20 μL,其中包括cDNA模板0.8 μL、2×Real Star Green Fast Mixture 10 μL、正向引物与反向引物(10 μmol/L)各0.8 μL、RNase-free H2O 7.6 μL。采用两步法PCR扩增标准程序进行实时荧光定量PCR反应,具体程序为:95℃预变性 2 min;95℃变性15 s,退火30 s,熔解曲线由机器自动设置(基础温度65℃,每5 s增加0.5℃扩增至95℃)(表1)。试验所得Cq值经过MS Office处理后利用相对定量法2-ΔΔCt=2-[(目的样品Ct-内参基因Ct)-(对照样品Ct-内参基因Ct)]计算目的基因CTSB、CTSD mRNA的相对表达量,使用SPSS 19.0软件对2-ΔΔCt相对定量法所得数据进行单因素方差分析(one-way ANOVA)与配对样本T检验,使用LSD法进行差异显著性检验,分别以P<0.05、P<0.01为差异显著性、极显著性判断标准。
1.6 PCR扩增黔北麻羊CTSB、CTSD基因CDS区以逆转录所得的cDNA第1链为模板对目的基因CTSB、CTSD的CDS区进行PCR扩增,PCR扩增体系为20 μL,其中2×Es Taq Master Mix 10 μL,上下游引物(10 μmol/L)各1 μL、cDNA第1链模板2 μL,补充ddH2O至20 μL。扩增程序为95℃预变性3 min;95℃变性30 s,引物退火45 s,72℃延伸30 s,30个循环;72℃终延伸 5 min。反应结束后将PCR产物置于4℃冰箱保存, 1.2%琼脂糖凝胶电泳检测PCR扩增产物是否有目的条带(表1)。
1.7 目的基因CTSB、CTSD的克隆将琼脂糖凝胶上的目的条带切割放入2 mL透明离心管中进行胶回收,按照北京康为世纪有限公司胶回收试剂盒说明书进行,采用超微量分光光度计检测胶回收产物浓度与纯度,并与pMD19-T载体进行连接反应(金属浴16℃,12 h),将连接产物转化至大肠杆菌感受态细胞DH5α,经涂板、37℃恒温箱过夜培养后,挑取白斑放入含氨苄青霉素的装有LB液体培养基的10 mL离心管中,37℃,200 r/min摇12~16 h,待菌液浑浊后立即进行菌液PCR反应,1%琼脂糖凝胶电泳检测菌液PCR产物;筛选目的条带正确的阳性菌液送至生工生物(上海)股份有限公司测序。
1.8 黔北麻羊CTSB、CTSD基因生物信息学分析测序结果经过DNAStar软件比对正确后,应用MegAlign软件对黔北麻羊CTSB、CTSD基因的编码序列进行同源性分析,分别应用在线ExPASy网站(https://web.expasy.org/protparam/)和ProtScale程序(https://web.expasy.org/protscale/)分析黔北麻羊CTSB、CTSD基因编码蛋白质的理化性质与疏水性;用在线软件SOPMA(http://npsapbil.ibcp.fr/cgi -bin/npsa_auto mat.pl?page=npsa_sopma.html)与SWISS-MODEL(www.swissmodel.expasy.org)程序预测CTSB、CTSD蛋白质的二、三级结构;利用PSORT Ⅱ Preadict(https://psort.hgc.jp/form2.html)软件对CTSB、CTSD蛋白进行亚细胞定位分析;利用SignalP 4.1 Sever(http://www.cbs.dtu.dk/services/SignalP-4.1)预测氨基酸序列的信号肽及剪切位点,最后利用MEGA6.0软件构建CTSB、CTSD基因编码的氨基酸序列在不同物种中的系统进化树。
2 结果
2.1 PCR扩增黔北麻羊CTSB、CTSD基因以逆转录合成的cDNA第1链为模板对CTSB、CTSD基因荧光定量引物与CDS区克隆引物进行扩增,1.5% 琼脂糖凝胶电泳检测PCR扩增目的基因CTSB(A)、CTSD(B)荧光定量产物,扩增出约为182和185 bp条带,与预测片段大小一致,且条带清晰、单一,无非特异性扩增、证明目的基因CTSB、CTSD荧光定量引物特异性良好,可用于下一步试验研究(图1A,B)。PCR扩增目的基因CDS区克隆产物 C、D可知,条带明亮,扩增出约为1 008和1 239 bp 大小的片段,与预测结果一致,可用于下一步试验研究(图1C,D)。
2.2 CTSB、CTSD基因在单、多羔黔北麻羊不同组织中的表达组内比较发现CTSB基因mRNA在单、多羔黔北麻羊的卵巢组织中的表达量最高,在下丘脑中的表达量最低,两者之间差异极显著(P<0.01),CTSB基因mRNA在单、多羔黔北麻羊卵巢组织中的表达量均极显著高于其他组织(P<0.01),其在单、多羔黔北麻羊中的表达顺序一致、依次为:卵巢>输卵管>垂体>子宫>下丘脑。组间比较可知,CTSB基因mRNA在多羔黔北麻羊垂体与子宫中的表达量极显著高于单羔黔北麻羊(P<0.01),在输卵管与卵巢中的表达量高于单羔黔北麻羊,但没有达到显著性差异(P>0.05)(图2)。CTSD基因组内比较发现mRNA在单、多羔黔北麻羊卵巢组织中的表达量最高,极显著高于其他组织(P<0.01),在子宫组织中的表达量最低。CTSD基因mRNA在单羔黔北麻羊的表达量依次为卵巢>输卵管>下丘脑>垂体>子宫;在多羔黔北麻羊的表达量依次为卵巢>垂体>输卵管>下丘脑>子宫。由组间比较得出,CTSD基因在多羔黔北麻羊卵巢、垂体、输卵管中的表达量极显著高于单羔黔北麻羊,其余组织均未达到显著性差异(P<0.05)。
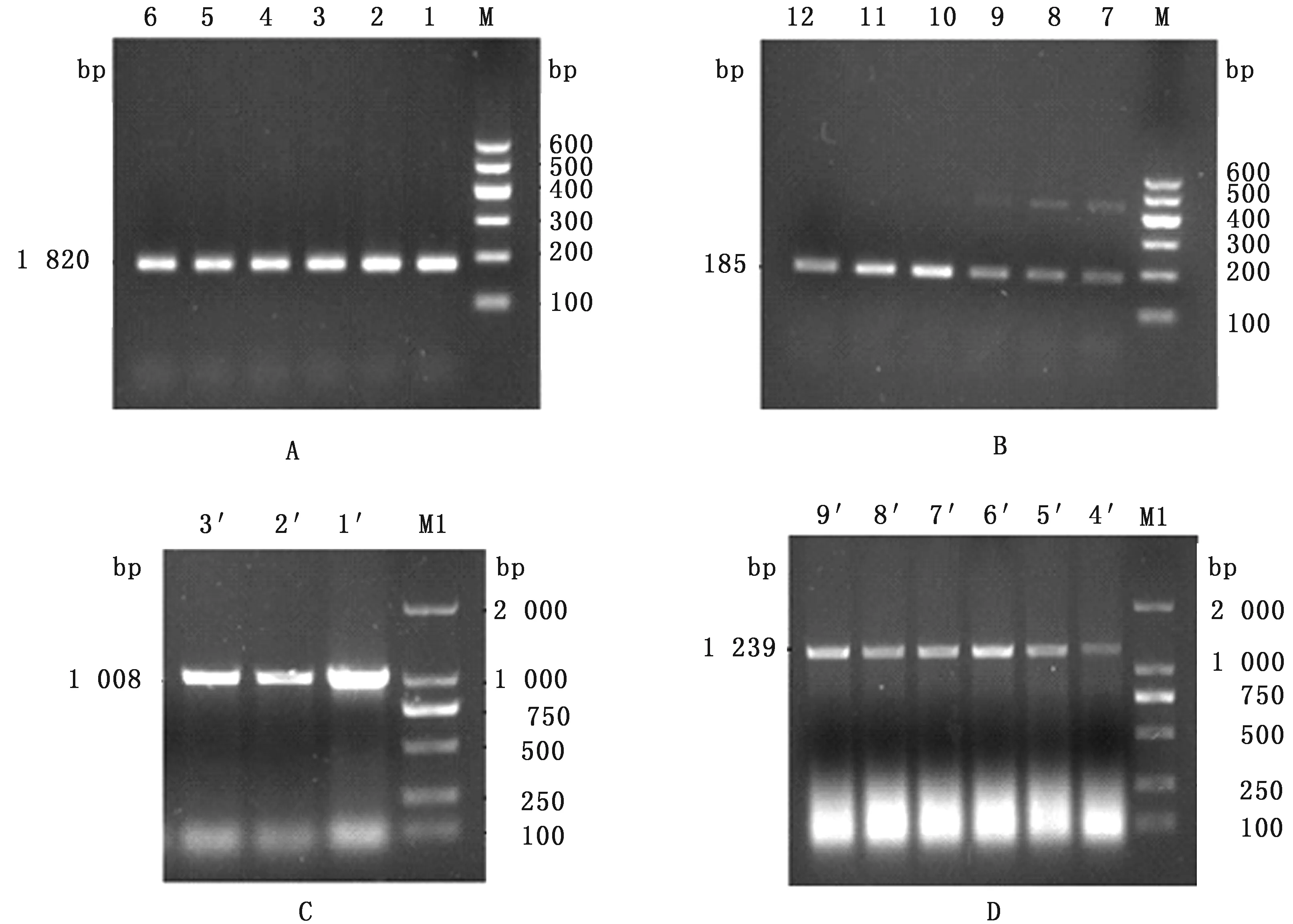
图1 琼脂糖凝胶电泳检测CTSB、CTSD基因PCR扩增产物 A.CTSB基因荧光引物;B.CTSD基因荧光引物;C.CTSB基因CDS区序列;D.CTSD基因CDS区序列。M,M1.DL2000 DNA Marker;1~6.CTSB基因荧光引物扩增产物;7~12.CTSD基因荧光引物扩增产物;1′~3′. CTSB基因CDS区片段;4′~9′.CTSD基因CDS区片段

图2 CTSB基因在单、多羔黔北麻羊不同组织中的表达量 注:不同大写字母A、B、C表示同一物种在不同组织间极显著差异(P < 0.01);**.表示同一组织在不同物种之间极显著差异(P < 0.01)。下同
2.3 CTSB、CTSD基因T克隆载体的鉴定与测序鉴定将目的基因CTSB、CTSD与pMD19-T连接后,经涂板转化,蓝白斑挑菌后,进行菌液PCR验证,结果显示,菌液PCR条带位置与目的条带位置一致,1 008 bp代表CTSB基因CDS区片段,1 239 bp代表CTSD基因CDS区片段,目的条带明亮,满足下一步试验要求(图4)。阳性菌液测序验证结果显示黔北麻羊CTSB基因与NCBI上传的山羊CTSB基因序列吻合度高达99.91%,第919位碱基由A突变为T,氨基酸由谷氨酰胺突变为组氨酸。黔北麻羊CTSD基因与NCBI公布的山羊CTSD基因序列吻合度达到100%,无碱基、氨基酸的突变。菌液PCR与测序验证证明目的基因pMD19-T-CTSB和pMD19-T-CTSDT克隆载体构建成功。
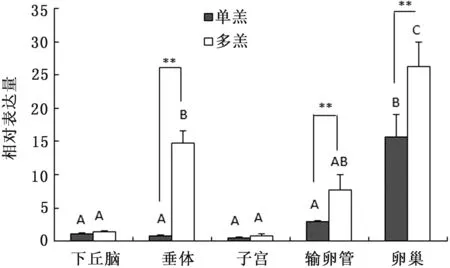
图3 CTSD基因在单、多羔黔北麻羊不同组织中的表达量
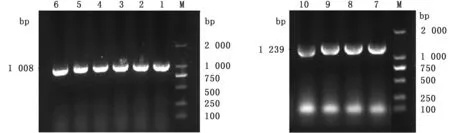
图4 CTSB、CTSD基因菌液PCR检测结果 M.DL2000 DNA Marker;1~6.CTSB基因;7~10.CTSD基因
2.4 黔北麻羊CTSB、CTSD基因CDS区生物信息学分析
2.4.1黔北麻羊CTSB、CTSD蛋白质理化性质分析 黔北麻羊CTSB基因CDS区包含1 008 bp,共编码335个氨基酸,ExPASy Protparam在线程序分析显示CTSB的分子式为C1623H2444N438O491S26,原子总数为5 022,编码的蛋白相对分子质量为36 780,理论等电点为5.65;该蛋白中甘氨酸(Gly)的含量最多,占氨基酸总量的11.0%,谷氨酰胺(Gln)与甲硫氨酸(Met)的含量最少,各占氨基酸总量的2.4%。该蛋白的不稳定指数为65.16(不稳定指数>53.0),提示该蛋白可能为相对不稳定蛋白;CTSD基因CDS区包含1 239 bp,共编码412个氨基酸,其分子式为C2008H3154N524O586S18,包括6 290个原子,蛋白相对分子质量为44 590,理论等电点为7.03;该蛋白中甘氨酸(Gly)的含量最多,占氨基酸总量的10.0%,色氨酸(Trp)的含量最少,占氨基酸总量的1.0%,Protparam在线程序分析出该蛋白的不稳定指数为37.82,提示该蛋白可能为相对稳定蛋白。
进一步使用ProtScale程序分析CTSB、CTSD蛋白的疏水性并生成检测图谱,横坐标为编码蛋白的氨基酸位置,纵坐标为蛋白疏水性分值,0分以下表示亲水,0分以上表示疏水。CTSB蛋白第9,10位丝氨酸、半胱氨酸的疏水性最强为2.467,第220位赖氨酸的亲水性最强为-2.500,负值氨基酸数量多于正值氨基酸,证实该蛋白为亲水性蛋白(图5A)。CTSD蛋白第13位亮氨酸的疏水性最强,分值为2.889,第126位天冬酰胺的亲水性最强,分值为-2.678,正值氨基酸略多于负值氨基酸,证实CTSD蛋白可能为疏水性蛋白(图5B)。

图5 CTSB(A)、CTSD(B)蛋白疏水性图谱
2.4.2黔北麻羊CTSB、CTSD蛋白质高级结构分析与预测 依据在线SOMPA软件预测黔北麻羊CTSB、CTSD蛋白质的二级结构,结果发现CTSB蛋白质二级结构由4种结构组成,无规则卷曲所占比例最大为54.03%,其次为α-螺旋占22.99%,延伸链所占比例为14.93%,最后β-转角占比7.28%;CTSD蛋白质二级结构共有4种结构组成,无规则卷曲占41.75%,其次为延伸链,所占比例为31.07%,α-螺旋与β-转角所占比例分别为19.90%与7.28%,得出CTSB、CTSD蛋白二级结构均主要由无规则卷曲构成,β-转角所占比例最低。随后,使用SWISS-MODEL软件进一步对CTSB、CTSD蛋白质三级结构进行预测,结果显示,CTSB蛋白质三级结构主要由无规则卷曲与α-螺旋组成,CTSD蛋白质三级结构更多则是由无规则卷曲与延伸链组成,与二级结构预测一致(图6)。
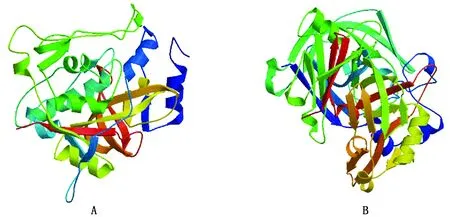
图6 黔北麻羊CTSB(A)、CTSD(B)蛋白质三级结构预测图像
2.4.3黔北麻羊CTSB、CTSD蛋白质亚细胞定位分析与信号肽预测 运用PSORT Ⅱ Prediction在线程序对CTSB、CTSD蛋白质进行亚细胞定位分析,发现黔北麻羊CTSB蛋白有66.7%的可能定位在细胞外(包括细胞壁)、位于细胞核、空泡与线粒体的比例相同,均为11.1%;黔北麻羊CTSD蛋白有44.4%的可能位于细胞外(包括细胞壁);22.2%的可能位于空泡;细胞质、线粒体、内膜各占11.1%。再使用SignalP 4.1在线预测网站预测黔北麻羊CTSB、CTSD基因编码的氨基酸序列中是否存在潜在的信号肽剪切位点,选择神经网络法(NN法)预测氨基酸的信号肽位点,横坐标表示氨基酸的位置,纵坐标表示信号分值,结果可知,黔北麻羊CTSB基因编码氨基酸序列具有信号肽,且信号肽的剪切位点在第17号与第18号氨基酸之间(图7A);黔北麻羊CTSD基因编码氨基酸序列也具有信号肽,剪切位点位于第22~23号氨基酸 (图7B)。
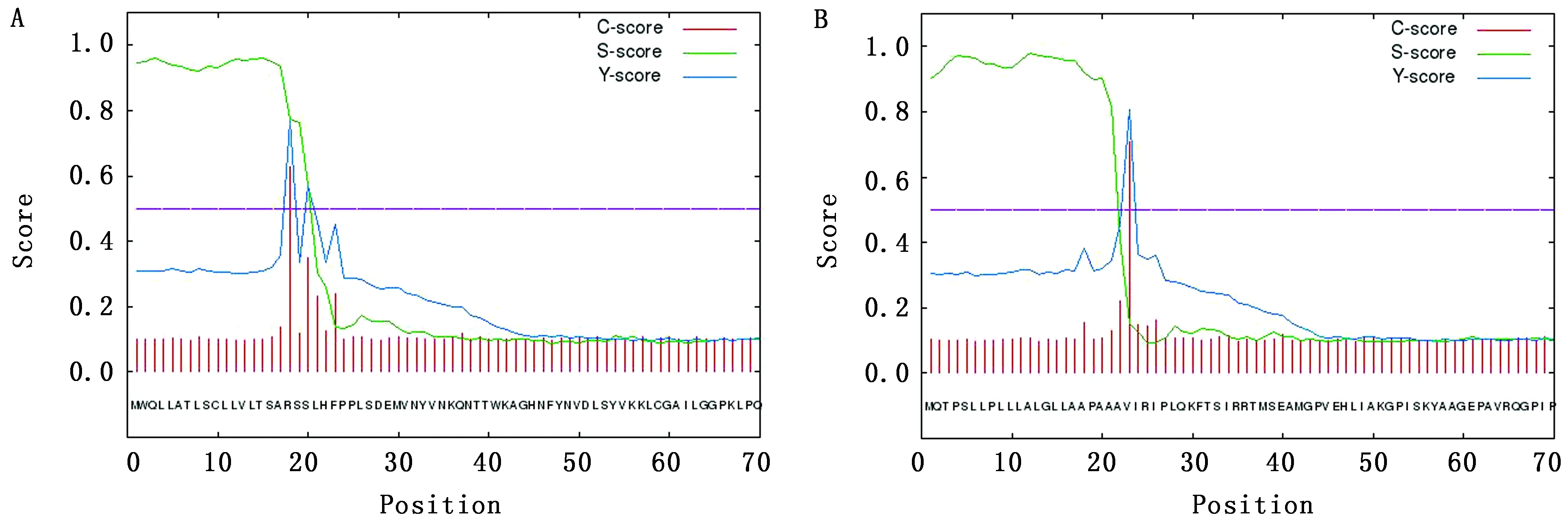
图7 黔北麻羊CTSB(A)、CTSD(B)编码氨基酸信号肽预测分析
2.4.4CTSB、CTSD氨基酸同源性分析 运用DNAStar软件对不同物种CTSB、CTSD氨基酸进行同源性分析,结果显示黔北麻羊CTSB基因编码的氨基酸序列与绵羊、牛、牦牛、虎鲸、骆驼、猪、鸡、大鼠、小鼠与人的相似性分别为99.4%,95.2%,94.6%,90.4%,87.8%,90.4%,77.0%,78.2%,78.5% 和81.0%,说明CTSB基因编码的氨基酸序列在不同物种之间均具有较高的相似性(图8A);进一步利用MEGA6.0软件构建不同物种CTSB基因编码氨基酸的系统发育进化树,结果证实黔北麻羊与绵羊的亲缘关系最近,与牛、牦牛亲缘关系较近,与人、大鼠、小鼠、鸡的亲缘性相对较远(图9A)。
黔北麻羊CTSD基因编码氨基酸序列与绵羊、牛、牦牛、虎鲸、骆驼、猪、鸡、大鼠、小鼠与人的相似性分别为98.5%,96.8%,97.1%,87.6%,70.2%,86.8%,66.8%,80.1%,79.0%和84.6%,由数据分析可见,CTSD基因编码氨基酸序列在不同物种之间也具有较高的保守性,黔北麻羊CTSD氨基酸序列与绵羊的相似性最高,与鸡的相似性最低(图8B)。系统发育进化树结果表明哺乳动物聚成一个大的分支,黔北麻羊CTSD基因编码氨基酸序列与绵羊的遗传距离最近,与牛、牦牛的遗传距离相对较近,与鸡、大鼠、小鼠的遗传距离相对较远(图9B)。

图8 不同物种CTSB(A)、CTSD(B)基因编码氨基酸序列比较
3 讨论
组织蛋白酶家族均归属于水解酶,是一大类蛋白水解酶,具有水解蛋白的能力。自从20世纪20年代提出组织蛋白酶的概念以来,到目前为止组织蛋白酶A~Z都已有报道[17]。组织蛋白酶B、D都是组织蛋白酶家族被研究最广泛、最常见的成员,目前CTSB和CTSD已经在常见动物猪、绵羊、水产动物、特种动物旋毛虫等多种动物中克隆并测序验证[18-20],其mRNA也在多种组织器官中广泛表达[21]。但近年来,关于组织蛋白酶的研究多是与疾病、癌症、免疫反应有关[22],其在黔北麻羊中的调控机制与组织表达谱尚不明确。
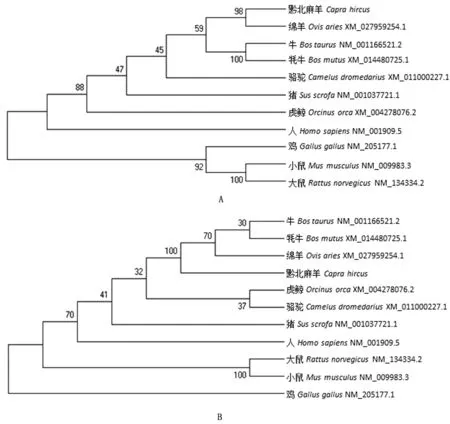
图9 不同物种CTSB(A)、CTSD(B)氨基酸系统发育进化树
本研究成功克隆了黔北麻羊CTSB、CTSD基因编码序列并与NCBI-GenBank数据库中的登录序列进行比对后发现,黔北麻羊CTSB基因编码序列与山羊CTSB基因编码序列匹配度达到99.91%,第919位氨基酸由谷氨酰胺(Gln)突变为组氨酸(His),黔北麻羊CTSD基因编码序列与山羊CTSD基因编码序列匹配度高达100%;氨基酸的突变是否会导致黔北麻羊CTSB蛋白功能的变异还需要后续验证。信号肽位点预测发现黔北麻羊CTSB、CTSD蛋白具有信号肽,CTSB蛋白信号肽剪切位点在第17~18号氨基酸,而CTSD蛋白信号肽剪切位点在第22~23号氨基酸,此结果与陈磊等[23]在猪上对CTSB的研究结果一致、与潘俐玲等[24]在水产动物上对CTSD的研究结果一致,说明黔北麻羊CTSB、CTSD蛋白可能是一种分泌蛋白;经氨基酸同源性比较与系统发育进化树发现,黔北麻羊CTSB、CTSD基因编码氨基酸序列与绵羊、牛、牦牛、虎鲸等大型哺乳动物的同源性相对较高,遗传距离相对较近,与人、鸡、大鼠、小鼠等动物的同源性相对较低,遗传距离相对较远,黔北麻羊CTSB基因编码氨基酸序列与其余10个物种相比同源性均在77.0% 以上,而CTSD基因编码氨基酸序列与其余10个物种相比同源性均在66.8%以上,提示CTSB、CTSD基因在遗传进化的过程中保守性较高,氨基酸不易发生改变。理化性质、疏水性分析与亚细胞定位发现黔北麻羊CTSB蛋白可能是一种位于细胞外(细胞壁)(66.7%)的不稳定亲水性蛋白,CTSD蛋白是一种位于细胞外或细胞壁(44.4%)的稳定疏水性蛋白,这分别与孙铭苑等[25]的对猪带涤虫以及祁昕等[26]对绵羊CTSB的分析结果一致,与王念璐等[27]对天府肉羊CTSD的分析结果一致;蛋白质高级结构分析表明黔北麻羊CTSB蛋白质二级结构主要由无规则卷曲与α-螺旋构成,CTSD蛋白质二级结构主要由无规则卷曲与延伸链组成,依然与祁昕等[26]对CTSB的研究结果一致。
研究发现CTSB与CTSD能以多种形式存在,其在细胞或组织中的作用也不同。邓桂馨等[21]研究表明CTSB广泛分布于哺乳动物的肝、脾、肾、骨、神经细胞和巨噬细胞等各种组织中。而CTSD也分别在心、肝、脾、子宫和卵巢等组织中检测出[28]。本研究利用qRT-PCR法对目的基因在单、多羔黔北麻羊下丘脑、垂体、子宫、输卵管和卵巢5个性腺组织中的表达量进行差异分析,结果显示CTSB、CTSD基因mRNA在这些组织中均有不同程度的表达,AHN等[29]研究CTSB蛋白在鸡的卵巢中有分布,在鸡癌变的卵巢中有大量的表达,ASHRY等[30]利用转录本技术分析得出CTSB mRNA在卵丘细胞中的丰度较其他组织高,SONG等[31]得出CTSB和CTSD在绵羊子宫内膜中呈低度表达。这些结果与本研究得出CTSB与CTSD基因mRNA在单、多羔黔北麻羊的表达谱一致。此外BALBOULA等[32]研究发现CTSB对卵巢细胞的影响较大并能够参与细胞凋亡,故其mRNA在卵细胞中较为活跃。也有较多的研究证实CTSB对卵巢细胞的凋亡有很大的相关性。CTSD作为天冬氨酸蛋白酶家族成员同样也对细胞凋亡有影响、还能够参与卵泡的发育与成熟。研究表明CTSD mRNA在草鱼性腺组织中的表达量高于其他组织[33],同时,本研究发现CTSB、CTSD基因在单、多羔黔北麻羊卵巢组织中的表达量最高。这提示CTSB、CTSD可能参与卵巢组织的生殖调控且对产羔性状有一定的影响。

