固定化天冬氨酸酶制备(R)-3-氨基丁酸
张飞龙,杨卫华,陈明亮,严燕兵,唐云平,肖延铭
(1.长兴制药股份有限公司 工业生物催化与转化浙江省工程研究中心,浙江 长兴 313100;2.浙江海洋大学 食品与医药学院,浙江 舟山 316022)
度鲁特韦是人类免疫缺陷病毒类型I(HIV-1)整合酶链转移抑制药,其化学合成所需原料较多,(R)-3-氨基丁醇是其重要原料之一,(R)-3-氨基丁酸(R-3-ABA)主要作为医药中间体(R)-3-氨基丁醇的前体物[1-2]。目前,国内对于(R)-3-氨基丁醇的制备主要还是传统的化学方法,包括:化学拆分法、化学诱导法、手性原料合成法和制备色谱法等。但采用以上方法制备(R)-3-氨基丁醇易对环境造成较大的污染且收率不高,不利于节能减排[3-4]。开发具有高效、低成本的路线合成高纯度的(R)-3-氨基丁酸是降低度鲁特韦原料药成本、推广其应用范围的关键步骤。相对于化学法,利用生物酶法催化技术建立一个低成本、高效、环保,且制备工艺简单,有利于工业化生产的工艺将具有更加广泛的应用前景。
天冬氨酸酶,也称天冬氨酸裂氨酶(EC 4.3.1.1,Asp),是特异于天冬氨酸或其衍生物为底物的3种类型的氨裂解酶之一,在氮代谢中起着重要的作用,通过催化L-天冬氨酸可逆地消除氨并产生富马酸盐[5-6]。目前研究的几种相关的天冬氨酸酶包括大肠杆菌、荧光假单胞菌、枯草芽孢杆菌和芽孢杆菌YM55-1。其中研究最多的是大肠杆菌天冬氨酸酶(AspA)和芽孢杆菌YM55-1天冬氨酸酶(AspB)[7-10]。AspA是已知最具特异性的酶之一,但AspA对其天然底物的高选择性限制了该酶的实际应用。与AspA相比,AspB具有较高的活性和对映体选择性、广泛的亲核试剂特异性、相对热稳定性以及缺乏底物或金属离子的变构调节,从而在有机合成领域引起了研究者极大的兴趣[11]。
已有研究报道天冬氨酸酶基因T187、K324和N326为底物C1羧基的结合残基,本研究通过克隆构建、定点突变获得了重组天冬氨酸酶(AspBm)[12],利用酶催化将底物巴豆酸转化为(R)-3-氨基丁酸(图1)。与传统化学方法合成相比,酶法制备更加安全、环保,制成固定化细胞用于工业化生产使得生产成本大大降低[13]。

图1 天冬氨酸酶催化合成(R)-3-氨基丁酸
1 材料与方法
1.1 材料
细菌基因组DNA制备试剂盒、质粒DNA提取试剂盒、DNA凝胶回收试剂盒、DNA清洁试剂盒,Axygen公司;限制性内切酶、DNA连接酶、DpnⅠ,TaKaRa公司;引物合成和基因测序,杭州擎科梓熙生物技术有限公司。胰蛋白胨、酵母提取物,Oxoid公司,硅藻土、戊二醛、聚乙烯亚胺、氨水、(NH4)2SO4等均为市售生化试剂。
Bacillussp.YM55-1、E.coliDH5α、E.coliBL21(DE3)、pET-28a(+)均保藏于本公司。
LB培养基(g/L):酵母提取物5、胰蛋白胨10、NaCl 10。
TB培养基(g/L):酵母膏24、胰蛋白胨12、甘油5、KH2PO42.31、K2HPO4·3H2O 16.43。
1.2 方法
1.2.1 天冬氨酸酶的克隆
根据NCBI数据库中Bacillussp.YM55-1基因序列设计引物,正向引物F:5′-CGCGGATCCATGAATACCGATGTTCGT-3′,反向引物R:5′-CCGCTCGAGTATTTTCTTCCAGCAATTCCCGG-3′(下划线部分分别为BamH Ⅰ和XhoⅠ的限制性酶切位点)。挑取Bacillussp.YM55-1单菌落于LB液体培养基中,37 ℃培养14 h,5 000 r/min离心10 min收集菌体,使用细菌基因组提取试剂盒提取Bacillussp.YM55-1基因组。以获得的基因组为模板进行PCR,扩增得到天冬氨酸酶基因AspB。扩增程序如下:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1.5 min,30个循环后72 ℃延伸10 min。PCR产物经DNA凝胶回收试剂盒纯化,与载体pET-28a(+)分别用BamHⅠ和XhoⅠ于37 ℃双酶切2 h。酶切反应液使用DNA清洁试剂盒纯化后,取适量载体和基因片段,加入DNA连接酶混匀,于16 ℃连接反应12 h。随后加入到E.coliDH5α感受态细胞进行转化,利用卡那霉素抗性筛选得到克隆菌株,测序验证得到重组质粒pET-28a(+)-AspB。
设计天冬氨酸酶基因T187C、K324M和N326C定点突变所需引物,进行定点突变PCR。PCR扩增产物纯化后使用DpnⅠ于37 ℃酶切3 h,随后加入到E.coliDH5ɑ感受态细胞中进行转化,转化液涂布在含有卡那霉素抗性的LB固体培养基中。挑取单菌落至4 mL LB培养基,37 ℃、220 r/min培养过夜,抽提质粒并送公司测序,确保突变基因正确。将得到的重组突变质粒转入E.coliBL21(DE3),得到重组表达菌株E.coliBL21(DE3)/pET-28a(+)-AspBm。
1.2.2 天冬氨酸酶酶液制备
挑取重组表达菌株单菌落接种到含卡那霉素的4 mL LB液体培养基中,37 ℃、220 r/min培养14 h,按体积分数1%接种量接种至200 mL TB液体培养基中,37 ℃、220 r/min培养,待OD600至0.6~0.8时加入终浓度为0.2 mmol/L的IPTG,25 ℃诱导培养16 h。菌液于5 000 r/min离心10 min,收集菌泥,用50 mmol/L K2HPO4-KH2PO4缓冲液(pH 7.0)重悬2次后,加入50 mmol/L pH 7.0的磷酸盐,超声波破碎(200~400 W,超声3 s,间歇5 s,总共8 min),在4 ℃条件下,8 000 r/min离心30 min收集上清液。
1.2.3 天冬氨酸酶活力测定
天冬氨酸酶酶活力的测定参照文献[9]进行。1 mL反应体系含50 mmol/L pH 7.0 HEPES缓冲液、0.1 mol/L L-天冬氨酸、100 μL适当稀释浓度的酶液。反应体系于30 ℃反应5 min,立即在240 nm处测定富马酸吸光值的变化。
酶活定义:在30 ℃、pH 7.0条件下每分钟生成1 μmol/L富马酸所需的酶量定义为1个酶活单位,1 U。
1.2.4 SDS-PAGE和蛋白含量测定
SDS-PAGE采用12%分离胶进行电泳。蛋白含量测定采用考马斯亮蓝法进行。
1.2.5 固定化细胞的制备
将180 mL水加入20 g菌体,充分搅拌,再向菌悬液中加入1.2 g硅藻土和6 mL 5%聚乙烯亚胺,氨水调控pH至9.0,28 ℃充分搅拌1 h。随后向溶液中加入2 mL 25%戊二醛进行交联,维持pH在9.0左右,充分搅拌1 h后进行抽滤,水淋洗2次,4 ℃储存备用。固定化细胞前进行了预实验,设置不同量的硅藻土、聚乙烯亚胺和戊二醛,在上述参数下,天冬氨酸酶固定化细胞酶活最高。
1.2.6 天冬氨酸酶催化体系
催化体系为(g/L)巴豆酸185、MgSO42.4、(NH4)2SO458.8;氨水调pH至8.2。固定化天冬氨酸酶菌体量30 g/L,反应温度为40 ℃,反应开始后氨水调控pH在8.9~9.1。
2 结果与讨论
2.1 天冬氨酸酶在E.coli BL21(DE3)中的表达
重组表达菌株进行诱导表达,超声波破碎后进行SDS-PAGE,结果见图2。由图2可知,天冬氨酸酶大部分存在于上清液中,在分子量为(4.43~6.64)×104位置有明显的表达条带,与pET-28a(+)-AspBm理论5.16×104大小相近。

1—E.coli BL21(DE3)/pET-28a(+)-AspBm IPTG诱导前样;2—E.coli BL21(DE3)/pET-28a(+)-AspBm破碎上清液;M—标准蛋白
2.2 固定化细胞催化合成(R)-3-氨基丁酸的条件优化
2.2.1 缓冲液pH对催化反应的影响
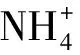

图3 缓冲液pH对反应的影响
2.2.2 温度对催化反应的影响
保持其他反应条件相同,设置不同反应温度,考察温度对反应的影响,结果见图4。由图4可知,随着温度的升高,酶活得到逐步提高,在40 ℃达到最大。当温度提高到45 ℃时,相对酶活仅有85.7%,考虑可能是温度过高导致天冬氨酸酶的稳定性变差,从而使酶活变低。因此选择40 ℃作为最佳反应温度。

图4 温度对反应的影响
2.2.3 菌体量对催化反应的影响
保持其他反应条件相同,设置不同反应菌体量,考察菌体量对反应的影响,结果见图5。由图5可见,(R)-3-氨基丁酸的质量浓度随着菌体量的增加而逐渐得到提高,在菌体量为30 g/L时,底物转化接近99%,进一步增加菌体量会对后续的产物分离造成一定的困难,同时也存在一定程度的浪费,因此最佳菌体量选择为30 g/L。

图5 菌体量对反应的影响
2.2.4 反应时间对催化反应的影响
其他反应条件不变,考察反应时间对反应的影响,结果如图6所示。由图6可知,随着反应时间的延长,产物质量浓度得到不断地提高。在反应前16 h反应速率较快,在22 h后产物质量浓度的增长变得更加缓慢,一方面可能是反应时间过长,酶活力降低,另一方面可能是反应达到平衡。结合实际生产,反应时间选择在22 h。

图6 反应时间对反应的影响
2.2.5 固定化AspBm催化巴豆酸产(R)-3-氨基丁酸
巴豆酸经固定化AspBm催化反应22 h后,产物(R)-3-氨基丁酸收率为97.8%。利用HPLC分析反应18 h和26 h的情况,结果如图7所示。由图7可知,反应26 h转化液几乎已无巴豆酸残留,反应较为彻底。

图7 固定化细胞催化巴豆酸反应18和26 h的HPLC图谱
2.2.6 重复使用次数
在上述最优条件下进行固定化细胞酶促反应,每批次反应结束后检测(R)-3-氨基丁酸的质量浓度,固定化细胞经清洗后立即进入下批次的转化反应。固定化细胞重复使用次数的结果如图8所示。由图8可知,固定化细胞可重复使用次数不低于24次,此时(R)-3-氨基丁酸的产率达到89.2%。随着反应批次的继续增多,产率逐渐减小。

图8 固定化细胞重复使用次数对反应的影响
3 结论
从Bacillussp.YM55-1中克隆得到天冬氨酸酶基因,对其序列进行分析,作定点突变,并利用大肠杆菌作为表达宿主,实现了Bacillussp.YM55-1 Asp基因的异源表达。将天冬氨酸酶基因工程菌制备成固定化细胞,考察不同反应条件对天冬氨酸酶催化生成(R)-3-氨基丁酸产量的影响,结果发现:反应缓冲液pH控制在9.0、反应温度40 ℃、反应时间22 h、菌体量为30 g/L时,产物的质量浓度能达到220 g/L,转化率达到98%以上。基因工程菌固定化细胞多达24次的重复使用,使得工业化生产(R)-3-氨基丁酸的成本得到显著降低。在本项目研究过程中,发现随着底物巴豆酸质量浓度的提高,天冬氨酸酶耐受性变差,反应转化率随之降低。倘若通过诸如一些分子生物学方面的技术来改造天冬氨酸酶,或许可以提高酶的稳定性和酶活力,从而使工业化生产成本得到进一步的降低,同时对于降低度鲁特韦的售价也能起到一定的作用。

