以四甲基氢氧化铵为溶剂的磁性纤维素微球制备、表征及应用
朱瀛奎,万丽君,曹 飞,周 华,韦 萍,贾红华
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
纤维素是生物质资源中含量最多的一种天然聚合物,由于其具有资源量大、可再生、生物可降解等特点,人们一直希望以纤维素为原料开发新型生物基材料,用于替代许多传统化学合成的高分子材料[1-3]。纤维素微球是一种以纤维素为原料加工而成的多孔材料,可用作吸附材料、医药材料等[4]。目前对纤维素微球已有相当多的研究,Dong等[5]制备了离子液体修饰的纤维素微球并用于Au3+的吸附;Huang等[6]制备了醋酸丁酯纤维素微球用于埃玛菌素缓释研究。
由于分子间氢键作用,天然纤维素均聚集成了高度结晶的致密结构,导致绝大多数溶剂无法有效溶解纤维素,从而给纤维素微球的制备带来了很大的难度[7-8]。因此,长期以来,寻找和开发溶解纤维素的溶剂体系一直是研究的热点,目前已发现了几种纤维素溶剂体系,如N-甲基吗啉-N-氧化物(NMO)体系[9]、LiCl/二甲基乙酰胺体系[10]、离子液体[11]以及NaOH-尿素体系[12]等,但是这些溶剂体系大多需要高温且操作条件比较苛刻。
季铵碱作为一种新型纤维素溶解溶剂,可在比较低温度下溶解纤维素,是一种理想的纤维素溶解溶剂[13]。本课题组在多年研究季铵碱溶解纤维素的基础上,试图利用季铵碱四甲基氢氧化铵溶液来溶解纤维素进而制备纤维素微球,并混入磁性Fe3O4纳米粒子使其具有良好的磁响应性能,在利用扫描电镜(SEM)分析、傅里叶变换红外光谱(FT-IR)分析、X线衍射(XRD)分析、振动样品磁强计(VSM)分析、比表面和孔径(BET)分析等对磁性纤维素微球进行表征的基础上,初步尝试了利用所制备磁性纤维素微球进行染料吸附的研究。
1 材料和方法
1.1 试剂和仪器
微晶纤维素、FeCl3·6H2O、乙二醇、无水乙酸钠、无水乙醇、吐温80等试剂均为分析纯,国药集团化学试剂有限公司;真空泵油,苏州惠丰润滑材料有限公司;四甲基氢氧化铵、亚甲基蓝(分析纯),阿拉丁试剂有限公司。
S-3400 NII型扫描电子显微镜,日本Hitachi公司;BI-200SMz型傅里叶红外光谱仪、GENESYS 10S型紫外可见分光光度计,美国Thermo Fisher公司;EV7型振动样品磁强计,美国ADE公司;XTRA型X线衍射仪,瑞士ARL公司;ASAP2020型全自动比表面及孔隙率分析仪,美国Micromertics公司。
1.2 磁性Fe3O4纳米粒子制备
将0.338 g FeCl3·6H2O完全溶解在10 mL乙二醇中,得到澄清的黄色溶液,再加入1.36 g无水乙酸钠。将混合物剧烈搅拌30 min后密封入压力容器中,然后在200 ℃加热12 h。室温下缓慢冷却后,用磁铁收集产品并用乙醇洗涤,然后在60 ℃下干燥6 h,得到磁性Fe3O4纳米粒子。
1.3 磁性纤维素微球的制备
将0.8 g纤维素加入20 mL 25%四甲基氢氧化铵的水溶液中,进行搅拌促进其快速溶解。待纤维素完全溶解后,将0.3 g所制备的干燥磁性Fe3O4纳米粒子加入到纤维素溶液中去,然后搅拌混合0.5 h。随后,将磁性Fe3O4纳米粒子-纤维素混合液缓慢倒入准备好的真空泵油-吐温80乳化液(20 mL真空泵油,1 mL吐温80)中,继续高速搅拌乳化3 h。停止搅拌后,将15 mL乙醇缓慢倒入乳化液,使磁性纤维素微球固化析出,待降至室温后用磁铁将乳化液中析出的磁性纤维素微球分离,并用乙醇和去离子水进行多次洗涤,所得磁性纤维素微球真空冷冻干燥保存,备用。
1.4 磁性纤维素微球的表征
1.4.1 FT-IR分析
用美国Thermo Fisher公司BI-200SMz型傅里叶变换红外光谱仪对制得的磁性Fe3O4纳米粒子、微晶纤维素和磁性纤维素微球样品进行FT-IR分析,KBr压制样片,机器扫描次数为30次,波长范围设置为4 000~400 cm-1。
1.4.2 SEM分析
用0.05%吐温溶液制备磁性纤维素微球分散液后,取样滴到干净铝箔上,干燥后用日本Hitachi公司S-3500NII型扫描电子显微镜进行表面扫描分析。
1.4.3 XRD分析
用瑞士ARRL公司XGSTI型X线衍射仪对磁性Fe3O4纳米粒子、纤维素和磁性纤维素微球进行晶体结构分析,扫描范围5~90°,扫描速度0.5°/min。
1.4.4 VSM分析
用美国ADE公司EV7型振动样品磁强计测定磁性Fe3O4纳米粒子、磁性纤维素微球的磁滞回曲线,测试温度300 K,磁场强度变化范围(-2.39~2.39)×106A/m。
1.4.5 比表面和孔径(BET)分析
用美国Micromeritcs公司ASAP2020型全自动比表面及孔径分析仪对磁性纤维素微球进行BET分析,以N2为吸附质,测定前样品在50 ℃真空脱气10 h。
1.5 磁性纤维素微球吸附性能测试
取10 mL亚甲基蓝溶液放置于25 mL的离心管中,加入50 mg的纤维素微球并置入恒温摇床中,每隔1 h取样在664 nm下测定样品吸光值。磁性纤维素微球吸附量(Q)的计算见式(1)。
(1)
亚甲基蓝的去除率(B)的计算见式(2)。
(2)
式中:Q代表磁性纤维素微球在不同状态对亚甲基蓝的吸附量,mg/g;ρ0是亚甲基蓝溶液刚开始的初始质量浓度,mg/L;ρt是t时刻残留的亚甲基蓝质量浓度,mg/L;V代表亚甲基蓝溶液的体积,L;m表示所加入磁性纤维素微球的质量,g。实验重复3次之后对吸光值取平均值。
2 结果与讨论
2.1 磁性纤维素微球的形貌及孔表征
以四甲基氢氧化铵溶液为溶剂,制备纤维素和磁性Fe3O4纳米粒子混悬液,然后用真空泵油和吐温80混合液作为乳化剂,在充分混合乳化后,加入乙醇等反溶剂,促使纤维素包裹磁性Fe3O4纳米粒子,固化析出成球,成功制备了磁性纤维素微球。对所制备的磁性纤维素微球进行SEM分析,结果如图1所示。

图1 磁性纤维素微球SEM照片
由图1可知,所制备的磁性纤维素微球表面粗糙,外观球形度非常好,且粒度相对均一,为200 nm左右。比表面积和孔径分析结果显示,磁性纤维素微球比表面积为13.6 m2/g,其表面微孔体积为0.5 cm3/g。
2.2 FT-IR分析结果
图2显示了纤维素、磁性Fe3O4纳米粒子和磁性纤维素微球的红外光谱图。由图2可知,1 163 cm-1为纤维素糖苷键C—O—C醚键的伸缩振动峰,1 372 cm-1处为甲基和亚甲基中的C—H弯曲振动峰,1 639 cm-1处为吸附水的弯曲振动峰,2 900 cm-1处为亚甲基和次甲基中C—H的伸缩振动峰,3 347 cm-1处为羟基的伸缩振动峰。通过纤维素和磁性纤维素微球的红外光谱对比分析,两者的出峰位置基本一样,可证明纤维素在经过溶解和再生且与磁性Fe3O4纳米粒子混合之后生成磁性纤维素微球的过程中,其结构未发生明显变化。从图2中还可看出,磁性Fe3O4纳米粒子578 cm-1处出现了很明显的Fe3O4的特征吸收峰,而在微球谱图的578 cm-1处也出现了这一特征吸收峰,说明所制备微球由纤维素包裹磁性Fe3O4纳米粒子而成。
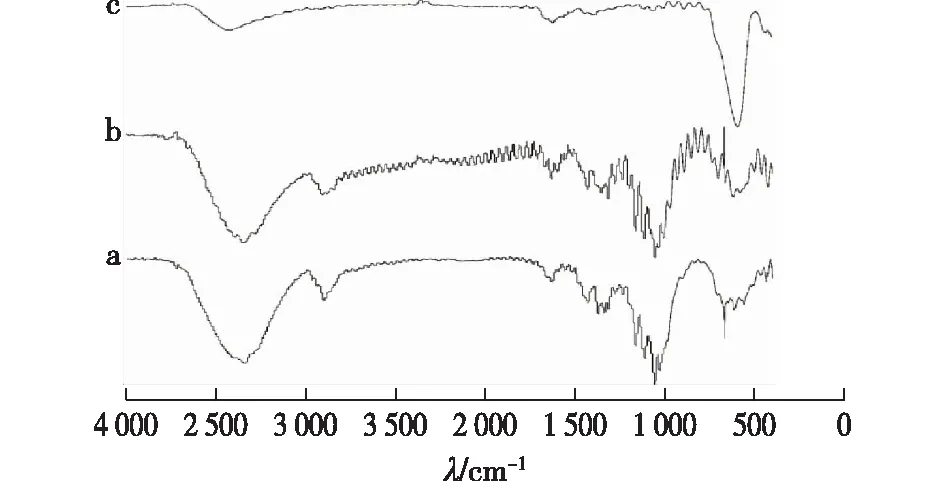
图2 纤维素(a)、磁性纤维素微球(b)、磁性Fe3O4纳米粒子(c)的红外光谱图
2.3 XRD分析结果
图3为纤维素、磁性Fe3O4纳米粒子的XRD谱。由图3可知,谱线a和谱线c这两条谱线的衍射角在30.1°、35.5°、43.1°、53.4°和57.0°都出现了衍射峰,通过对比过数据库标准JCPDS卡片(PDF No.65—3107)后得知与磁性Fe3O4纳米粒子的晶面衍射峰一致。通过比较谱线b和c可发现,磁性纤维素微球具有明显的纤维素衍射特征峰,但部分峰有所降低。从上述分析可知,所制得的磁性纤维素微球确实为磁性Fe3O4纳米粒子的纤维素包裹物。磁性纤维素微球的纤维素衍射峰相比原料有所下降,可能是因为季铵碱溶解纤维素后再生成微球的过程中,纤维素的结晶态遭到一定程度的破坏,进而降低其衍射吸收。

图3 磁性Fe3O4纳米粒子(a)、纤维素(b)和磁性纤维素微球(c)的XRD谱图
2.4 VSM分析结果
图4显示了利用振动样品磁强计在室温下对磁性Fe3O4纳米粒子和磁性纤维素微球进行测试的磁性能曲线。由图4可知,磁性纤维素微球与磁性Fe3O4纳米粒子均拥有顺磁性,其中磁性Fe3O4纳米粒子的磁性为7.5×10-3T/g,而磁性纤维素微球的磁性为2.0×10-3T/g。VSM分析结果表明,磁性纤维素微球拥有良好的磁响应性能,方便从各种体系中回收。

图4 Fe3O4纳米粒子和磁性纤维素微球的VSM分析
2.5 磁性纤维素微球用量对吸附亚甲基蓝的影响
为了研究磁性纤维素微球用量与亚甲基蓝去除效果之间的关系,在室温条件下,分别量取10 mL质量浓度为4 mg/mL的亚甲基蓝溶液于25 mL带塞子的4支离心管中,然后称取30、40、50和60 mg的磁性纤维素微球,分别加入上述对应的离心管中,再将离心管放置于恒温振荡器上,定时取样测吸光值,计算其单位吸附量和去除率,结果见图5。由图5可知,不同用量的微球,吸附量1 h内增速最快,基本上都达到了平衡状态,吸附量与微球用量成正比关系。随着微球用量的增加,其单位吸附量逐渐减小,当微球用量为30 mg时,单位吸附量达到8.4 mg/g,继续增加微球用量,加入60 mg时,单位吸附量为5.1 mg/g。从上图可以看出,随着微球用量的增加,对亚甲基蓝的去除率增加越来越快,在用量为60 mg时,去除率达到76.3%,去除效率较为理想。
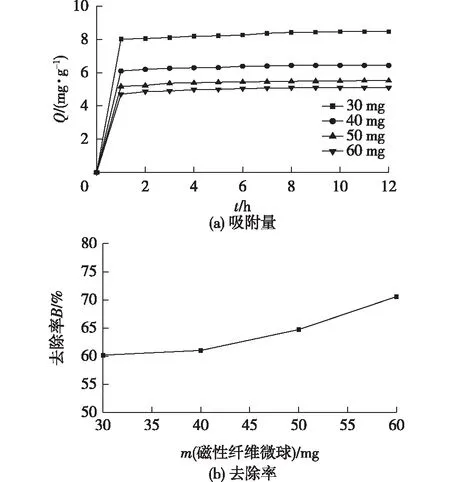
图5 磁性纤维素微球用量对单位吸附量和去除率的影响
2.6 亚甲基蓝浓度对染料吸附效果的影响
为了研究溶液中亚甲基蓝的浓度与纤维素微球吸附效果之间的关系,在室温条件下,准确地量取1~4 mg/L的亚甲基蓝溶液10 mL并放置于带塞子的25 mL离心管中,然后称取50 mg的磁性纤维素微球置于离心管中,再将离心管放置于恒温振荡器上,定时取样测吸光值,计算染料去除率,结果见图6。由图6可知,纤维素微球对亚甲基蓝的吸附效果在1 h内非常明显,然后很快达到了吸附平衡。这可能是由于纤维素微球粒径较小,比表面积大,所以对亚甲基蓝的吸附性能非常强,因而短时间内迅速吸附大量亚甲基蓝,但是,亚甲基蓝很快在纤维素微球表面吸附完毕,表面的吸附位点被占据完全,只能渗透进纤维素微球内部,由于扩散阻力的影响,其后面的吸附过程比较缓慢。另外,在1和4 mg/L亚甲基蓝浓度下,纤维素微球达到吸附平衡的时间分别是1和8 h,这也表明纤维素微球对亚甲基蓝的吸附与亚甲基蓝的浓度直接关联。

图6 亚甲基蓝浓度对去除率的影响
2.7 pH对亚甲基蓝吸附效果的影响
配制不同pH的相同浓度亚甲基蓝溶液,并加入50 mg磁性纤维素微球,放入恒温振荡器进行振荡,定时取样测吸光值,结果如图7。由图7可知,在过酸和过碱环境下,磁性纤维素微球的吸附量都会降低,可能是过酸和过碱条件下会改变亚甲基蓝和磁性纤维素微球的带电状态,导致其吸附能力大大减弱。在pH为4~8时,磁性纤维素微球对亚甲基蓝的吸附量最高,约为5.7 mg/g,去除率达到了70%以上。

图7 不同pH下亚甲基蓝吸附情况随时间的变化
3 结论
1)以微晶纤维素和磁性Fe3O4纳米粒子为原料,四甲基氢氧化铵溶液为溶剂,通过分散乳化法成功制备了磁性纤维素微球。
2)一系列分析测试表明磁性纤维素微球确为纤维素与Fe3O4纳米粒子包裹结构,有着良好的球形结构且粒径均为200 nm左右。比表面积测试结果显示,磁性纤维素微球比表面积为13.6 m2/g,其表面微孔体积为0.5 cm3/g。磁性纤维素微球的磁强度为2.0×10-3T,磁响应性能良好,表明在外加磁场的条件下可实现磁性纤维素微球的快速分离和回收。
3)利用磁性纤维素微球进行亚甲基蓝吸附试验,结果显示磁性纤维素微球量与吸附效率成正比。磁性纤维素微球在不同pH下吸附亚甲基蓝试验表明,在pH为4~8时,其亚甲基蓝去除率都达到了70%以上。

