姜黄素对MRL/lpr狼疮性肾炎小鼠的作用及机制研究*
刘 谓, 戴 晖, 安乐美, 阎 磊, 邵凤民△
(1河南省人民医院/郑州大学人民医院风湿免疫科,河南郑州450003;2新疆哈密红星医院肾内科,新疆哈密839000;3河南省人民医院/郑州大学人民医院肾内科,河南郑州450003)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种以淋巴细胞异常活化产生大量自身抗体并累及多系统、多器官的慢性自身免疫性疾病[1]。狼疮性肾炎(lupus nephritis,LN)是SLE最常见且最严重的并发症之一,也是造成SLE患者死亡的主要原因[2-3]。目前临床上常采用激素和免疫抑制剂治疗LN,改善患者预后,但仍有部分患者最终进展为终末期肾病[4]。目前研究认为,免疫调节失衡和、炎症等是LN的重要发病机制[5],因此寻找新的、有效的治疗方法调节免疫功能并控制炎症反应,对治疗LN、改善病情及预后具有重要意义。姜黄素(curcumin,Cur)是一种多酚类中药单体,具有抗炎、抗氧化、抗增殖、免疫调节等多种药理作用,已被广泛用于治疗各种疾病[6-8]。本研究拟观察Cur对MRL/lpr小鼠的影响及其可能机制,为临床治疗LN提供新的思路。
材料与方法
1 试剂
姜黄素纯度为99%,购自Sigma;血清肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)和抗双链DNA(double-stranded DNA,dsDNA)检测试剂盒及炎症因子ELISA试剂盒均购自北京索莱宝科技有限公司;抗p-IκB、NF-κB、NLRP3、caspase-1、核仁纤维蛋白(fibrillarin)和GAPDH抗体购于Abcam。
2 方法
2.1 动物分组与处理 10只C57BL/6小鼠及30只MRL/lpr小鼠,雌性,体重(20±2)g,10周龄,购于上海斯莱克实验动物有限责任公司。所有动物实验均经本院伦理委员会批准。将MRL/lpr小鼠随机分为MRL/lpr组(灌胃等体积生理盐水)及Cur低、高剂量组(Cur-L和Cur-H组,分别给予100和200 mg/kg Cur灌胃处理),每组10只;C57BL/6小鼠为正常对照(normal control,NC)组(灌胃等体积生理盐水)。灌胃均每天1次,连续12周。
2.2 尿蛋白检测 分别于处理前及处理后每2周留取各组小鼠的尿液进行尿蛋白检测。将尿液稀释10倍后,使用BCA蛋白浓度检测试剂盒检测尿液中的蛋白含量,严格按照说明书进行操作。酶标仪(波长562 nm)测定吸光度。根据标准品计算样品的蛋白浓度。
2.3 SCr及BUN水平的测定 最后一次给药2 h后,麻醉状态下断颈处死小鼠,而后眼球取血,离心后取血清,-80℃冻存。采用全三硝基苯酚比色法和脲酶法分别测定SCr和BUN水平,操作步骤严格按试剂盒说明书进行。
2.4 肾脏组织的病理形态学观察 小鼠取血完成后迅速于冰台上解剖取肾组织,部分肾组织于4%的甲醛溶液固定,乙醇洗脱后进行石蜡包埋,制备成2µm左右的切片进行苏木精-伊红(hematoxylin-eosin,HE)染色,于光学显微镜下观察肾脏组织的形态学变化。按照Austin等[9]的方法,随机选取50个肾小球,对其进行肾小球增生和中性粒细胞浸润分析。
2.5 ELISA检测炎症因子及抗dsDNA水平 取部分新鲜肾组织,制成匀浆,4℃离心15 min,取上清液进行炎症因子检测。ELISA试剂盒检测血清和肾脏组织中IL-1β、IL-6和TNF-α水平及血清中抗dsDNA的含量,严格按照试剂盒操作进行。
2.6 Western blot实验 取部分肾组织,采用蛋白提取试剂盒提取总蛋白,然后再分别采用细胞核蛋白和细胞浆蛋白抽提试剂盒提取肾组织核蛋白和胞浆蛋白,严格按照试剂盒说明书操作。其中总蛋白用于检测NLRP3和caspase-1蛋白水平,胞浆蛋白用于检测p-IκB蛋白水平,胞核蛋白用于检测胞核NF-κB蛋白表达。BCA法测定蛋白浓度后,取40µg蛋白样品进行SDS-PAGE,转到PVDF膜,采用脱脂奶粉室温封闭2 h,分别加I抗[抗p-IκB、NLRP3、caspase-1、NF-κB、GAPDH(胞浆蛋白内参照)和fibrillarin(胞核蛋白内参照)抗体,均1∶1 000稀释]4℃孵育过夜。然后加入HRP标记的II抗IgG(1∶2 000),室温孵育1 h。化学发光显影后采用ImageJ计算目的条带与内参条带灰度值的比值,即目的蛋白的相对表达量。
3 统计学处理
采用SPSS 19.0软件进行统计分析。所有数据用均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 姜黄素对MRL/lpr小鼠尿蛋白含量的影响
各组小鼠各时点尿蛋白含量比较结果显示,MRL/lpr组小鼠尿蛋白含量显著高于NC组,且随时间延长而升高(P<0.05);与MRL/lpr组比较,Cur组在处理后10和12周时的尿蛋白含量显著降低,且Cur-H组在12周时显著低于Cur-L组(P<0.05),见图1。
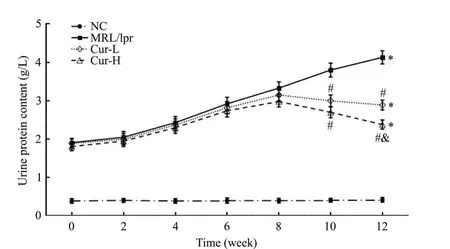
Figure 1. Comparison of urine protein content in each group at different time points.Mean±SD.n=10.*P<0.05 vs NC group;#P<0.05 vs MRL/lpr group;&P<0.05 vs Cur-L group.图1 各组小鼠不同时点尿蛋白含量的比较
2 姜黄素对MRL/lpr小鼠肾组织病理学变化的影响
各组小鼠肾组织HE染色结果显示,NC组肾脏结构清晰完整,未见增生和炎症细胞浸润;MRL/lpr组出现明显的肾小球系膜细胞增生,伴有炎症细胞浸润;与MRL/lpr组相比,Cur组系膜细胞增生、炎症细胞浸润得到不同程度的缓解,见图2A。同时,与NC组比较,MRL/lpr组肾小球增生比例和中性粒细胞浸润比例显著升高(P<0.05);Cur组肾小球增生比例和中性粒细胞浸润比例显著降低,且Cur-H组显著低于Cur-L组(P<0.05),见图2B、C。

Figure 2.The effect of Cur on pathological changes of renal tissues in MRL/lpr mice.A:HE staining of the renal tissues(scale bar=50µm);B:the percentages of glomerular proliferation;C:the percentages of neutrophil infiltration.Mean±SD.n=10.*P<0.05 vs NC group;#P<0.05 vs MRL/lpr group;&P<0.05 vs Cur-L group.图2 姜黄素对MRL/lpr小鼠肾组织病理学变化的影响
3 姜黄素对MRL/lpr小鼠肾功能指标及抗dsDNA的影响
与NC组相比,MRL/lpr组SCr、BUN及血清抗dsDNA水平显著增加(P<0.05);与MRL/lpr组相比,Cur组SCr、BUN及血清抗dsDNA水平显著降低,且Cur-H组显著低于Cur-L组(P<0.05),见表1。

表1 各组小鼠SCr、BUN及血清抗dsDNA水平的比较Table 1.Comparison of SCr,BUN and serum anti-dsDNA level in each group(Mean±SD.n=10)
4 姜黄素对MRL/lpr小鼠炎症因子水平的影响
与NC组比较,MRL/lpr组血清和肾组织中IL-1β、IL-6及 TNF-α 水平均显著升高(P<0.05);与MRL/lpr组比较,Cur组血清和肾组织中IL-1β、IL-6及TNF-α水平显著降低,且Cur-H组显著低于Cur-L组(P<0.05),见表2。
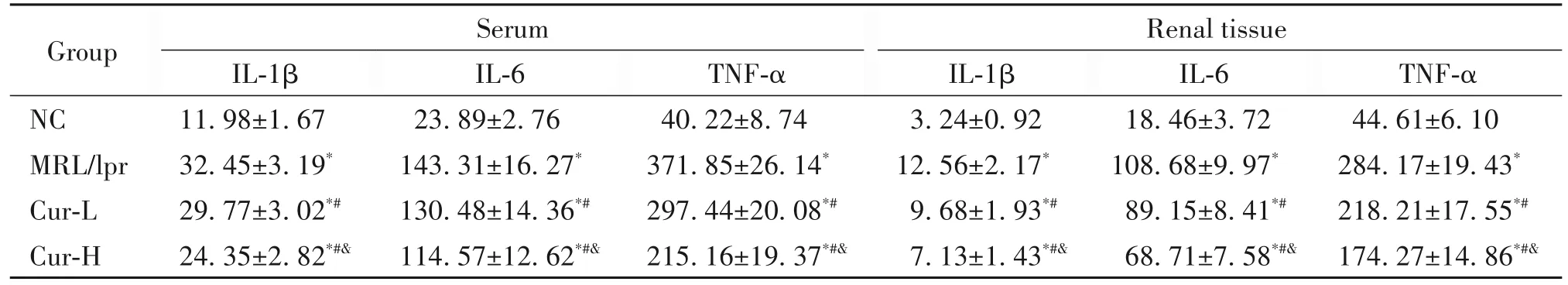
表2 各组小鼠血清及肾组织中IL-1β、IL-6及TNF-α水平的比较Table 2.Comparison of serum and kidney levels of IL-1β,IL-6 and TNF-α in the mice of each group(ng/L.Mean±SD.n=10)
5 姜黄素对NF-κB信号通路的影响
Western blot结果显示,与NC组比较,MRL/lpr组小鼠肾组织中p-IκB和NF-κB蛋白水平显著升高(P<0.05);与MRL/lpr组比较,Cur组小鼠肾组织中p-IκB和NF-κB蛋白水平显著降低,且Cur-H组显著低于Cur-L组(P<0.05),见图3。
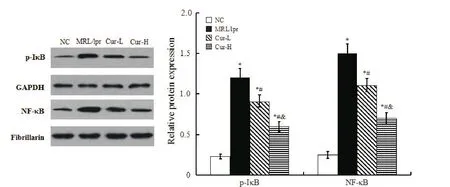
Figure 3.The effect of Cur on expression of NF-κB signaling pathway-related proteins.Mean±SD.n=10.*P<0.05vs NC group;#P<0.05 vs MRL/lpr group;&P<0.05 vs Cur-L group.图3 Cur对NF-κB信号通路相关蛋白的影响
6 姜黄素对NLRP3炎症信号通路表达的影响
与NC组相比,MRL/lpr组小鼠肾组织中NLRP3和caspase-1的蛋白水平显著升高(P<0.05);与MRL/lpr组比较,Cur组小鼠肾组织中NLRP3和caspase-1的蛋白水平显著降低,且Cur-H组显著低于Cur-L组(P<0.05),见图4。
讨 论
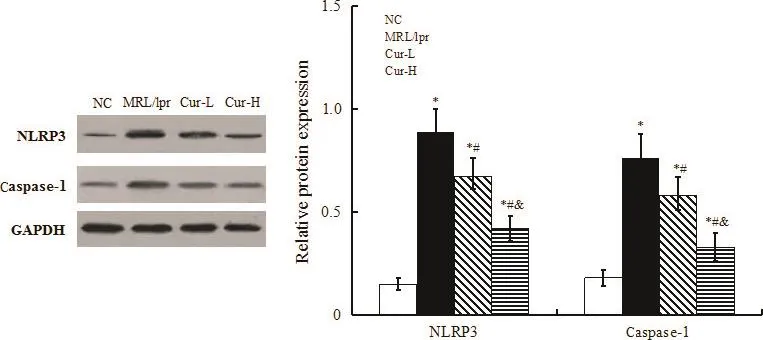
Figure 4.The effect of Cur on the protein expression of NLRP3 and caspase-1.Mean±SD.n=10.*P<0.05 vs NC group;#P<0.05 vs MRL/lpr group;&P<0.05 vs Cur-L group.图4 Cur对NLRP3和caspase-1蛋白表达的影响
LN是造成SLE患者死亡的主要原因之一,其治疗效果与SLE患者的远期预后及生存率密切相关[3,10]。目前临床上常用激素和免疫抑制剂治疗LN,以提高患者的生存率,但仍有部分患者的效果不佳或无效[4],临床仍迫切需要寻找新的治疗LN的有效药物。Cur是一种植物多酚,具有抗炎、抗氧化及抗纤维化等广泛的生物学活性,且被证实对肾损伤具有一定的保护作用[11-13]。Fan等[14]研究发现Cur可通过抑制Akt磷酸化,上调APPL1表达,进而保护缺血再灌注引起的急性肾损伤。本研究以MRL/lpr小鼠作为LN动物模型,结果发现Cur灌胃处理后MRL/lpr小鼠的尿蛋白、肾功能指标SCr和BUN水平均显著降低,且血清中SLE标志物抗dsDNA抗体显著减少,说明Cur能改善MRL/lpr小鼠的肾损伤。
NF-κB是一种重要的核转录因子,在炎症反应、应激反应及机体免疫反应中发挥重要调节作用[15]。多项研究表明NF-κB信号通路在感染、损伤或自身免疫等因素引起的肾炎中发挥重要作用[16]。研究显示MRL/lpr小鼠肾组织中NF-κB被激活,并伴随大量炎症因子的产生,而抑制NF-κB的激活能够改善MRL/lpr小鼠的肾损伤[17-18]。因此,NF-κB信号通路可作为治疗LN的潜在靶点。肇寅辉等[19]研究发现Cur可通过抑制NF-κB的表达,降低细胞炎症反应,减轻大鼠干热环境下的肾损伤。本研究结果显示,Cur处理后MRL/lpr小鼠肾组织中p-IκB和NF-κB的蛋白表达水平及血清和肾组织中的IL-1β、IL-6和TNF-α水平显著降低,同样表明Cur可通过抑制NF-κB的活化,减少其下游炎症因子的释放,从而发挥对LN的保护作用。此外,研究表明由NLRP3、ASC和caspase-1组成NLRP3炎症小体复合物也参与了LN的发生、发展[20]。多项研究表明NLRP3炎症小体复合物在MRL/lpr小鼠肾组织中表达上调,阻断NLRP3炎症小体,能降低蛋白尿水平、抑制自身抗体的产生、减少促炎症细胞因子IL-1β和IL-18的释放,减弱MRL/lpr小鼠LN发病的严重程度[21-22]。因此,抑制NLRP3炎症体的活化可能是治疗LN的新靶点。Lu等[23]研究发现Cur可以通过抑制NLRP3炎症小体活性来改善糖尿病肾病。本研究结果发现Cur处理能显著抑制MRL/lpr鼠肾组织中NLRP3和caspase-1的蛋白表达量,说明Cur处理能显著抑制抑制肾组织中NLRP3炎症小体的活化,抑制炎症反应,从而在LN中发挥保护作用。此外,还有研究表明抑制NF-κB的活化能抑制NLRP3的表达[24],但在MRL/lpr小鼠肾组织中NLRP3活化是否由NF-κB信号通路调控还需要进行更深入的研究。
综上所述,Cur对MRL/lpr小鼠具有显著的肾保护作用,其作用机制可能是与抑制NF-κB信号通路和NLRP3炎症小体的活化有关。本研究为LN的治疗提供了新的思路,初步揭示了Cur的作用机制,也为Cur的临床应用提供了一定的理论依据。

