腰椎间盘突出症大鼠模型的建立及病理动态研究
师振予 郭亦杰 曾嵘 郭建生 李鑫

〔摘要〕 目的 建立腰椎間盘突出症(lumbar disc herniation,LDH)大鼠模型,对建模后不同时间点模型效果进行动态比较以期发现建模后的最佳实验节点。方法 将48只Sprague-Dawley(SD)大鼠随机分为对照组(假手术组)、模型组,采用大鼠自体髓核移植法建立LDH大鼠模型。造模术后于不同时间节点(第7、14、21、28天)观察动物行为状态并随机处死动物后进行血清学和病理组织学检查。通过HE染色观察大鼠神经组织病理学的改变,采用ELISA法检测血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平。结果 (1)造模术后模型组和对照组(假手术组)大鼠均有明显的左后肢无力、跛行症状。术后第7天开始,对照组症状有恢复的趋势,并于第14天后基本恢复正常;模型组症状持续存在至术后第28天有好转趋势。(2)术后第7天对照组(假手术组)神经组织可见出血及炎症细胞浸润,但无神经损伤表现;模型组除可见出血及炎症细胞浸润还有神经受压表现。术后第14天开始对照组出血及炎症细胞浸润明显好转并于术后第21天基本恢复正常;而模型组术后第21天仍可见明显炎症细胞浸润、出现粘连及纤维化表现,并于术后第28天出现较明显的纤维化表现。(3)对照组大鼠TNF-α水平随时间进行明显下降。与对照组比较,模型组血清TNF-α水平在术后各个时间节点均显著升高(P<0.05)。结论 采用自体髓核移植法能有效地模拟建立LDH模型。造模术后第21天对照组基本恢复正常而模型组行为学表现、病理学检查及血清TNF-α水平与对照组比较均有明显差异,而在术后第21天之后模型组有恢复的趋势,说明造模术后第21天是比较合适的实验时间节点。
〔关键词〕 腰椎间盘突出症;大鼠模型;时间节点;肿瘤坏死因子-α
〔中图分类号〕R331;R681.5+3 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.01.007
〔Abstract〕 Objective To establish a rat model of lumbar disc herniation (LDH) and dynamically compare the effects of the models at different time points after modeling in order to find the best experimental node after modeling. Methods A total of 48 Sprague-Dawley (SD) rats were randomly divided into a control group (a sham operation group) and a model group. LDH rat model was established by autologous nucleus pulposus transplantation in rats. After modeling, the behavioral status of the animals was observed at different time points (days 7, 14, 21, and 28), and the animals were randomly sacrificed for serological and pathological examination. The pathological changes of the nerve tissue in rats were observed by HE staining, and the serum tumor necrosis factor-α (TNF-α) levels were measured by ELISA. Results (1) After modeling, the rats in the model group and the control group (the sham operation group) had obvious symptoms of weakness and lameness in the left hind limb. Starting from the 7th day after surgery, the symptoms in the control group showed a tendency to recover, and basically returned to normal after the 14th day. The symptoms in the model group continued to persist until the 28th day after surgery. (2) In the control group (the sham operation group), bleeding and inflammatory cell infiltration were seen in the control group (the sham operation group) on the 7th day after the operation, but no nerve damage was observed; in the model group, in addition to bleeding and inflammatory cell infiltration, there was nerve compression. On the 14th day after the operation, bleeding and inflammatory cell infiltration in the control group improved significantly and returned to normal on the 21st day after operation; while in the model group, obvious inflammatory cell infiltration, adhesion and fibrosis appeared on the 21st day after operation. On the 28th day after surgery, more obvious fibrosis appeared. (3) Serum TNF-α in the control group decreased significantly over time. Compared with the control group, serum TNF-α level of model group was significantly increased on each time points after modeling (P<0.05). Conclusion The adoption of autologous nucleus pulposus transplantation can effectively simulate the establishment of LDH model. The control group returned to normal on the 21st day after modeling, and the behavioral performance, pathological examination, and serum TNF-α levels of the model group were significantly different from those of the control group. However, the model group recovered after 21st day, the trend indicates that the 21st day after modeling is a more appropriate experimental time point.
〔Keywords〕 lumbar disc herniation; rat model; time point; tumor necrosis factor-α
腰椎间盘突出症(lumbar disc herniation,LDH)是一种发病率高且严重影响中老年人健康和生活质量的疾病[1],目前本病发生发展的生物学机制尚不明确。要探讨治疗LDH药物的作用和作用机制,复制与选择与临床相符合的动物模型至关重要。由于人类LDH主要是自发性疾病,是长期受到应力损伤或由于椎间盘退化,椎间盘细胞内环境变化后所逐渐发展起来的[2]。因此,运用损伤性方法建立动物模型来探讨治疗LDH药物疗效与机制的研究在过去十余年中并未取得十分突出的进展。不过由于要获得人类退化的椎间盘组织十分困难,同时在体外研究中也几乎不可能获得正常的人类椎间盘组织作为对照,因此,尽管存在一些限制,动物模型系统仍然是研究
LDH不可或缺的途径。本实验研究旨在建立一种合适的LDH动物模型,并对建模后不同时间点模型效果进行动态比较,以期发现建模后的最佳实验节点。
1 材料
1.1 动物
SPF级Sprague-Dawley(SD)大鼠,体质量(200±20)g,雌雄兼用,共48只。由湖南斯莱克景达实验动物有限公司提供。实验动物许可证号SCXK(湘)2009-0004。动物合格证号:HNSSLKJ20111549。
1.2 试剂
10%水合氯醛(天津科密欧化学试剂有限公司,批号:20110303);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(深圳雷杜生命科学股份有限公司,批号:201103);注射用青霉素钠(哈药集团制药总厂,批号:A100809310)。
1.3 仪器
SL系列手术放大镜(SLE2542,苏州捷美医疗器械有限公司);MP5001电子天平(上海舜宇恒平有限公司);LG10-2.4A高速离心机(北京医用离心机厂);RT-6000酶标仪(深圳雷杜生命科学股份有限公司);LEICA DMLB2双目显微镜(德国LEICA公司);Shandon325型石蜡切片机(英国Shandon公司);Motic B5显微摄像系统(麦克奥迪实业集团公司)。
2 方法
2.1 动物分组与模型建立
48只大鼠随机分为对照组(假手术组)及模型组,每组24只,雌雄各半。将模型组大鼠术前12 h禁食、不禁水,10%水合氯醛3 mL/kg腹腔注射麻醉,于尾根部距肛门约1 cm 处切断鼠尾并缝合伤口。在切断鼠尾前用橡皮条结扎切口的近端以减少出血。无菌条件下于背部正中切开皮肤(长约4 cm)、皮下组织,从左侧棘突上钝性分离椎旁肌,以双侧髂棘为定位点,切除髂棘以上两个椎体的棘突、左侧椎板和关节突。在手术显微镜下暴露左侧的硬脊膜,确认出左侧脊神经,取切下的鼠尾部的呈胶冻样椎间盘髓核5个(约10 mg)轻放于左侧神经根背侧周围,仔细止血后逐层关闭切口,术后再次用碘酒和75%酒精消毒皮肤并单笼喂养12 h后放回原笼。对照组(假手术组)仅切断鼠尾,分离椎旁肌,切除髂棘以上两个椎体的棘突、左侧椎板和关节突。大鼠术后连续3 d腹腔注射青霉素钠2×105 U/kg,每天1次。
2.2 标本采集
术后分别于第7、14、21、28天随机处死1/4动物(每次每组6只,雌雄各半),断头取血,在3 000 r/min速度下离心15 min,吸取上清备用。同时取神经节、神经根和脊椎组织,4%中性甲醛固定,5%硝酸脱钙后对神经节、神经根和脊椎组织按纵和横2个面进行修块。
2.3 大鼠行为学观察
采用Siegal T[3]推荐的神经功能判断六级分法(见表1),分别于造模术后第3、7、14、21、28天观察,每天2次。采用神经功能分值进行统计分析(t检验),0级-2分,1级-4分,2级-6分,3级-8分,4级-10分,5级-12分。
2.4 神经节、神经根和脊椎组织病理学检查
将标本浸入10%中性福爾马林固定液中固定48 h,各级酒精梯度脱水,石蜡包埋,石蜡切片机上切成4 μm石蜡切片,将切片置于58 ℃烤箱中烘烤18 h,行HE染色,用Motic B5显微摄像系统观察并摄影记录结果。
2.5 ELISA法测定血清TNF-α含量
严格按照ELISA试剂盒说明书步骤测定两组大鼠血清TNF-α含量:用RT-6000酶标仪于450 nm波长测定血清样本吸光度值,根据标准品浓度及对应的吸光度值,计算标准曲线的直线回归方程,再根据样本的吸光度值,在回归方程上计算出对应的血清TNF-α含量。
2.6 统计学处理
所有数据采用SPSS 17.0软件进行分析,计数资料采用秩和检验,计量资料以“x±s”表示,采用t检验及方差分析。P<0.05为差异有统计学意义。
3 结果
3.1 行为学观察
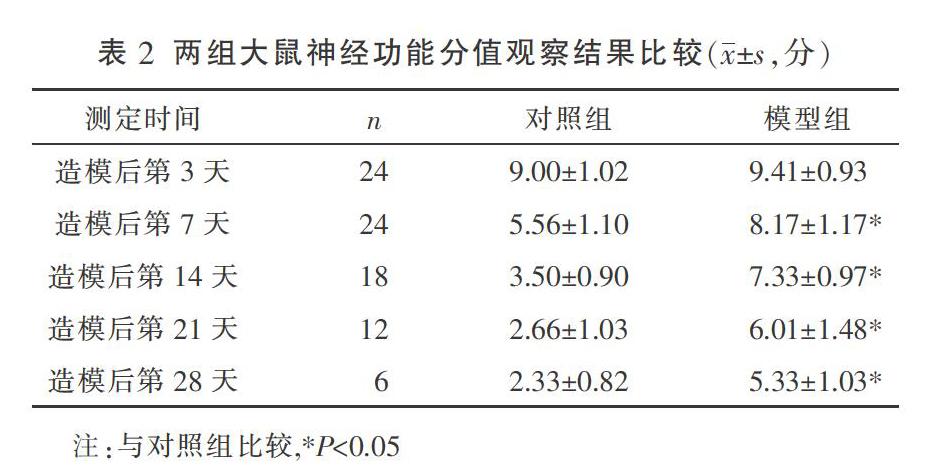
麻醉苏醒后两组大鼠均有蜷缩,少动的表现,但无瘫痪鼠。术后第3天,两组均有明显症状,神经功能评分均在3级以上;术后第7天,对照组有恢复的趋势,模型组仍有明显症状;术后第14天,对照组明显好转,模型组稍有好转;术后第21天,对照组基本恢复正常而模型组症状持续;术后第28天,对照组恢复正常,模型组症状好转。术后第7天开始,与对照组比较,模型组神经功能分值在各个时间节点均显著升高(P<0.05)。见表2。
3.2 神经及神经节病理学改变
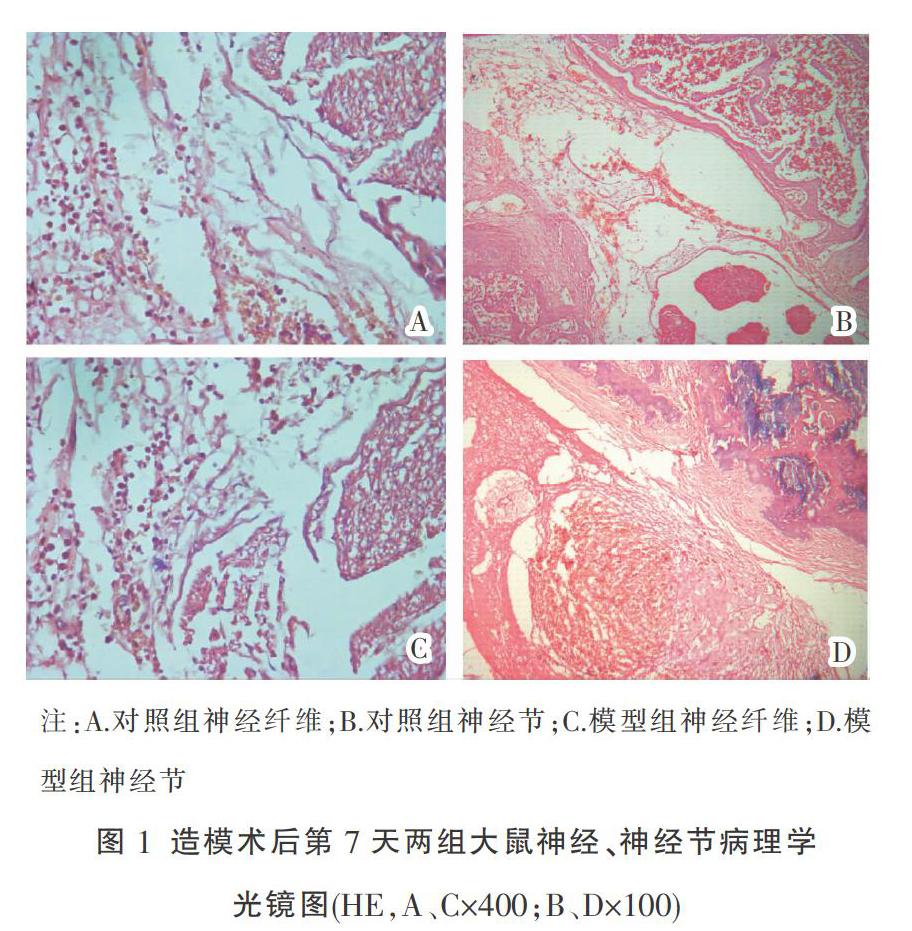
造模术后第7天,对照组(假手术组)神经节及神经根周围小血管扩张充血,神经组织内可见小静脉扩张充血,神经组织水肿,炎性细胞浸润,但未见神经束受压表现。模型组可见出血及炎症细胞细胞浸润,同时有神经受压表现。见图1。
造模术后第14天时,对照组出血及炎症细胞细胞浸润明显好转,神经元轻度水肿;模型组显示较明显的炎性细胞浸润,浸润的炎性细胞以中性粒细胞、巨噬细胞为主。神经组织肿胀明显、神经髓鞘肿胀、碎裂,轴突肿胀或消失,许旺氏细胞自溶、软化。见图2。
造模术后第21天,对照组炎症细胞细胞浸润明显好转及其他炎症表现基本恢复正常,模型组仍显示较明显的炎性细胞浸润。同时出现有成纤维细胞浸润,神经部分纤维化表现。见图3。
造模术后第28天,对照组炎症细胞细胞浸润明显好转及其他炎症表现基本恢复正常,模型组炎症细胞细胞浸润减弱,受压神经纤维组织及周围组织明显增生,神经纤维组织内有肉芽组织形成纤维间隙缩小,轻度瘢痕化,受压神经表现出明显的纤维化。见图4。
3.3 大鼠血清TNF-α表达的变化
对照组大鼠TNF-α表达随时间进行明显下降。造模术后第7天开始模型组血清中TNF-α含量高于对照组。术后第14天开始,与对照组比较,模型组血清中TNF-α含量在各个时间节点均显著升高(P<0.05)。结果见表3。
4 讨论
研究表明,多种大、小动物椎间盘的解剖学和生物力学特点都基本与人类相似,并可采取合适的模式模拟人类椎间盘退化的过程[4-5]。大小动物在构建模型上各有优缺点,Beckstein J C[6]详细比较了7种哺乳动物牛、猪、狒狒、羊、兔、大鼠和小鼠通过压缩椎间盘造模后出现的椎间盘轴向力学变化以及椎间盘中蛋白多糖含量的变化,结果发现不同动物的力学参数变化往往并没有出现显著差异,同时椎间盘中蛋白多糖和水含量的变化也表现出相似性,但不同物种出现退变所需的时间有显著差异。因此,相较于大动物难以饲养且昂贵等缺点,小动物造模虽然观察和取材较困难,但仍具有一定的优势。
常用的LDH模方法主要有自发性模型和诱发性模型两类。使用自发性椎间盘突出动物模型实验周期长、动物种类少,且难以确切估计模型成功时间,故较少应用。目前主要使用的模型仍是诱发性模型,例如从神经根受到慢性压迫的角度进行造模研究。此种造模方法能比较好地再现椎间盘突出症引起神经压迫症状的过程,特别是随着椎间盘突出症发病机制中自身免疫学说研究的深入,自体髓核移植法造模逐渐成为目前主流的造模方法。自体髓核移植法的基本思路是将实验动物自身的髓核取出,通过注射或手术等法将其移植至脊神经根和硬脊膜之間,从而模拟出LDH所致的症状。该法与LDH的病理生理机制基本吻合,目前广泛应用于LDH的发病机制以及神经递质和炎症因子甚至是一些药物和治疗手段作用机制的研究中[7]。越来越多的研究表明,自身免疫的异常在椎间盘突出症所致的常见症状如腰痛和下肢根性神经痛发生发展中起着十分重要的作用[8-9],故采取自体髓核移植法能较好地模拟椎间盘突出症的病理生理机制。
自身免疫反应活化过程包括抗原捕获、原型辅助性T(Th)细胞的活化和最终自身抗体的产生。其中Th细胞的活化是自身免疫系统激活过程中十分重要的途径,原型Th细胞活化后主要分化为产生干扰素-γ(IFN-γ)为主Th-1(I型辅助T细胞)细胞和产生白细胞介素-4(IL-4)为主的Th-2(II型辅助T细胞)细胞,Geiss A等[10]在对自体髓核引起免疫反应的研究中发现,在猪自体髓核突出模型中自体髓核“接触”免疫系统3周后能够促使原型Th细胞主要转变为产生IL-4为主的Th-2型细胞。IL-4是十分重要的细胞因子,能促使B淋巴细胞活化并上调II型主要组织兼容性复合体(majorhistocompatibility complexII,MHC II)的表达[11],同时IL-4也能促使巨噬细胞转换为修复型巨噬细胞(M2细胞)从而促进与创面修复和纤维化,此项研究提示自体髓核在暴露于免疫系统后能促使免疫反应的发生从而诱发炎症反应。同时研究也发现在猪皮下植入含自体髓核的钛囊后,与空白组相比含自体髓核的钛囊中活化T细胞(CD4和CD8)比例明显较高,表达免疫球蛋白的活化B细胞也明显增高,该研究提示自体髓核能促进T、B细胞的活化[12]。李晖等[13]研究也证实破碎型LDH标本中有T淋巴细胞浸润和免疫球蛋白IgG、IgM沉积,因而其病理机制可能是在损伤基础上的自免疫炎症反应过程,而完整型腰椎间盘突出以髓核退变、软骨基质及纤维环增生为主要表现,但没有发现免疫应答反应。
因此,本研究采用比较成熟的自体髓核移植法构建模型,在手术显微镜下成功将从鼠尾部取出的自体髓核移植至脊神经根和硬脊膜之间,成功建立了LDH模型。在造模术后第3天对照组(假手术组)与模型组均有明显症状,但术后第7天开始假手术组逐渐恢复而模型组仍有明显症状并直至术后第21天仍有明显症状;病理检查也显示在植入髓核后对照组与模型组的病理结果有显著性差异,病理学和行为学观察结果均支持模型效果。同时,多项研究已证实TNF-α是髓核突出后引起炎症反应的标志性因子,且与炎症反应所致疼痛密切相关[14-15]。能直接抑制TNF-α的药物Etanercep已开始应用于临床治疗椎间盘突出症所致症状[16],Horii M等[17]发现,在直接穿刺损伤大鼠椎间盘后即可出现大鼠背根神经节中降钙素基因相关肽(calcitonin gene-related peptide, CGRP)的表达增高,而Etanercep能迅速下调CGRP的表达,此途径可能是Etanercep的治疗机制。因此,我们选取测定血清中TNF-α的表达来验证模型的效果,结果显示,对照组TNF-α的表达随时间进行明显下降而模型组未见此种趋势,模型组TNF-α的表达在各个时间节点均显著高于对照组,说明通过移植自体髓核造模后成功诱导出了自身免疫性炎症反应。
炎性介质、细胞因子既是髓核退变、椎间盘突出后的病理产物,又是进一步促进退变、导致临床症状的致病因素。从细胞和分子水平,从细胞因子、炎症介质表达、自身免疫调节等多角度对药物治疗椎间盘突出症的有效性和作用机制进行深入细致的探讨对丰富传统中药治疗LDH的科学依据具有重要的意义。为了获得最佳实验效果,我们在此次模型研究中设计了对不同时间点模型效果的动态观察,以期获得建模后的最佳实验时间点。结果显示,在造模术后第21天对照组行为学症状和病理检查基本恢复正常而模型组在行为学表现、病理学检查及血清TNF-α表达上与对照组比较均有较大差异;而此后模型组开始有恢复的趋势。目前国内尚未见此类模型效果研究,Souza等[18]在自体髓核诱导的炎症细胞因子表达和痛觉阈值与时间相关性的研究中发现,自体髓核移植后表达水平最高的细胞因子是TNF-α、IL-1β和细胞因子诱导的中性粒细胞趋化因子-1(cytokine-induced neutrophil chemoattractant-1,CINC-1)且炎症因子表达水平和痛阈与植入时间呈正相关:植入7 d后大鼠细胞因子表达水平及痛阈值与对照组基本相当,但植入21 d细胞因子表达水平及痛阈值及显著高于对照组。我们的研究结果与其相似。综上所述,选取造模术后第21天作为LDH模型观察时间可能是比较药物疗效及机制比较合适的实验时间节点。
参考文献
[1] 王 峣,徐志杰,李海昕,等.慢性腰痛生物学治疗的研究进展[J].中国骨与关节杂志,2018,7(6):449-453.
[2] 苏少亭,周红海,梁 栋,等.腰椎关节突关节的生物力学研究进展[J].中国脊柱脊髓杂志,2017,27(5):474-479.
[3] SIEGAL T, SHOHAMI E, SHAPIRA Y, et al. Indomethacin and dexamethasone treatment in experimental neoplastic spinal cord compression[J]. Neurosurgery, 1988, 22(2):334-339.
[4] OCONNELL G D, VRESILOVIC E J, ELLIOTT D M. Comparison of animals used in disc research to human lumbar disc geometry[J]. Spine, 2007, 32(3): 328-333.
[5] SHOWALTER B L, BECKSTEIN J C, MARTIN J T, et al. Comparison of animal discs used in disc research to human lumbar disc: torsion mechanics and collagen content[J]. Spine, 2012, 37(15): E900-907.
[6] BECKSTEIN J C, SEN S, SCHAER T P, et al. Comparison of animal discs used in disc research to human lumbar disc: axial compression mechanics and glycosaminoglycan content[J]. Spine, 2008, 33(6): E166-173.
[7] 李慧莹,单志婧,翟志超,等.腰椎間盘突出症动物模型的研究进展[J].中国疼痛医学杂志,2015,21(1):64-66,68.
[8] 楚福明,董思佳,吴 忌,等.活血化瘀药物治疗腰椎间盘突出症免疫机制研究[J].云南中医中药杂志,2018,39(7):34-35.
[9] 刘振刚,卢一生,施建东,等.腰椎间盘突出症和椎间盘源性疼痛的免疫病理学研究[J].颈腰痛杂志,2016,37(4):272-275.
[10] GEISS A, LARSSON K, JUNEVIK K, et al. Autologous nucleus pulposus primes T cells to develop into interleukin-4-producing effector cells: an experimental study on the autoimmune properties of nucleus pulposus[J]. Journal of Orthopaedic Research, 2009, 27(1): 97-103.
[11] SOKOL C L, BARTON G M, FARR A G, et al. A mechanism for the initiation of allergen-induced T helper type 2 responses[J]. Nature Immunology, 2008,9(3):310-318.
[12] GEISS A, LARSSON K, RYDEVIK B, et al. Autoimmune properties of nucleus pulposus: an experimental study in pigs[J]. Spine, 2007, 32(2):168-173.
[13] 李 晖,马信龙,王 沛,等.腰椎间盘突出症的免疫病理学研究[J].中华骨科杂志,2007,27(5):778-780.
[14] 王 敏,李海燕,苏仁强,等.腰六俞穴位埋线结合导引术和腰腿痹通胶囊对腰椎间盘突出症患者血清肿瘤坏死因子-α和一氧化氮的影响[J].湖北中医药大学学报,2016,18(5):15-17.
[15] 张潇潇,姜 宏,张志刚,等.肿瘤坏死因子与腰椎间盘退变的相关性研究进展[J].中国中医骨伤科杂志,2017,25(12):79-82.
[16] SINCLAIR S M, SHAMJI M F, CHEN J, et al. Attenuation of inflammatory events in human intervertebral disc cells with a tumor necrosis factor antagonist[J]. Spine, 2011, 36(15):1190-1196.
[17] HORII M, ORITA S, NAGATA M, et al. Direct application of the tumor necrosis factor-α inhibitor, etanercept, into a punctured intervertebral disc decreases calcitonin gene-related peptide expression in rat dorsal root ganglion neurons[J]. Spine, 2011,36(2):E80-85.
[18] SOUZA GRAVA A L, FERRARI L F, DEFINO H L. Cytokine inhibition and time-related influence of inflammatory stimuli on the hyperalgesia induced by the nucleus pulposus[J]. European Spine Journal, 2012, 21(3): 537-545.
(本文编辑 杨 瑛)

