亲子鉴定实验用于评估产前诊断中母体细胞污染的研究*
严爱贞,林炎鸿,李晓丽,余秀蓉,林 娟,兰风华
(联勤保障部队第九〇〇医院临床遗传与实验医学科,福建福州 350025)
产前分子诊断技术现已广泛应用于单基因遗传病的诊断。尽管应用母体外周血中游离的胎儿DNA进行非侵入性检测及植入前产前诊断已出现[1-3],但侵入性产前诊断仍然为产前发现异常胎儿的有效手段。侵入性取样是通过在孕早期绒毛穿刺或孕中期羊水穿刺进行产前诊断,这种操作增加了母体细胞污染(MCC)的风险。由于基因扩增的高度敏感性,即使微量的母体污染都可能干扰基因诊断结果,也增加了产前诊断误诊的风险。2006年美国医学遗传学协会(ACMG)公布进行产前诊断的实验规范,并确立了实验指南[4]。2008年,英国临床分子遗传学协会(CMGS)要求所有单基因病的产前诊断都应该进行MCC鉴定,且产前诊断报告中应包含 MCC检测报告[5]。因此,检测所取胎儿标本是否存在MCC是产前诊断分子遗传实验室必须具备的鉴别技术。本研究对产前诊断孕妇孕中期羊水标本进行MCC检测,将亲子鉴定实验应用于遗传病基因检测前,以评估羊水标本受母体细胞污染的程度。
1 资料与方法
1.1一般资料 选取2005-2019年因单基因遗传病高风险来本实验室行产前诊断的孕妇共137例,孕期18~24周。抽取孕妇孕中期羊水标本,均无肉眼可见母血污染。同时抽取孕妇及所有家系成员EDTA抗凝的外周血,每人2 mL。以上家系检测前均接受遗传咨询并签署知情同意书。
1.2方法
1.2.1羊水采集和羊水细胞培养 在B超引导下,由本院产科医生按常规方法抽取入选孕妇羊水(每人20~40 mL)置于无菌容器中,并立即送检。每份羊水分成两部分:一部分直接提取DNA,另一部分加入适量AminMAX培养基,置于37 ℃、5%CO2湿润环境进行羊水细胞培养。
1.2.2羊水细胞或外周血DNA提取 使用QIAamp®DNA Kit(QIAGEN公司,德国)或Chelex-100方法提取DNA,用紫外线分光光度计NanoDrop-2000仪(Thermo公司,美国)测定其浓度及吸光度(A)值(A260/A280≈1.8)。
1.2.3短串联重复序列位点分析 采用Identifiler系统(ABI公司,美国),对羊水及其父母外周血基因组DNA进行扩增分析。包含的15个常染色体STR基因座(D3S1358、D13S317、D16S539、D18S51、D2S1338、CSF1PO、TH01、vWA、D21S11、D7S820、D5S818、TPOX、D8S1179、D19S433、FGA)和1个性别牙釉质蛋白Amelogenin基因座进行基因分型。反应体系总体积为12.5 μL,内含PCR Reaction mix 5.25 μL,Identifiler Primer Set 2.75 μL,Golden Taq 0.25 μL,DNA 5 μL(约0.5 ng)。扩增循环参数:95 ℃预变性11 min,94 ℃ 1 min,59 ℃ 1 min,72 ℃ 1 min,共28个循环,60 ℃ 1 h,4 ℃避光保存。
1.2.4PCR产物的检测及结果分析 取2 μL PCR 产物(或1 μL Ladder),加入12 μL高度去离子甲酰胺(Hi-Di)及0.5 μL GS-500LIZ,充分混匀,于95 ℃变性2 min,冰浴4 min。将变性冷却后的产物置于ABI3130遗传分析仪行毛细管电泳及荧光检测,Data Collection3.0电泳数据,GeneMapperID 3.2基因分型,识别STR基因型及峰高。
1.2.5检测敏感性实验 对已知等位基因分型的4对亲生母子的8份血液标本分别提取纯DNA,并进行浓度及A260/A280值测定,通过用母亲污染孩子(胎儿)DNA标本,产生了混合基因组DNA。混合标本模拟2.5%、5.0%、10.0%、20.0%、30.0%、40.0%的MCC水平,稀释到0.5 ng/μL,用Identifiler体系扩增,评估该方法检测MCC的敏感性。
2 结 果
2.1混合样品检测实验分析结果 参照法医个体识别和混合标本鉴别的方法,以荧光吸收峰表示每一基因座的等位基因,单一样品,纯合子基因座仅有一个峰,杂合子有2个峰。混合样品,会出现复杂的STR图谱。不同比例混合的样品会出现峰高不平衡现象且组分的比例越悬殊,峰高差异越显著。对24个二组分混合样品进行分析,结果显示,在6个不同稀释比例的标本中,4组模型中5.0%以上稀释比例的标本均能检测到母源性峰(图1),当混合比例为5.0%时,其部分等位基因已消失,其峰高已接近“Stutter”峰高,鉴别时注意区分[6];当混合比例为2.5%时,已完全检测不到。可见该方法检测MCC的灵敏度为5.0%。
2.2Identifiler体系排除MCC结果判断 根据峰出现数目分析,因胎儿有一个基因型来自母亲,另一个来自父亲,如果羊水中存在MCC,母亲和胎儿之间共有的等位基因对MCC判定来说是毫无意义的。当几个基因座存在3个峰型,即母亲独有等位基因(污染等位基因)出现在羊水DNA中,即可判断为存在MCC,根据母亲独有基因型峰高/胎儿独有基因型峰高×100%,可以估算MCC程度,见图2。
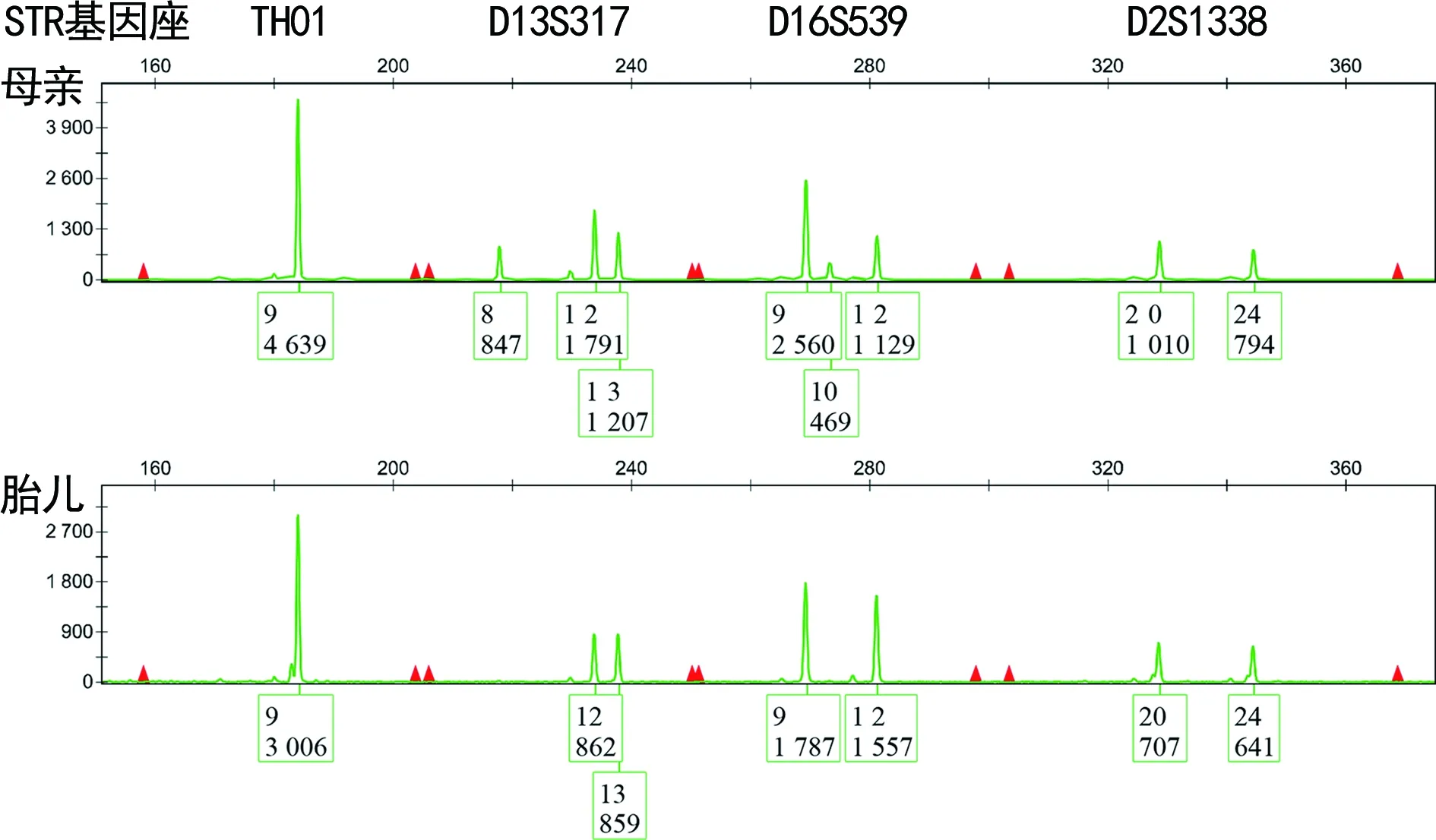
注:THO1和D2S1338基因座是无意义的,黑色箭头所示P为Stutter峰,S为母亲、胎儿共有等位基因,C为母亲独有等位基因,N为胎儿独有等位基因。
2.3羊水细胞DNA检测结果与随访结果 共实施137例单基因遗传病高风险家系的产前诊断,对羊水细胞基因组DNA、胎儿父母亲基因组DNA作亲子鉴定实验,鉴定结果显示男性胎儿76例,女性胎儿61例;未发现存在MCC的羊水标本。诊断结果为异常胎儿基因型有35例,占25.6%,建议终止妊娠,其中11例接受引产后留脐带血复查,结果与产前一致;102例为正常或隐性携带者,随访出生后未见疾病表现,其中121例取脐带血复查,结果也与产前一致。另外,共发现先证者基因型不符合孟德尔遗传定律4例,均证实为亲生关系。
3 讨 论
亲子鉴定技术是多重PCR技术和荧光标记技术的结合,能够实现在一个单管中同时扩增出多个人类短串联重复序列(STR)基因座(又称微卫星DNA),其突出特点是基因座多,片段短,多态性高,在法医学亲子鉴定和个体识别、人类起源和进化、遗传性疾病的诊断中具有广泛的应用价值[7]。本实验室自2004年采用法医亲子鉴定Identifiler系统对产前诊断中MCC程度进行筛查,是国内较早将亲子鉴定实验应用到遗传病产前分子诊断中的医院[8]。有研究数据表明,在产前羊水标本中MCC是普遍存在的,其中0.3%~1.3%的羊水标本污染比例可达20%以上[9]。较高的MCC可能导致不确定的结果或严重的妊娠结局,需要进行额外的侵入性操作,而每一次操作都会增加流产的风险,因此通过MCC检测可为培养后标本的可用性提供机会[10]。
侵入性产前诊断主要适应证有:(1)已知先证者突变,可直接检测胎儿是否遗传该特有突变;(2)胎儿超声检查结果提示有遗传性疾病风险,并要求进行基因检测以确定诊断结果。不同病种采用的检测技术可能存在差异,MCC对于产前诊断结果的影响程度,取决于疾病的分子遗传学特征及产前诊断所使用的技术方法。本研究的产前病例均为前一种情况,主要采用Sanger测序和多重连接依赖探针扩增(MLPA)[11]的检测技术。研究数据显示,分子检测技术本身的灵敏度与MCC检测的灵敏度之间存在差异,Sanger测序对MCC的灵敏度限制在5%~30%,相较于MLPA,当存在较高比例的MCC(≥40%)时才会导致诊断的不确定性[12]。侯巧芳等[13]也认为,对于基于PCR的基因分析,10%及以上的MCC即可能对检测结果产生干扰,30%的MCC容易导致错误的诊断结果。本研究所采用的Identifiler系统[14-15]是选用16个STR基因座的鉴定体系,是以检测灵敏度为5.0%以上的污染比例为基础的,明显高于Sanger测序和MLPA方法的报告敏感性,完全可以达到排除MCC干扰的目的。本研究以单基因遗传病高风险家系为研究对象,对137例均无可见母血污染的羊水标本,进行MCC筛查,均未发现存在MCC污染,与其他同类报道存在差异[13,16]。这可能与本研究在收集羊水标本时丢弃最初的2 mL羊水的做法有关,由此证明该方法可以极大降低MCC的风险[16],但也可能与本研究的病例数较少有关。
实际上在产前分子诊断中,由于遗传方式不同、母亲是否为携带者或胎儿性别等情况,鉴定胎儿是否是患者还是携带者会出现多种复杂的可能情况。如常染色体隐性遗传病,父母双方均为无症状携带者,遗传给下一代就可能发病。MCC对于正常或仅父源突变携带者的胎儿无明显影响,但是当检测到胎儿存在母源性突变时,却增加了正常胎儿被误判为携带者或异常胎儿的风险;尤其是在显性/X连锁遗传病诊断中,当母亲为致病基因携带者时,则必须筛查母体污染,以排除母体基因型的干扰,以免影响基因诊断结果,造成严重后果。
本研究共检测137例产前诊断病例,其中常染色体隐性遗传病例84例,占大部分;其次为X-连锁遗传和显性遗传病例分别为37例和16例。通过应用亲子鉴定技术检测产前诊断标本的MCC污染,所检测的异常胎儿基因型有35例,占25.6%,受检夫妇均选择终止妊娠,其中仅31例接受引产后留脐带血做复查,结果与产前一致;102例为正常或隐性携带者,随访出生后未见疾病表现,其中90例取脐带血做复查,结果与产前一致。此外,在对先证者及其父母进行家系筛查的过程中,发现4例先证者基因型不符合孟德尔遗传定律,通过亲子鉴定实验,证实均存在亲生血缘关系,考虑先证者为新发突变,而同样的新发变异可能在孕妇新的妊娠中复发并导致下一个孩子也受到影响,二者具有很高的实际相关性。因此,需要针对这种复发性风险进行评估,并对孕妇及家属进行充分的告知。 本实验室自2005年起将亲子鉴定实验应用于遗传病产前诊断中,并建立了基于该方法检测微量MCC的产前标本质量评估流程(图3)。本研究结果显示,在进行侵入性操作时,经验丰富的产科医生及规范化操作是保证产前标本足够纯度的重要前提。同时,在常规进行MCC排除鉴定时,应同时对父、母体DNA进行检测并作为对照。此外,进行性别位点鉴定可以增加判断性连锁遗传病产前诊断结果的准确性,指导患某些代谢性遗传病(如21-羟化酶缺陷症)的胎儿进行宫内干预治疗。

图3 产前标本基因诊断质量评估流程
4 结 论
本研究采用亲子鉴定实验对有创标本的MCC进行鉴定,为多种单基因遗传病实现了准确的产前诊断,证实了亲子鉴定实验是一种快速确定胎儿身份和评估MCC的有效方法,对提高产前诊断的准确性和指导临床治疗具有重要意义。

