后交通动脉动脉瘤伴动眼神经麻痹的形态学危险因素分析
赵飞龙, 王 斌, 祖庆泉, 赵林波, 贾振宇, 周 春, 刘兴龙, 施海彬,刘 圣
后交通动脉(posterior communicating artery,PComA)是颅内动脉瘤最常见部位之一,约占所有颅内动脉瘤15.5%[1]。 未破裂颅内动脉瘤自然病程相关研究结果表明,PComA 动脉瘤较颅内其他部位动脉瘤更易发生破裂出血[1-2], 致残率和致死率较高。 因此对高风险PComA 动脉瘤进行治疗具有重要临床意义。既往文献报道30%~50%PComA 动脉瘤患者会出现动眼神经麻痹(oculomotor nerve palsy,ONP)症状[3-4],通常被认为是动脉瘤破裂的前兆症状, 是需要准确评估和积极干预的重要依据。本研究分析未破裂PComA 动脉瘤引起同侧ONP形态学危险因素,筛选出具有高破裂风险的未破裂PComA 动脉瘤, 进一步为临床治疗方案提供依据。
1 材料与方法
1.1 研究对象
回顾性收集2010 年1 月至2018 年10 月在南京医科大学第一附属医院接受脑血管造影和治疗的颅内动脉瘤患者临床资料, 其中71 例确诊为单侧、单发、未破裂PComA 动脉瘤患者,纳入本研究并进行动脉瘤形态学分析。 ONP 诊断标准为:①上眼睑下垂;②眼外肌麻痹;③复视;④瞳孔散大,直接和对光反射减弱或消失。 上述症状出现1 条或多条即判定为ONP。 排除标准:既往有蛛网膜下腔出血病史、破裂动脉瘤、多发动脉瘤、外伤性动脉瘤、夹层动脉瘤及梭形动脉瘤。
1.2 形态学参数测定
根据DSA 造影后三维重建图像,测量相关动脉瘤形态学参数,如动脉瘤大小、瘤颈宽度、纵横比(aspect ratio, AR)、 动脉瘤直径与载瘤动脉平均直径比(size ratio, SR)、瓶颈指数(bottle neck,BN)、径颈比、长宽比、瘤顶指向及有无子囊。
形态学参数定义[5-6]:①动脉瘤大小——瘤体最大径。 ②AR——动脉瘤高(瘤颈平面至瘤体最远点垂直距离)与瘤颈比值。 ③SR——动脉瘤直径指瘤颈中心至动脉瘤最远距离, 载瘤动脉平均直径=(D1a+D1b+D2a+D2b+D3a+D3b)/6, 其中D1a、D2a、D3a 分别为瘤颈处载瘤动脉直径,D1b、D2b、D3b 分别表示1.5D1a、1.5D2a、1.5D3a 处载瘤动脉直径。 ④BN——动脉瘤宽与瘤颈比值。⑤径颈比——动脉瘤最大径与瘤颈比值。 ⑥长宽比——动脉瘤高与宽比值, 宽指平行瘤颈的瘤体最大距离。 ⑦瘤顶指向——3D 脑血管标准正位造影图像(RAO 0°或LAO 0°)上,PComA 与颈内动脉交点作一平行线,瘤顶位于平行线以上指动脉瘤向上生长,位于平行线以下指向下生长;PComA 与颈内动脉交点作一垂直线,瘤顶位于垂直线以内指向内生长,位于垂直线以外指向外生长;RAO 90°或LAO 90°时,确定向前或向后生长。 见图1。
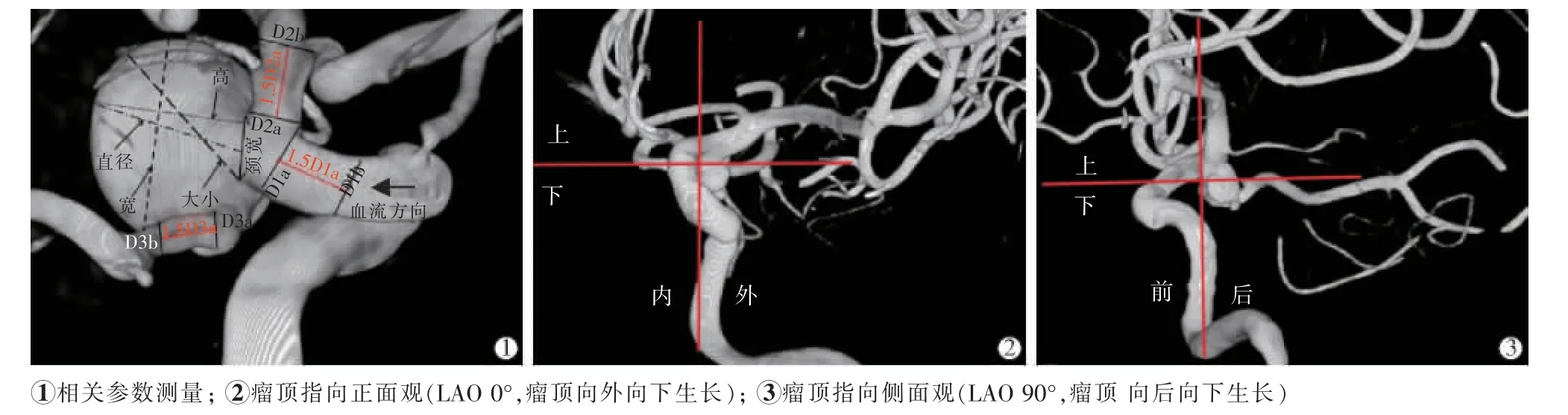
图1 动脉瘤相关参数测量示意图
1.3 统计学分析
采用SPSS 21.0 软件进行统计学分析。 计量资料用t 检验分析或秩和检验,以均数±标准差(±s)表示; 计数资料用χ2检验或Fisher 确切概率法;对单因素有统计学差异的形态学参数进一步以多因素logistic 回归法分析危险因素。 P<0.05 表示差异有统计学意义。
2 结果
2.1 患者一般资料
71 例患者中男16 例,女55 例,平均年龄62 岁;PComA 动脉瘤伴ONP 31 例(ONP 组),不伴ONP 40例(非ONP 组),两组患者基本资料差异无统计学意义(表1)。ONP 组患者均接受治疗,其中血管内栓塞27 例,外科夹闭4 例;非ONP 组患者中32 例接受治疗,其中血管内栓塞26 例,外科夹闭6 例。 ONP组27 例血管内栓塞治疗患者均接受DSA 或MRA随访检查,其中6 例有瘤颈残留,其余无复发迹象;后期获住院或电话随访的24 例中23 例ONP 完全或部分缓解,1 例ONP 无好转。
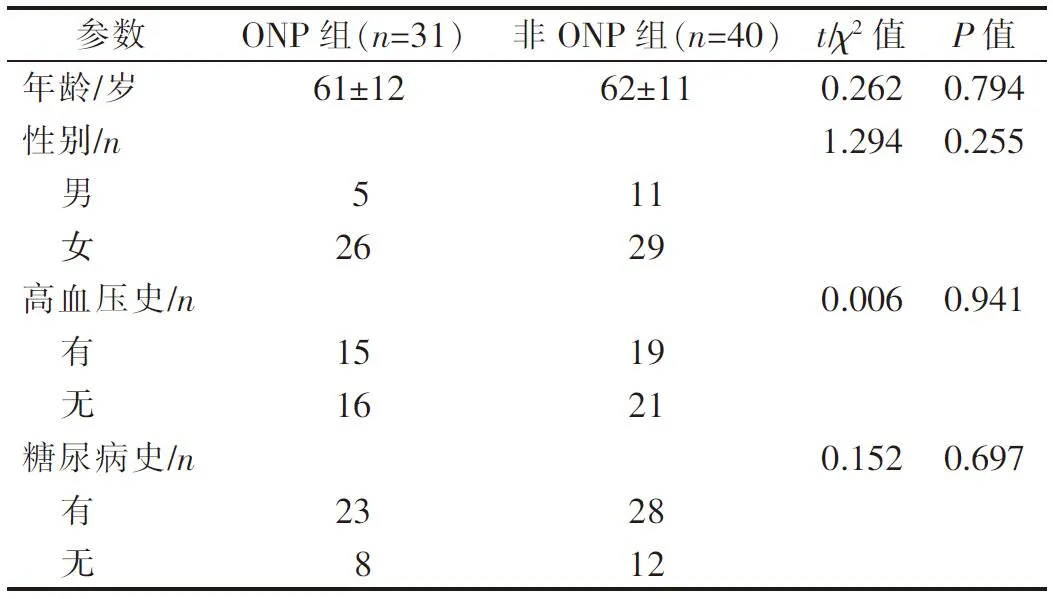
表1 两组患者基本资料比较
2.2 动脉瘤形态学分析
单因素分析形态学参数显示,ONP 组与非ONP 组患者动脉瘤瘤颈宽度(P=0.046)、 有无子囊(P=0.002)、瘤顶指向(P=0.005)差异均有统计学意义,动脉瘤大小、AR、SR、BN、径颈比、长宽比差异均无统计学意义(P>0.05),见表2。 瘤颈宽度在受试者工作特征曲线(ROC)曲线下面积(AUC)为0.637,其灵敏度和特异度最大时对应临界值为3.8 mm。以瘤颈宽度≤3.8 mm、动瘤顶指向及有无子囊为自变量, 有无ONP 为因变量进一步行多因素logistic 回归分析,结果显示,瘤颈宽度≤3.8 mm(OR=5.437,95%CI=1.158~18.970,P=0.008)、 瘤顶指向后外下(OR=5.953,95%CI=1.807~19.605, P=0.003)、有子囊(OR=5.356,95%CI=1.414~20.290,P=0.014)是ONP 发生的独立危险因素。
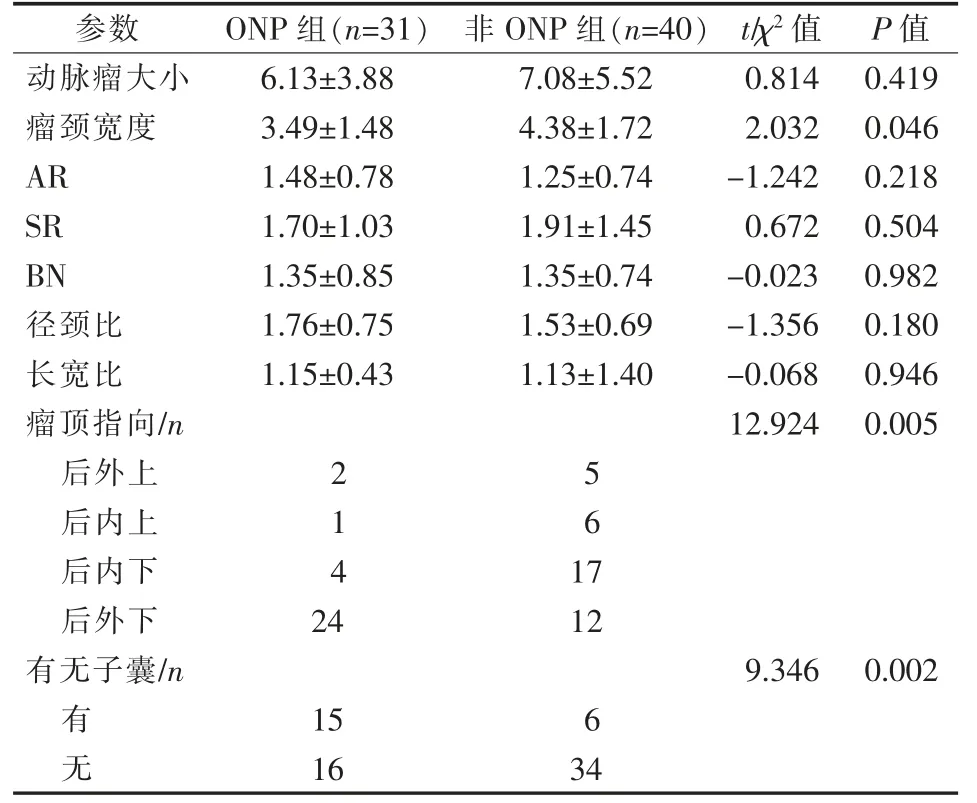
表2 两组动脉瘤形态学参数单因素分析结果
3 讨论
目前越来越多研究表明,动脉瘤形态学因素在颅内动脉瘤发生、发展及破裂中起着重要作用。 通常认为PComA 动脉瘤伴ONP 是一种特殊类型动脉瘤,临床上具有较高的破裂风险。 本研究通过比较伴有或不伴有ONP 的PComA 动脉瘤形态学特征,发现瘤颈宽度≤3.8 mm、瘤顶指向后外下、存在子囊为PComA 动脉瘤引起ONP 的危险因素, 有助于为临床上PComA 动脉瘤治疗选择提供一定依据。
既往关于颅内动脉瘤破裂危险因素的研究较多,但对于动脉瘤瘤颈宽度这一形态学参数是否有临床意义,仍缺乏统一观点。 You 等[7]报道对123 例未破裂和167 例破裂颅内动脉瘤进行对照研究,结果显示瘤颈宽度≤3 mm 与动脉瘤破裂密切相关。傅建华等[8]报道对314 例破裂和270 例未破裂颅内动脉瘤形态学参数进行回顾性比较分析,结果表明瘤颈宽度<1.7 mm 为颅内囊性动脉瘤破裂的独立危险因素。 然而也有学者研究结果表明,颅内动脉瘤瘤颈宽度在破裂与未破裂动脉瘤间差异无统计学意义[9]。本研究中PComA 动脉瘤形态学单因素分析显示,ONP 组动脉瘤瘤颈宽度(3.49±1.48) mm 与非ONP 组瘤颈宽度(4.38±1.72) mm 差异有统计学意义(P=0.046);多因素分析显示,瘤颈宽度≤3.8 mm(OR=5.437,P=0.008)为PComA 动脉瘤引起ONP 的独立危险因素,即PComA 动脉瘤瘤颈越小,其破裂风险相对较高,这与You 等[7]研究结果相似。本研究推测这可能与窄的瘤颈形成的动脉瘤瘤壁较薄[8]有关,这使得动脉瘤在短期内生长速度增加,从而压迫动眼神经,最终导致动脉瘤破裂。 未来仍需大样本数据进一步探讨瘤颈宽度在PComA 动脉瘤导致ONP 及破裂进程中的作用。
Matsukawa 等[10]研 究 比 较39 例 破 裂 和95 例未破裂PComA 动脉瘤瘤顶指向, 发现瘤顶向外为PComA 动脉瘤破裂的独立危险因素(OR=6.7,P=0.001), 并认为瘤顶指向除了影响动脉瘤血流动力学参数外, 还会搏动性接触动脉瘤周围组织结构。 动脉瘤瘤顶可能触及周边结构如颅神经、邻近脑实质、颅底骨质等,进一步会发生变形,致使动脉瘤更加易破裂。 崔岩等[11]研究分析185 例PComA动脉瘤, 得出瘤顶指向后下外为破裂的危险因素(OR=7.584,P=0.038)。 本研究经多因素分析显示PComA 动脉瘤瘤顶指向后下外为PComA 动脉瘤引起ONP 的危险因素。 这可能是由于PComA 与动眼神经特殊的解剖学关系所致。 动眼神经自中脑脚间窝发出,经大脑后动脉与小脑上动脉间穿出,走行于PComA 外侧与腹侧,向外突出的PComA 无法延伸至动眼神经下方,并压迫动眼神经内侧,从而引起ONP 症状。这与Matsukawa 等[10]提出的动脉瘤接触到邻近组织结构引起破裂的假设相一致。
国内外多项研究表明,子囊形成与动脉瘤破裂密切相关。 万军等[12]回顾性分析显示颅内破裂动脉瘤常表现为形态不规则,破口处瘤壁不光整,破口周围易形成假性动脉瘤。 李元辉等[13]报道对颅内小动脉瘤(≤5 mm)形态学参数进行分析,结果提示子囊在破裂组和未破裂组患者间差异有统计学意义,但多因素分析未显示差异有统计学意义。 Skodvin等[14]报道分析29 例患者破裂前后颅内动脉瘤形态学,破裂前有9 例(31%),破裂后有17 例(59%)患者子囊数≥1, 破裂后动脉瘤伴子囊比例明显增加(P=0.005)。 Abboud 等[15]报道对420 例颅内动脉瘤进行远期随访,发现伴发边缘规则和不规则单囊的动脉瘤破裂风险增加3 倍,子囊形成时增加5.5 倍,形成多囊时增加7.2 倍。本研究中ONP 组患者存在子囊比例明显高于非ONP 组, 多因素回归分析显示存在子囊为PComA 动脉瘤引起ONP 的独立危险因素,可能是引起PComA 动脉瘤破裂的又一独立危险因素。 这可能归因于子囊内平均壁面应切力相对较低、子囊壁相对较薄[1],子囊生长速度较瘤体快。 动脉瘤子囊数越多,动脉瘤生长速度越快,其压迫动眼神经的可能性越大;同时,动脉瘤子囊指向后外下时,由于其特殊的解剖学关系,易引起ONP 症状。
本研究也存在一些不足,如为单中心回顾性研究,样本量相对较小;未对完全或部分ONP 进行分析; 未评估血流动力学参数对PComA 动脉瘤伴ONP 的影响。 后期需多中心参与、扩大样本量进一步验证。
综上,本研究结果显示,瘤颈宽度≤3.8 mm、瘤顶指向后外下、存在子囊,可能是PComA 动脉瘤引起ONP 的形态学危险因素, 也是PComA 动脉瘤破裂相关重要形态学参数。 临床上对于具有这些形态学特征的PComA 动脉瘤需要早期甄别, 进行积极的早期干预,以避免发生破裂出血等严重后果。

