稻纵卷叶螟颗粒体病毒的持续感染及检测
韩光杰,刘琴,李传明,祁建杭,徐彬,陆玉荣,徐健
稻纵卷叶螟颗粒体病毒的持续感染及检测
韩光杰,刘琴,李传明,祁建杭,徐彬,陆玉荣,徐健
(江苏里下河地区农业科学研究所/国家农业微生物扬州观测实验站,江苏扬州 225007)
【目的】稻纵卷叶螟颗粒体病毒(granulovirus,CnmeGV)是稻纵卷叶螟的专性病原微生物,病毒持续感染对害虫种群控制具有重要作用。研究旨在建立CnmeGV持续感染的检测方法,分析病毒持续感染对害虫种群的控制作用,为病毒杀虫剂的应用提供理论依据。【方法】多重比较分析颗粒体病毒基因序列,选择变异较大区域设计CnmeGV巢式PCR引物并评估探针的灵敏度和可靠性。室内使用玉米苗繁殖稻纵卷叶螟,以106OB/ml的亚致死浓度口服感染4龄幼虫,并饲养至成虫阶段,统计羽化率。以10%甲醛处理口服感染病毒的昆虫体表,利用探针分析稻纵卷叶螟持续感染种群中幼虫、蛹、蛹蜕及成虫的带毒率。施用106OB/mL病毒制剂,监测次年稻纵卷叶螟幼虫发病率,并检测田间土壤的带毒率。【结果】建立了CnmeGV的巢式PCR探针,包括外侧引物Cm-gran1和内侧引物Cm-gran2。巢式PCR探针检测最低灵敏度为0.85 fg·µL-1,是常规PCR的1 000倍。探针具有较高的可靠性,在稻纵卷叶螟的食物源(水稻、玉米)、其他多角体和颗粒体病毒中,均未检测到目标片段。使用10%甲醛处理病毒感染的幼虫体表10、30 min和16 h后,均未检测到病毒目标片段,但处理16 h后,稻纵卷叶螟蛹不能羽化。亚致死浓度的病毒处理稻纵卷叶螟幼虫96 h后,未显症幼虫经体表处理后病毒检出率为100%。待幼虫化蛹及羽化后,蛹、蛹蜕和成虫的病毒检出率分别为87.5%、83.3%和16.7%。经卡方检测,幼虫到化蛹阶段,病毒感染率未有显著变化(2=3.2,=0.234);而蛹羽化为成虫,病毒检出率显著降低(2=32.356,=0),表明成虫在变态过程中,大部分病毒随蛹蜕一起被排出体外。进一步待蛹羽化,发现和对照群体93.4%的羽化率相比,病毒感染群体成虫羽化率仅有30.8%。田间调查显示,已使用CnmeGV的田块次年稻纵卷叶螟幼虫病毒显症率为4%,土壤带毒率为58%,病毒可以在土壤中存活并通过水平传播持续感染稻纵卷叶螟种群。【结论】构建的巢式PCR探针具有较高的灵敏度,可用于CnmeGV持续感染的检测。CnmeGV的持续感染可有效控制稻纵卷叶螟的发生,成虫变态在稻纵卷叶螟体内病原物的清除中发挥了重要作用。
稻纵卷叶螟;颗粒体病毒;持续感染;潜伏侵染;分子标记;水平传播;昆虫变态
0 引言
【研究意义】稻纵卷叶螟()是水稻上重要的迁飞性害虫[1],大量化学农药的使用并未从根本上控制其暴发危害且造成了农药面源污染风险。稻纵卷叶螟颗粒体病毒(granulovirus,CnmeGV)是稻纵卷叶螟的专性病毒,对稻纵卷叶螟具有较强的致病力,田间应用可以显著降低害虫种群增长趋势指数,有效抑制稻纵卷叶螟种群增长[2]。杆状病毒的持续感染是一种非显症的、但在生物体内存在病毒粒子或遗传信息的潜伏性感染,其对控制害虫特别是迁飞性害虫的暴发危害具有重要的生态意义。但是,目前CnmeGV特异探针的构建工作尚未开展,且对该病毒持续感染的认识也不全面。因此,开发CnmeGV的巢式PCR探针,用于低剂量病毒感染的检测,对研究CnmeGV的持续感染具有重要的应用价值,同时明确病毒持续感染对害虫的控制作用,可为CnmeGV病毒杀虫剂的应用提供理论依据。【前人研究进展】杆状病毒作为生物控制因子的关键在于病毒在自然界中长期存活并持续感染(或称为covert infection)[3-4]。潜伏侵染是一种狭义的持续感染,是一种可转化的、非增殖性的感染,病毒基因组在宿主中保留,但通常并不产生感染性的病毒[5]。自然界存在的病毒可以通过接触感染的水平传播途径使敏感害虫持续感染,也可以通过潜伏侵染长期存在于宿主体内并通过繁殖垂直传播给子代[6]。潜伏侵染直接影响昆虫子代的生长发育和产卵繁殖,使幼虫发育历期延长、产卵量和卵孵化率显著下降,对害虫种群消长发挥重要的调控作用[7-9]。一些常规PCR检测探针的开发证实了棉铃虫()核型多角体病毒(HaNPV)的经卵传播[10]和家蚕()核型多角体病毒(BmNPV)的跨代传播[11],从而提高了对于杆状病毒潜伏侵染的认识。CnmeGV是一种属杆状病毒,主要感染稻纵卷叶螟幼虫脂肪体细胞,表现出颗粒体病毒Ⅱ型特征[12-13]。CnmeGV制剂对田间稻纵卷叶螟控制效果在70%以上,持效期达50 d,且可以保护蜘蛛等天敌[14],发挥了较好的生态效应,但病毒的感染特征还不太明确。【本研究切入点】常规PCR探针对于研究杆状病毒的潜伏侵染还稍显不足,巢式PCR具有更高灵敏度可以检测微量的病毒感染,利用该标记可以分析CnmeGV经蛹传播的潜伏侵染特征。【拟解决的关键问题】建立高灵敏度的CnmeGV病毒检测探针,利用探针分析CnmeGV在害虫种群中的持续感染,明确病毒持续感染特征及对稻纵卷叶螟发生的影响。
1 材料与方法
1.1 稻纵卷叶螟饲养
稻纵卷叶螟幼虫采自扬州市槐泗稻田,在室温(25±1)℃,相对湿度70%条件下,使用玉米苗饲养[15]。幼虫饲养多代后,挑选健康,大小一致的2龄或4龄幼虫供试。
1.2 CnmeGV的增殖与接种
以106OB/ml的CnmeGV病毒口服感染2龄中期的稻纵卷叶螟幼虫,正常饲养至5龄(显症率达90%以上)后收集病虫尸体,研磨匀浆,过滤经差速离心(12 000 r/min离心10 min,3 000 r/min离心30 s)后,收集发白的颗粒体病毒,用血球计数板计数颗粒体病毒数量。
以106OB/ml(该剂量为实验室前期试验结果,未发表,死亡率约30%)的CnmeGV病毒作为亚致死浓度口服感染4龄稻纵卷叶螟幼虫80头/重复,共3个重复,正常饲养96 h后,收集部分幼虫后继续饲养,后续收集蛹和成虫,幼虫和蛹使用10%甲醛处理10 min。
1.3 蛹表面处理方法
使用健康的稻纵卷叶螟蛹作为CnmeGV病毒蛹表面处理的供试虫。以105OB/ml的CnmeGV病毒液(添加0.1%羧甲基纤维素钠增加黏性)处理蛹,处理10 min后晾干。晾干的蛹使用10%的甲醛处理10、30 min、16 h及按照苏志坚等[16]描述的碱液-Dnase酶处理方法处理,提取所有样本总DNA。同样的方法适用幼虫表面处理。
1.4 样品DNA的提取
昆虫及病毒DNA的提取:选取经体表处理的不同发育阶段的稻纵卷叶螟,经液氮研磨后,使用700 µL裂解液(0.1 mol·L-1Na2CO3,0.1 mol·L-1NaCl,0.008 mol·L-1EDTA,pH 10.7)37℃温浴裂解10 min,添加7 µL蛋白酶K和1 µL Rnase酶55℃水浴30 min,之后使用酚氯仿抽提一次后等体积异丙醇沉淀,经12 000 r/min离心10 min后,75%乙醇洗涤一次,晾干后在沉淀中加入100 µL ddH2O溶解。病毒DNA的提取不使用液氮研磨,其余方法一致。
土壤总DNA的提取:在2017年施用CnmeGV制剂的田块(东经119°23′,北纬32°29′),2018年采用5点取样法选取不同位置的水稻表层土壤为样本,经室内风干后研磨,按照Solarbio公司土壤基因组DNA提取试剂盒(D2600-50T)方法,提取土壤总DNA。
1.5 病毒granulin巢式PCR引物的设计及检测
通过NCBI nr/nt数据库下载CnmeGV等8个颗粒体病毒,利用GENEDOC软件多重比较分析,设定第1轮PCR上游引物位于该基因5′端200 bp以内,通过Primer 5.0软件设计巢式PCR外侧引物Cm-gran1和内侧引物Cm-gran2(表1),建立检测探针。

表1 引物设计
PCR检测试剂为诺唯赞公司2×Taq Master Mix产品,PCR仪器为BIO-RAD公司T100。外侧引物Cm-gran1和内侧引物Cm-gran2使用相同的PCR反应程序,为95℃ 3 min;95℃ 30 s,55℃ 30 s,72℃ 30 s,30个循环;72℃ 5 min。PCR反应体系为20 µL,包括Taq Mix 10 µL,上下游引物各1 µL,模板1 µL,ddH2O 7 µL。每轮PCR检测需同时至少做8个无DNA模板的阴性对照。
巢式PCR顺序为先使用外侧引物Cm-gran1进行第1轮PCR扩增,扩展产物稀释100倍后作为第2轮内侧引物Cm-gran2 PCR反应的模板。第2轮PCR产物使用1%的琼脂糖电泳进行检测。
1.6 调查及统计分析
田间稻纵卷叶螟幼虫调查采用5点取样法,每个点剥查20头幼虫,统计幼虫感病率。室内亚致死浓度病毒处理的稻纵卷叶螟待正常羽化后,统计羽化率。图形制作使用GraphPad Prism软件,数据处理使用SPSS 21.0。羽化率和田间幼虫感病率差异分析采用T-test法,不同虫态病毒检出率统计分析采用卡方测验。
2 结果
2.1 CnmeGV granulin分子标记的建立
多重比较分析来自CnmeGV、AdorGV、ChocGV等8种颗粒体病毒的,CnmeGV与其他7个基因核苷酸一致性为72.3%—75.8%。除5′端200 bp以内,其他区域核苷酸较保守。因此,选择特异性较高的区段为分子标记位点,建立了巢式PCR探针(图1),该标记可以有效扩出目标片段。以实验室常备材料(水稻、玉米、稻纵卷叶螟健康虫、斜纹夜蛾核型多角体病毒、小菜蛾颗粒体病毒、黏虫颗粒体病毒、茶尺蠖核型多角体病毒)的DNA为模板,利用该标记均未检测到目标条带(图略)。
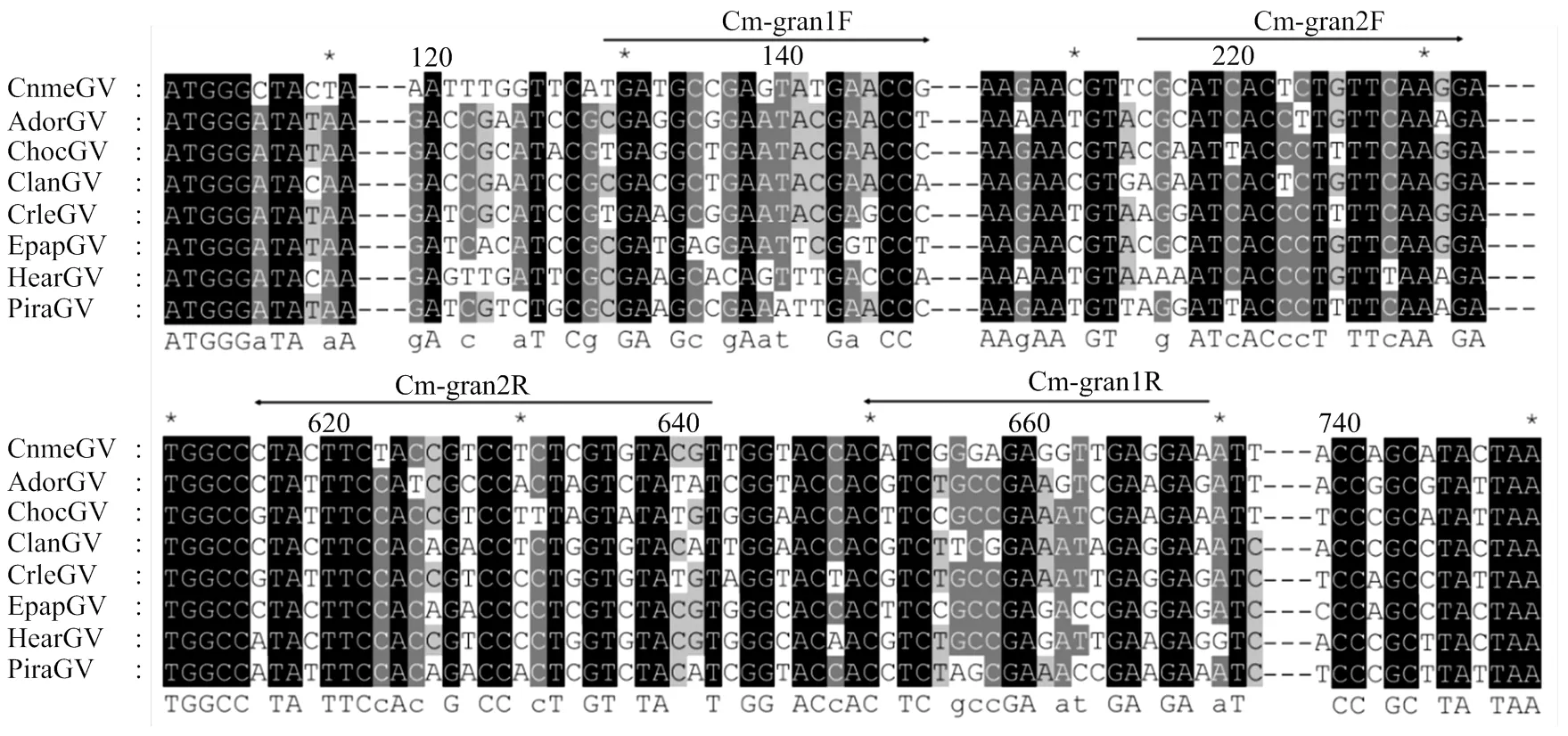
CnmeGV: KP658210.1:1-750; AdorGV: AF547984.1:1-747; ChocGV: NC_008168.1:1-747; ClanGV: HQ116624.1:1-747; CrleGV: AY229987.1:1-747; EpapGV: JN408834.1:1-747; HearGV: EU255577.1:1-747; PiraGV: AY428513.1:1-744
2.2 巢式PCR标记的敏感性
将浓度为85 ng·µL-1的病毒DNA依次10倍稀释作为模板,检测分子标记的灵敏度,经4次重复检测发现病毒DNA的最低检出限为0.85 fg·µL-1,是常规PCR的1 000倍(图2)。不同处理方式处理蛹表后,检测结果发现稻纵卷叶螟健康蛹、10%甲醛处理10 min—16 h的病毒处理蛹均未检测到病毒,但甲醛处理16 h后的蛹不能正常羽化。参考苏志坚等[16]方法,使用碱液-Dnase处理30 min,并不能去除蛹表的病毒DNA(图3)。在增加24个个体的试验重复后,结果一致。
2.3 CnmeGV经蛹传播及对蛹羽化的影响
使用亚致死浓度的病毒处理稻纵卷叶螟幼虫96 h后,挑选24头未显症幼虫经体表处理后检测病毒感染率。经巢式PCR检测发现,幼虫病毒感染率为100%,表明所有幼虫均有病毒定殖。待幼虫成功化蛹后,收集部分蛹进行体表处理后,提取蛹、蛹蜕和成虫DNA检测病毒。发现蛹的病毒检出率为87.5%,蛹蜕为83.3%,成虫为16.7%。经卡方检测,幼虫到化蛹阶段,病毒感染率未有显著变化(2=3.2,=0.234);而蛹羽化为成虫,病毒检出率显著降低(2=32.356,=0)(表2)。
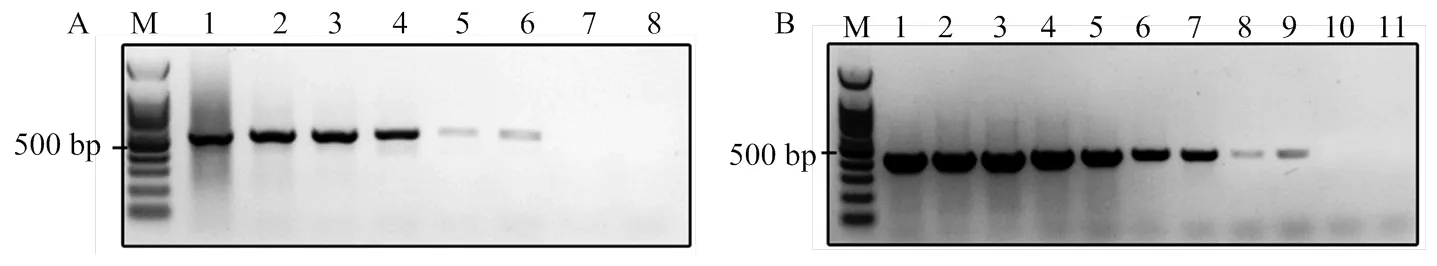
1-11: 85, 8.5, 0.85 ng·µL-1, 85, 8.5, 0.85 pg·µL-1, 85, 8.5, 0.85 fg·µL-1, 85, 8.5 ag·µL-1

1—4:CnmeGV处理的稻纵卷叶螟蛹the pupa of C. medinalis treated with CnmeGV;5—8:稻纵卷叶螟健康蛹the healthy pupa of C. medinalis;9—12:10%甲醛处理稻纵卷叶螟蛹(病毒处理)10 min the infected pupa treated with 10% formaldehyde for 10 min;13—16:10%甲醛处理蛹表30 min the infected pupa treated with 10% formaldehyde for 30 min;17—20:经碱处理并使用DNase处理蛹表30 min the infected pupa treated with Lye-Dnase for 30 min;21—24:10%甲醛处理蛹表16 h the infected pupa treated with 10% formaldehyde for 16 h
进一步待蛹羽化,发现与对照群体93.4%的羽化率相比,病毒感染群体羽化率仅有30.8%(<0.0001)(图4)。
2.4 CnmeGV田间水平传播分析
2017年在扬州单一田块施用106OB/ml病毒制剂后,当代稻纵卷叶螟幼虫感病率达70%[2]。次年,调查同一田块,发现稻纵卷叶螟幼虫的病毒显症率仍有4%,而附近田块未发现感病个体(图5)。考虑到病毒水平传播的可能性,检测了田间土样带毒水平。利用该分子标记检测24份土样,发现田间土壤带毒率为58%(图6)。
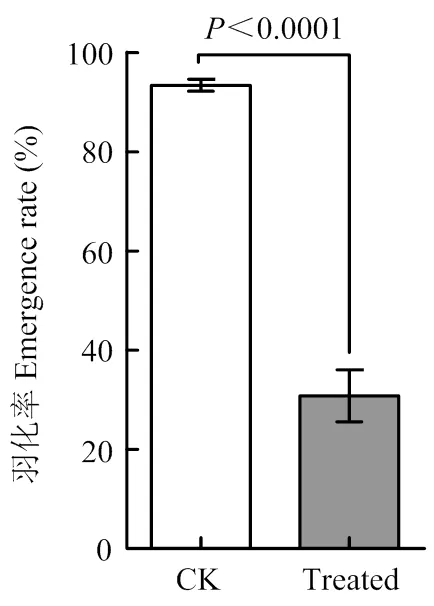
CK:稻纵卷叶螟健康群体healthy population of C. medinalis;Treated:病毒处理群体infected population of C. medinalis

CK:未使用病毒制剂田块control field without the use of CnmeGV;Inf-Field:使用病毒制剂的田块,次年稻纵卷叶螟幼虫显症率the prevalence rate of larvae in the next year after using CnmeGV
3 讨论
潜伏侵染(狭义的持续感染)在杆状病毒[4-5]、植物病原细菌[17]、动物病毒[18]等中被广泛研究,虽然宿主未表现症状,但潜伏侵染严重影响了宿主种群的健康和病原物的后期流行规模。分子标记的开发对病原微生物潜伏侵染的研究具有重要作用,包括常规PCR探针[10-11]、定量PCR探针[18]、巢式PCR探针[19]等。对葡萄霜霉病菌()的检测结果显示定量PCR探针灵敏度是常规PCR探针的100倍[17],对美人蕉黄斑驳病毒(canna yellow mottle virus)的检测结果显示巢式PCR探针灵敏度是常规PCR探针的1 000倍[19],二者横向比较,巢式PCR探针的灵敏度更高。因此,为了更好地检测病毒的潜伏侵染,笔者选择开发CnmeGV的巢式PCR探针。该探针检测CnmeGV的最低限为0.85 fg·µL-1,检测灵敏度是常规PCR探针的1 000倍。同时,为了保证检测的特异性,CnmeGV的巢式PCR探针是选取颗粒体病毒变异度较大的区域作为候选区来设计的,且在稻纵卷叶螟的食物源(水稻、玉米)、其他多角体和颗粒体病毒中均未检测到目标片段。在昆虫饲养中,甲醛可以使蛋白质变性、DNA分子断裂,一般被用来蛹表消毒。本研究发现10%的甲醛处理10 min就能完全清除蛹表污染病毒,而参照苏志坚等[16]的碱液-Dnase酶处理(其主要作用机理为利用碱液裂解病毒蛋白,使病毒DNA暴露,再使用Dnase酶消解DNA)方法未能有效清除病毒,造成这种差异的原因可能是常规PCR灵敏度或者Dnase酶活力不同。因此,在该探针检测的灵敏度范围内,10%甲醛可以被认为能够清除稻纵卷叶螟体表的CnmeGV。
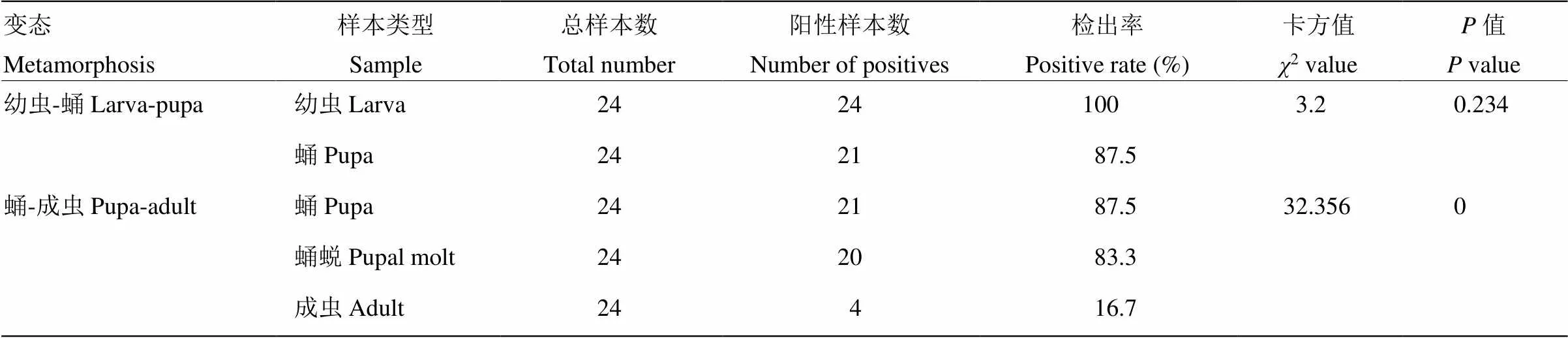
表2 稻纵卷叶螟不同虫态中稻纵卷叶螟颗粒体病毒检出率统计分析
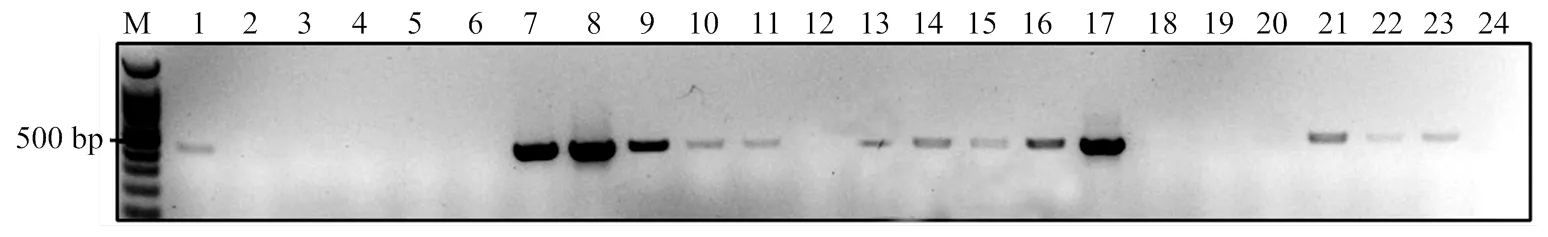
图6 病毒制剂处理后田间次年土壤带毒检测
杆状病毒潜伏侵染普遍存在,Khurad等以亚致死剂量的家蚕多角体病毒感染幼虫,存活成虫和子代幼虫体内都扩增到473 bp的病毒早期基因[20]。印度谷螟()感染颗粒体病毒后,存活的幼虫和蛹内检测到病毒晚期表达颗粒体蛋白基因()mRNA,成虫卵巢和睾丸中也检测到该基因的mRNA[21]。本研究使用亚致死浓度的CnmeGV感染稻纵卷叶螟4龄幼虫,同样在幼虫、蛹及成虫中检测到病毒,但成虫的病毒感染率显著下降。进一步研究发现,蛹蜕的病毒检出率高达83.3%。昆虫的细胞凋亡或蜕皮是清除病毒和细菌感染的一个重要防御机制,死亡的细胞被新分化细胞代替,从而降低了感染水平[22]。因此可以推断,成虫在变态过程中,大部分病毒随蛹蜕一起被排出体外,从而降低了后代持续感染病毒的风险。但是笔者也注意到,在幼虫化蛹的变态中,病毒的感染率未有明显的下降,幼虫-蛹的变态在昆虫病毒清除中的作用目前并不清楚。有研究报道,黏虫成虫潜伏的核型多角体病毒多数集中于足、翅和触角[23]。这些结果是否间接表明昆虫成虫体表潜伏病毒的数量远大于体内,值得进一步去探究。由于鳞翅目昆虫成虫鳞片具有疏水特性,10%甲醛体表处理很难有效清除体表病毒,这也是本试验尚未解决的难题。
潜伏侵染是杆状病毒与宿主昆虫协同进化共存的一种方式,同时也是病毒选择和丰度控制昆虫种群密度的因素之一[24]。斜纹夜蛾()成虫感染斜纹夜蛾核型多角体病毒后,平均寿命及单雌产卵量明显下降,对子代幼虫种群控制作用干扰指数为0.1807[25]。本研究发现潜伏感染的稻纵卷叶螟可以正常化蛹,但是成虫羽化率显著降低,未羽化的蛹呈现发黑状,显示CnmeGV对稻纵卷叶螟种群的控制效果显著。前期研究也发现,CnmeGV对稻纵卷叶螟种群具有明显的干扰控制作用,种群控制指数为0.31—0.32[2],显示了其作为生物杀虫剂的优势。田间调查发现,使用病毒制剂田块次年稻纵卷叶螟幼虫显症率仍达4%,而相邻田块未发现病毒感染幼虫,进一步研究发现该发病田块土壤带毒率为58%。CnmeGV于1979年首次在广东恩平县被分离[26],时隔30年后,该地区仍然存在因感染CnmeGV而死亡的稻纵卷叶螟幼虫[27]。因此,CnmeGV在土壤中存活,通过水平传播进行持续感染可能是诱发稻纵卷叶螟感病的主要原因。
无论是杆状病毒水平传播造成持续感染还是垂直传播形成的潜伏侵染,对害虫种群控制都具有重要的生态意义。稻纵卷叶螟是重要的迁飞性害虫,潜伏侵染的种群可以将病毒带到其他地方,并形成种群内的持续感染,从而有效控制种群暴发。一定条件下持续感染能被激发并在宿主体内复制增殖转化为增殖感染,引起害虫死亡并形成持续传播[4,28]。这些激发条件可能包括种群密度[6]、微毒化合物[29]、其他病毒[9,30]等。因此,稻纵卷叶螟持续感染种群病毒激发的条件将是后期研究重点。
4 结论
巢式PCR检测体系可以应用于CnmeGV的持续感染研究,其灵敏度是常规PCR的1 000倍。CnmeGV在宿主体内可以经蛹传播,并显著降低稻纵卷叶螟的羽化率。CnmeGV的持续感染对控制害虫种群暴发具有重要的生态意义。
[1] 陆明红, 刘万才, 胡高, 翟保平, TUAN H A, KHANH D H. 中越水稻迁飞性害虫稻飞虱、稻纵卷叶螟发生关系分析. 植物保护, 2018, 44(3): 31-36, 60.
LU M H, LIU W C, HU G, ZHAI B P, TUAN H A, KHANH D H. Analysis of the relationships of rice planthopper and rice leaf folder occurrence between China and Vietnam., 2018, 44(3): 31-36, 60. (in Chinese)
[2] 徐健, 李传明, 韩光杰, 徐彬, 祁建杭, 孙俊, 刘琴. 颗粒体病毒(CnmeGV)对稻纵卷叶螟的感染及害虫种群增长的影响. 江苏农业学报, 2018, 34(1): 29-33.
XU J, LI C M, HAN G J, XU B, QI J H, SUN J, LIU Q. The effect ofgranulovirus (CnmeGV) on larva infection and population regulation of rice leaffolder., 2018, 34(1): 29-33. (in Chinese)
[3] ZHOU M Z, SUN X L, SUN X C, VLAK J M, HU Z H, VAN DER WERF W. Horizontal and vertical transmission of wild-type and recombinantsingle-nucleocapsid nucleopolyhedrovirus., 2005, 89(2): 165-175.
[4] Williams T, Virto C, Murillo R, Caballero P. Covert infection of insects by baculoviruses., 2017, 8: 1337.
[5] 翁庆北, 庞义. 杆状病毒在昆虫中的持续感染. 环境昆虫学报, 2010, 32(1): 90-95.
WENG Q B, PANG Y. Persistent infection of baculoviruses in insects., 2010, 32(1): 90-95. (in Chinese)
[6] CORY J, MYERS J H. The ecology and evolution of insect baculoviruses., 2003, 34: 239-272.
[7] 蒋杰贤, 胡颂平, 季香云, 刘劲军, 袁永达. 甜菜夜蛾核型多角体病毒对宿主种群的控制作用. 植物保护学报, 2004, 31(4): 383-389.
JIANG J X, HU S P, JI X Y, LIU J J, YUAN Y D. The control effect ofnuclear polyhedrosis virus on its host population., 2004, 31(4): 383-389. (in Chinese)
[8] IL’INYKH A V, POLENOGOVA O V. Demonstration of the remote effect of baculovirus vertical transmission, with gypsy mothL. (Lepidoptera, Lymantriidae) as an example., 2012, 73(5): 389-395.
[9] LAREM A, BEN TIBA S, FRITSCH E, UNDORF-SPAHN K, WENNMANN J T, JEHLE J A. Effects of a covert infection withgranulovirus in insect populations of., 2019, 11(4): 337.
[10] 曲良建, 张永安, 王玉珠, 王登元. PCR法证实棉铃虫核型多角体病毒对棉铃虫经卵和蛹的垂直传播. 中国生物防治学报, 2005, 21(1): 45-48.
QU L J, ZHANG Y A, WANG Y Z, WANG D Y. Identification of the vertical transmission of HaNPV inby PCR assay., 2005, 21(1): 45-48. (in Chinese)
[11] 张彦. 家蚕核型多角体病毒在家蚕中的垂直传播及检测技术研究[D]. 合肥: 安徽农业大学, 2014.
ZHANG Y. Study on vertical transmission and detection technique of BmNPV in the silkworm,L.[D]. Hefei: Anhui Agricultural University, 2014. (in Chinese)
[12] HAN G J, XU J, LIU Q, LI C M, XU H X, LU Z X. Genome ofgranulovirus, the first Crambidae-infecting betabaculovirus isolated from rice leaffolder to sequenced., 2016, 11(2):e0147882.
[13] 王艳, 刘琴, 徐健, 李传明, 韩光杰, 徐彬, 祁建杭, 孙俊. 颗粒体病毒(CnmeGV)对稻纵卷叶螟的感染及影响因素研究. 扬州大学学报(农业与生命科学版), 2019, 40(1): 107-111.
WANG Y, LIU Q, XU J, LI C M, HAN G J, XU B, QI J H, SUN J. The infectivity and influence factors ofgranulovirus (CnmeGV) to larva of rice leaffolder., 2019, 40(1): 107-111. (in Chinese)
[14] XU J, LIU Q, LI C M, HAN G J. Field effect ofgranulovirus (CnmeGV) on the pest of rice leaffolder., 2019, 18(9): 2115-2122.
[15] XU J, LI C M, YANG Y J, QI J H, ZHENG X S, HU R L, LU Z X, LIU Q. Growth and reproduction of artificially fed., 2012, 19(3): 247-251.
[16] 苏志坚, 庞义, 余健秀, 陈其津, 毛文富, 李广宏. 污染寄主卵面的斜纹夜蛾核型多角体病毒PCR检测及其消除. 农业生物技术学报, 2001, 9(2): 119-122.
SU Z J, PANG Y, YU J X, CHEN Q J, MAO W F, LI G H. PCR- detection and Dnase-elimination ofnucleopolyhedrovirus attached to host-eggs surface., 2001, 9(2): 119-122. (in Chinese)
[17] 李文学, 肖瑞刚, 吕苗苗, 丁宁, 石华荣, 顾沛雯. 葡萄霜霉病菌实时荧光定量PCR检测体系的建立和应用. 中国农业科学, 2019, 52(9): 1529-1540.
LI W X, XIAO R G, Lü M M, DING N, SHI H R, GU P W. Establishment and application of real-time PCR for quantitatively detectingin., 2019, 52(9): 1529-1540. (in Chinese)
[18] 陈俊杰, 李媛媛, 阳瑞雪, 古晶晶, 汪开毓, 耿毅, 欧阳萍. 锦鲤疱疹病毒潜伏感染实时荧光定量PCR检测方法的建立. 湖南农业大学学报(自然科学版), 2017, 43(3): 310-314.
CHEN J J, LI Y Y, YANG R X, GU J J, WANG K Y, GENG Y, OUYANG P. Method of real-time PCR for the detecting latent infection of koi herpesvirus., 2017, 43(3): 310-314. (in Chinese)
[19] 陈细红, 杨小龙, 廖富荣, 高芳銮, 沈建国. 美人蕉黄斑驳病毒巢式PCR检测方法的建立. 植物保护, 2019, 45(4): 162-165.
CHEN X H, YANG X L, LIAO F R, GAO F L, SHEN J G. Development of nested PCR assay for detection of canna yellow mottle virus., 2019, 45(4): 162-165. (in Chinese)
[20] KHURAD A M, MAHULIKAR A, RATHOD M K, RAI M M, KANGINAKUDRU S, NAGARAJU J. Vertical transmission of nucleopolyhedrovirus in the silkworm,L., 2004, 87(1): 8-15.
[21] BURDEN J P, GRIFFITHS C M, CORY J S, SMITH P, SAIT S M. Vertical transmission of sublethal granulovirus infection in the Indian meal moth,., 2002, 11(3): 547-555.
[22] HAKIM R S, BALDWIN K, SMAGGHE G. Regulation of midgut growth, development, and metamorphosis., 2010, 55: 593-608.
[23] GRAHAM R I, TUMMALA Y, RHODES G, CORY J S, SHIRRAS A, GRZYWACZ D, WILSON K. Development of a real-time qPCR assay for quantification of covert baculovirus infections in a major African crop pest., 2015, 6(3): 746-759.
[24] ILYINYKH A V. Vertical transmission of baculoviruses., 2019, 46(3): 302-310.
[25] 肖留斌, 柏立新, 谭永安, 赵洪霞. 核多角体病毒对斜纹夜蛾成虫及其后代的影响. 中国生物防治学报, 2011, 27(1): 136-139.
XIAO L B, BAI L X, TAN Y A, ZHAO H X. Effects of SpltMNPV on survival, fecundity, development ofadults and their progeny., 2011, 27(1): 136-139. (in Chinese)
[26] 庞义, 赖涌流, 刘炬, 叶育昌. 稻纵卷叶螟幼虫颗粒体病毒. 微生物学通报, 1981(3): 103-104.
PANG Y, LAI Y L, LIU J, YE Y C. A new granulovirus from naturally-infected Asiatic rice leafroller,., 1981(3): 103-104. (in Chinese)
[27] 张珊, 贾茜雯, 孙士锋, 庞义, 陈其津, 杨凯. 一株稻纵卷叶螟颗粒体病毒的系统发育分析和流行病学调查. 环境昆虫学报, 2014, 36(5): 756-762.
ZHANG S, JIA X W, SUN S F, PANG Y, CHEN Q J, YANG K. Phylogenetic analysis and epidemiologic investigation of agranulovirus strain., 2014, 36(5): 756-762. (in Chinese)
[28] SINGH J, SINGH C P, BHAVANI A, NAGARAJU J. Discovering microRNAs fromnucleopolyhedrosis virus., 2010, 407(1): 120-128.
[29] VIRTO C, NAVARRO D, TELLEZ M M, MURILLO R, WILLIAMS T, CABALLERO P. Chemical and biological stress factors on the activation of nucleopolyhedrovirus infections in covertly infected., 2017, 141(5): 384-392.
[30] Murillo R, Hussey M S, Possee R D. Evidence for covert baculovirus infections in alaboratory culture., 2011, 92(5): 1061-1070.
the persistent infection and Detection ofgranulovirus in
HAN GuangJie, LIU Qin, LI ChuanMing, QI JianHang, XU Bin, LU YuRong, XU Jian
(Jiangsu Lixiahe District Institute of Agricultural Sciences/National Agricultural Experimental Station for Agricultural Microbiology, Yangzhou, Yangzhou 225007, Jiangsu)
【Objective】granulovirus (CnmeGV) is a specific pathogenic microorganism of. Persistent infection of baculovirus plays an important role in pest population control. The objective of this study is to construct the detection method of persistent infection with CnmeGV, analyze the control effect of viral persistent infection on pest population, and to provide a theoretical basis for the application of viral pesticides.【Method】The largely diverged regions were selected to design CnmeGV nested PCR primers based on multiple comparisons ofgene sequences of granulovirus. The sensitivity and reliability of probes were further evaluated. The maize leaves were used to feedin the laboratory. The 4th instar larvae were singled out, and then fed with maize leaves soaked by CnmeGV with a sublethal concentration of 106OB/ml. The infectedwere reared to adult stage, and the emergence rate was counted. After treating the insect body surface with 10% formaldehyde, the carrying CnmeGV rates of larvae, pupae, pupal molts and adults in persistent infection population ofwere analyzed using these probes.The prevalence rate of larvae and carrying rate of soil in the next year after using CnmeGV were also detected.【Result】The probes of CnmeGV nested PCR were constructed including the outer primer Cm-gran1 and the inner primer Cm-gran2. The sensitivity of nested PCR was 0.85 fg·μL-1genomic DNA, which was 1 000 times higher than that of the conventional PCR. The probes were highly reliable, and no target fragment was detected in the food sources of(rice and maize), other polyhedrosis and granulosis viruses. The target fragments of CnmeGV were not detected in larvae after treated with 10% formaldehyde for 10, 30 min and 16 h, respectively. However, the pupa ofcould not emerge after 16 h of treatment. The detection rate of CnmeGV was 100% in the larvae of infected population treated with sublethal concentration of CnmeGV for 96 h. After pupation and emergence, the detection rates of pupae, pupal molts and adults were 87.5%, 83.3% and 16.7%, respectively. The detection rate of CnmeGV had no significant change from larva to pupa stage (2=3.2,=0.234) by Chi-square test. However, the detection rate of CnmeGV decreased significantly (2=32.356,=0) from pupa to adult stage, indicating that most of the viruses were excreted from the body with pupal molt during metamorphosis. The emergence rate of adult in infected population (30.8%) was significantly lower than that of the control (93.4%). Field tests showed that the prevalence rate oflarvae in the field at one year following CnmeGV treatment was 4%, and the rate of soil carrying CnmeGV was 58%, suggesting that CnmeGV could survive in the soil and continue to infectthrough horizontal transmission.【Conclusion】The sensitivity of constructed nested PCR probes is high and can be used for the detection of CnmeGV persistent infection. Persistent infection of CnmeGV can effectively control the population development of, and adult metamorphosis plays an important role in removing pathogens.
; granulovirus; persistent infection; latent infection; molecular marker; horizontal transmission; insect metamorphosis
2020-02-15;
2020-03-16
国家自然科学基金(31701792)、江苏省自然科学基金(BK20181215)、江苏省农业科学院颠覆性计划项目[ZX(17)2002]
韩光杰,E-mail:hanguangjie177@163.com。通信作者徐健,Tel:0514-87302019;E-mail:bio-xj@163.com
(责任编辑 岳梅)

