海洋来源杂色曲霉次级代谢产物及其抗植物病原细菌活性
付兵,王美,刘建阳,林伟,张成省,赵栋霖
海洋来源杂色曲霉次级代谢产物及其抗植物病原细菌活性
付兵1,2,王美1,刘建阳2,林伟2,张成省1,赵栋霖1
(1中国农业科学院烟草研究所海洋农业研究中心,山东青岛 266101;2福建省烟草公司南平市公司,福建南平 353000)
【目的】针对植物细菌病害日趋严重,并缺少有效防治药剂的问题,从前期筛选获得的具有抗菌活性且次级代谢产物丰富的海洋杂色曲霉()D5发酵提取物中分离纯化单体化合物,分析鉴定其化学结构,并进行抗菌活性评价,阐明目标真菌的抗菌活性成分,为新颖结构抗细菌生物农药的研发提供先导化合物。【方法】综合运用正/反相硅胶柱层析、Sephadex LH-20凝胶柱层析和半制备高效液相色谱(HPLC)等方法分离纯化单体化合物,采用核磁、质谱等现代波谱分析方法对单体化合物进行结构鉴定;采用微量稀释法对化合物进行抗6种植物病原细菌燕麦食酸菌()、胡萝卜软腐欧文氏菌()、密执安棒形杆菌()、丁香假单胞菌()、青枯雷尔氏菌()和野油菜黄单胞菌()活性评价,获得活性化合物的最小抑菌浓度(MIC)。【结果】从海洋杂色曲霉D5马铃薯葡萄糖液体发酵培养基乙酸乙酯提取物中分离鉴定了12个化合物,包括4个2-羰基-4-苯基喹啉生物碱,viridicatin(1)、3--methylviridicatin(2)、3,6--dimethylviridicatin(3)和3--methylviridicatol(4);2个双氧代哌嗪生物碱,(+)-cyclopenol(5)和(−)-cyclopenol(6);3个喹唑啉fumiquinazolines生物碱及其衍生物,versicoloid A(7)、chrysopiperazine C(8)和cottoquinazoline A(9);以及3个蒽醌类化合物,versiconol(10)、averufin(11)和noraverufanin(12)。抗菌活性结果表明,2-羰基-4-苯基喹啉生物碱3,6--dimethylviridicatin(3)具有显著的抗植物病原细菌活性,对青枯雷尔氏菌和野油菜黄单胞菌的MIC分别为50和100 µg·mL-1。初步的构效关系分析表明,C-6位置的甲氧基可能是该类化合物发挥抗植物病原细菌作用的关键基团。【结论】海洋杂色曲霉D5代谢产物丰富,能够产生结构多样的生物碱和蒽醌类化合物。从其发酵产物中分离鉴定了9个生物碱类化合物和3个蒽醌类化合物,其中3,6--dimethylviridicatin(3)对青枯雷尔氏菌和野油菜黄单胞菌具有显著的抗菌活性,有开发成为抗细菌生物农药的潜力。
海洋真菌;杂色曲霉;生物碱;蒽醌;结构鉴定;植物病原细菌
0 引言
【研究意义】随着世界人口数量的不断增长,避免饥饿、保障粮食安全显得尤为重要,因此,需要控制植物病害的发生,增加和保证粮食的产量[1-2]。植物病原细菌在世界农业生产历史上曾经多次造成重大影响,作物细菌病害是导致农作物减产、人口数量下降和社会动荡的客观因素之一[3]。已知的植物病原细菌有200多个属,其中最重要的包括假单胞菌属()、雷尔氏菌属()、农杆菌属()、黄单胞菌属()、欧文氏菌属()、木质部小菌属()和果胶杆菌属()[4-6]。目前防治植物细菌病害的方法主要是采用抗病品种、加强田间管理和轮作等方式,但效果有限[4];防治的药剂主要为化学农药,容易造成环境污染、食品安全和病原抗性等一系列问题[4,7]。一直以来,农用硫酸链霉素都是我国农作物细菌病害防治的主力军,而随着我国停止使用农用硫酸链霉素,植物细菌病害的防治面临巨大挑战。随着国家大力推行发展绿色农业,更加注重环境友好,研发新型高效低毒的抗细菌生物农药迫在眉睫。【前人研究进展】众所周知,海洋真菌由于生活在高盐、高压、低温、低氧、少光和寡营养的海洋环境中,拥有独特的生存策略,经过长期的进化演变形成了不同于陆地真菌的特殊代谢机制,能够产生种类繁多、结构新颖、生物活性显著的次级代谢产物,因而近年来成为研究的热点[8]。许多海洋真菌次级代谢产物具有明显的抗细菌活性,显示出了作为新型抗细菌农药的巨大开发潜力[9]。然而,对于这些化合物的抗细菌活性研究大多集中在人类医学领域,关于农业领域的研究和应用还很少,但仅有的少量研究展现了极其可观的研究价值和前景。UCHIDA等[10]从一株未鉴定的海洋真菌发酵粗提物中分离获得了两个聚酮类化合物chlorogentisylquinone和gentisylquinone,它们在10 µg/disk的浓度下对水稻黄单胞菌()的抑菌圈分别为9和10 mm,表现出了较强的抑菌活性;SWatHI等[11]对海洋来源的一株曲霉(sp.)发酵提取物进行抗菌活性研究,发现其对野油菜黄单胞菌()具有较强的抑菌活性,在100 µg·mL-1的浓度下抑菌圈达到12 mm,有望从中发现强活性抗菌化合物;SILBER等从一株海水来源的真菌sp. KF525发酵液中分离获得了一个二十四元大环内酯类化合物calcaride A,其对野油菜黄单胞菌显示了中等强度的抑菌活性,最小抑菌浓度(MIC)为5.5µmol·L-1[12];随后,该小组发现分离自波罗的海和南极海域的两株Lindgomycetaceae所产聚酮类化合物lindgomycin和ascosetin,对野油菜黄单胞菌的IC50分别为17.8和14.8 µmol·L-1[13];HENRIQUEZ等[14]从南极海域采集的海绵中分离获得了101株真菌,发现其中11株真菌的发酵提取物对密执安棒形杆菌()具有抑菌活性,22株真菌的提取物对野油菜黄单胞菌表现出了明显的抑菌活性;NIU等[15]对分离自深海来源真菌sp. MCCC 3A00308的多酚类化合物进行研究,发现spiromastols A和C表现出极强的抗植物病原细菌活性,对野油菜黄单胞菌、假单胞菌()、根癌农杆菌()和青枯雷尔氏菌()的MIC达到0.25—0.5 µmol·L-1,活性强于阳性药氯霉素,具有开发成为抗细菌农药的潜力;WANG等[16]对一株海胆来源的亮白曲霉()HDf2进行研究,从中获得了两个具有抗菌活性的刺孢青霉酸类化合物spiculisporic acid F和G,它们对青枯雷尔氏菌显示了中等强度的抑菌活性;CHEN等[17]对一株海藻来源的格孢腔菌(sp.)所产混源萜类次级代谢产物进行研究,发现pleosporallins D和E对密执安棒形杆菌显示了中等活性的抑菌活性,MIC为9.48 µg·mL-1。【本研究切入点】笔者课题组在前期研究中,从山东沿海和海南海洋特殊红树林生境中分离纯化了200余株海洋真菌,通过初步的形态学排重后,对其进行了种属鉴定。对其中近80株真菌进行小规模发酵,测试其发酵产物乙酸乙酯提取物的抗植物病原细菌活性,筛选得到多株抗菌活性显著的海洋真菌[18-19]。其中,一株海藻来源的杂色曲霉()D5,其发酵提取物对青枯雷尔氏菌等植物病原细菌表现出了明显的抗菌活性。HPLC指纹图谱分析发现,D5次级代谢产物丰富,结构类型多样,产量较大,有望从中发现抗菌活性化合物。【拟解决的关键问题】从杂色曲霉D5发酵产物中分离、纯化单体化合物,并采用多种谱学方法对其进行结构鉴定,进而对单体化合物进行抗植物病原细菌活性测试并分析构效关系,阐明目标菌株的活性成分及活性化合物的关键作用基团,为海洋真菌来源高效低毒生物农药的研发提供化合物基础。
4.创新活动载体。要提高党组织的凝聚力和战斗力,创新活动载体、保证活动成效十分关键。结合社会组织主要分布在油田各行各业、在职党员具有较强的业务知识等特点,引导社会组织“适时、适宜、适度”地参与油田各项建设,引导他们参与油田的各项便民利民服务,如定期不定期举办法律、医疗保健,家庭理财等方面的咨询服务等,并通过建立服务志愿者队伍,把参与结果作为吸收入党、评选先进的一项重要参考指标,吸引更多的新社会组织从业人员投入到油田发展,使越来越多的员工群众从中受益。
1 材料与方法
试验于2017—2019年在中国农业科学院烟草研究所海洋农业研究中心/滩涂生物资源保护利用创新团队完成。
Monographic report: Screening and prevention of chronic kidney disease in Shanghai
1.1 仪器与试剂
核磁共振波谱仪Agilent DD2 500(美国安捷伦公司);质谱仪ESI-MS Q-TOF Ultima Global GAA076(美国Waters公司)和Q-TOF maXis(美国Bruker公司);高效液相色谱仪(日本日立公司);C18柱:(5 μm,10 mm×250 mm,美国Waters公司);旋转蒸发仪Hei-VAP Industrial-glassware set R(德国Heidoph公司);LRH-250生化培养箱(上海一恒科学仪器有限公司);正相柱层析硅胶100—200、200—300目(青岛海洋化工厂);凝胶Sephadex LH-20(美国GE公司);正相TLC预制板(烟台汇有硅胶开发有限公司);马铃薯葡萄糖水培养基(青岛海博生物技术有限公司);马铃薯葡萄糖琼脂培养基(青岛海博生物技术有限公司);HPLC用甲醇和乙腈为色谱纯(国药集团),其他试剂均为分析纯。
1.2 菌株发酵与培养
化合物3为白色晶体,ESIMS质谱中在m/z 282.1 [M + H]+处给出分子离子峰,结合氢谱和碳谱,推测分子式为C17H15NO3,不饱和度为11。仔细分析其1H-NMR和13C NMR数据,发现3的核磁数据与2十分相似。与2相比,3少了1个芳香氢信号,同时增加了1个甲氧基信号H3.67,C55.5,提示该分子中的1个芳香氢被甲氧基取代。经过与文献数据比对,确定化合物3为3,6--dimethylviridicatin[23](图1)。
1.2.2 菌株发酵与培养 500 mL的发酵瓶中倒入250 mL马铃薯葡萄糖水(PDW)培养基,灭菌。挑取生长于马铃薯葡萄糖琼脂(PDA)培养基上的目标菌株加入其中,共发酵10瓶。摇床(180 r/min,28℃)振荡培养72 h,获得种子液。将400 mL PDW培养基加入容量为1 L的发酵瓶中,加入粗海盐使其浓度为3%,灭菌,共发酵80 L。取种子液5 mL分别加入400 mL PDW培养基中,于28℃静置培养30 d。
加强“吃住行游购娱”硬件设施建设,优化健康旅游服务软环境,构筑全区域、全方位、全覆盖、全过程的配套服务体系。推进“互联网+健康旅游”,打造智慧旅游服务,实现信息数据共享,建立标准化电子健康档案,保障游客享受旅游服务的延续性。构建“快进慢游”交通网络,运用北斗、大数据分析等技术,开展旅游交通精准信息服务,依托高铁、民航、高等级公路等建立“快进”网络,增强通达性和便捷性;建设风景道、自行车道、步行道等“慢游”设施,打造健康主题线路[17]。
1.3 化合物分离纯化
化合物9为淡黄色粉末,ESIMS:m/z 430.2 [M + H]+,结合其1H-NMR和13C-NMR数据,推断其分子式为C23H19N5O4。1H-NMR在H8.10(1H,d,=8.0 Hz),7.83(1H,t,=7.5 Hz),7.72(1H,d,=8.0 Hz),7.52(1H,t,=7.0 Hz)给出信号,以及7.39(1H,d,=7.5 Hz),7.27(2H,m),7.07(1H,dd,=7.0,4.5 Hz)给出信号,提示分子中存在2个1,2-二取代苯环。13C-NMR中C167.8、165.6和159.4给出3个酰胺碳信号;低场区给出13个芳香碳信号;此外还给出了4个次甲基信号,1个亚甲基信号和1个甲基信号。以上数据经过与文献进行比对,确定化合物9为cottoquinazoline A[26](图1)。
1.4 抗菌活性测定
病原细菌:燕麦食酸菌()、胡萝卜软腐欧文氏菌()、密执安棒形杆菌、丁香假单胞菌()、青枯雷尔氏菌和野油菜黄单胞菌。
Divas’ Dream超薄三问腕表采用极其纤薄的37毫米18K玫瑰金表壳,精巧灵动,而圆润饱满的扇形表耳则平添了温婉韵致。表耳上排布着明亮式切割钻石更显雍容瞩目。18K玫瑰金表冠上镶嵌着华美的多面切割钻石,与柔和温婉的线条相映成辉。这款精美的珠宝腕表,传承了Divas’ Dream系列以美学技法与精致格调为主题不断演化的魅力,自然需配以华彩夺目的表盘。
采用微量稀释法,测试化合物对几种植物病原细菌的MIC[20]。病原菌振荡培养至对数期,并稀释至106cfu/mL。将待测化合物用DMSO配成10 mg·mL-1母液。每种病原菌采用单独的96孔板进行测试。在96孔板第1列的第1孔加198 μL菌液,余下2—8孔各加100 μL菌液。吸取2 μL化合物母液加入第1孔,混合均匀。采用二倍稀释法将1—8孔依次稀释,即从第一孔中吸取100 μL含药菌液加入第2孔混匀后,从第2孔吸取100 μL含药菌液加入第3孔,并混匀,以此类推。到第8孔混匀后,移除100 μL含药菌液,使每孔都含有100 μL含药菌液,后再每孔加入100 μL菌液,使每孔体积达到200 μL。每个化合物重复3列。用无菌培养基作空白对照,并设立未加化合物的菌液对照,DMSO作阴性对照,空白对照和阴性对照分别做3个孔,硫酸链霉素做阳性对照,测试方法与化合物相同。将96孔板放入生物培养箱中,37℃培养24 h,酶标仪600 nm波长下测量吸光度,并结合肉眼观察,以吸光度出现大幅度变化,且最后一个澄清的孔对应的浓度,作为化合物MIC值。
2 结果
2.1 结构鉴定
核磁波谱数据:1H-NMR(500 MHz,CDCl3):H12.11(1H,s,NH-1),7.53(2H,t,=7.5 Hz,H-13,H-15),7.47(1H,t,=7.5 Hz,H-14),7.41(1H,d,=8.5 Hz,H-8),7.37(2H,m,H-12,H-16),7.07(1H,dd,=8.5,2.5 Hz,H-7),6.65(1H,d,=2.5 Hz,H-5),3.83(3H,s,3-OCH3),3.67(3H,s,6-OCH3);13C-NMR(125 MHz,CDCl3):C160.3(C-2),155.2(C-6),145.7(C-3),138.9(C-4),133.5(C-11),129.9(C-9),129.3(C-12,C-16),128.5(C-13,C-15),128.3(C-14),121.7(C-10),117.5(C-7),117.0(C-8),108.6(C-5),60.3(3-OCH3),55.5(6-OCH3);ESIMS:m/z 282.1 [M + H]+。
(3)注意整个施工过程的维护工作,尤其是进行防渗漏施工时,涂刷好防水涂料后必须要进行一定的防护,防止后期出现其他问题,影响施工质量。
12月13日上午,省自然资源厅召开庆祝改革开放40周年座谈会,回顾自然资源工作历程,展望发展前景。省自然资源厅党组书记、厅长李琥参加会议并讲话。厅一级巡视员王桂鹏主持。厅领导、厅机关和各直属事业单位主要负责同志、退休老干部及基层代表共130余人参加会议。
核磁波谱数据:1H-NMR(500 MHz,CD3OD):H7.34(2H,m,H-7,H-8),7.31(1H,d,=8.0 Hz,H-15),7.24(1H,d,=8.0 Hz,H-6),7.11(1H,m,H-5),6.87(1H,m,H-14),6.80—6.82(2H,m,H-12,H-16);13C-NMR(125 MHz,CD3OD):C160.5(C-2),158.7(C-13),143.0(C-3),136.1(C-4),134.3(C-9),130.6(C-11),128.0(C-15),127.3(C-7),126.3(C-5),123.8(C-6),123.0(C-10),122.1(C-16),117.9(C-12),116.5(C-8),116.0(C-14);ESIMS:m/z 254.1 [M + H]+。
他在云游时曾发现,江浙一带部分僧人宗教生活的全部就是帮人做法事,明码标价,谈拢动身,钵满盈满的他们不喜欢公开,最直接的一条理由无关贪腐,而是数目之咋舌,可能会带来竞争,“都来当和尚怎么办?”
化合物2为白色晶体,ESIMS:m/z 252.1 [M + H]+,结合其氢谱和碳谱,推测分子式为C16H13NO2,不饱和度为11。1H NMR谱H12.66处给出1个酰胺氢特征信号,低场区给出了9个芳香氢信号,以上信息结合TLC特征,推测2与1为同系列化合物。在13C-NMR中,C161.1提示酰胺碳的存在;在低场区给出了14个碳信号,包括5个季碳和9个叔碳;C60.4处的信号提示分子中存在1个甲氧基。以上数据经过与文献对比,确定化合物2为3-- methylviridicatin[22](图1)。
核磁波谱数据:1H-NMR(500 MHz,CDCl3):H12.66(1H,s,NH-1),7.53(2H,t,=7.5 Hz,H-13,H-15),7.49(1H,d,=7.5 Hz,H-14),7.45(1H,t,=7.5 Hz,H-7),7.38(2H,d,=7.5 Hz,H-12,H-16),7.23(1H,d,=7.5 Hz,H-5),7.12(1H,t,=7.5 Hz,H-6),3.85(3H,s,3-OCH3);13C-NMR(125 MHz,CDCl3):C161.1(C-2),145.2(C-3),139.4(C-4),135.5(C-9),133.5(C-11),129.4(C-12,C-16),128.8(C-14),128.4(C-13,C-15),128.2(C-7),126.4(C-5),122.6(C-6),120.9(C-10),116.0(C-8),60.4(3-OCH3);ESIMS:m/z 252.1 [M + H]+。
1.2.1 菌株来源 海洋真菌分离自山东青岛沿海一种未鉴定的海藻,通过形态学及分子生物学鉴定方法确定为杂色曲霉D5。菌种于中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为CGMCC NO. 15386。
化合物1为白色晶体,质谱ESIMS给出分子离子峰m/z 254.1 [M + H]+,结合其氢谱和碳谱,推测其分子式为C15H11NO3,不饱和度为11。在1H NMR中给出了8个芳香氢信号,提示分子中存在2个苯环。在13C NMR中,低场区给出了14个芳香碳和烯碳信号以及1个酰胺碳信号C160.5,其中包括2个连氧的sp2杂化碳信号C158.7和143.0,结合其分子式,提示分子中存在2个羟基。以上数据与文献报道的化合物viridicatol数据一致[21],故鉴定化合物1为 viridicatol(图1)。
除了在磷石膏综合利用方面的协同发展外,何光亮还提到两家企业还会在磷矿石开采进行协同发展,他说:“把开磷的采矿技术和瓮福的选矿技术结合起来,创造的价值将成倍增长。”同时,瓮福集团的氟提取技术也会在开磷集团应用,提高开磷集团在氟化工方面的效益。
核磁波谱数据:1H-NMR(500 MHz,DMSO-6):H12.07(1H,s,NH-1),9.64(1H,s,15-OH),7.41(1H,t,=7.5 Hz,H-7),7.34(1H,d,=7.5 Hz,H-8),7.30(1H,t,=7.5 Hz,H-13),7.09(1H,t,=7.5 Hz,H-6),7.04(1H,d,=7.5 Hz,H-5),6.85(1H,d,=7.5 Hz,H-14),6.71(1H,d,=7.5 Hz,H-12),6.68(1H,s,H-16),3.69(3H,s,3-OCH3);13C-NMR(125 MHz,DMSO-6):C158.5(C-2),157.3(C-15),144.9(C-3),137.6(C-4),135.7(C-9),134.7(C-11),129.5(C-13),128.6(C-7),125.8(C-5),121.9(C-6),119.9(C-10),119.7(C-12),116.0(C-16),115.1(C-8),115.0(C-14),59.5(3-OCH3);ESIMS:m/z 268.1 [M + H]+。
化合物5为白色晶体,ESIMS:m/z 311.1 [M + H]+,结合化合物1H和13C NMR,推断分子式为C17H14N2O4,不饱和度为12。1H-NMR中给出了8个芳香氢信号,1个连氧次甲基H4.07和1个氮甲基信号H3.19;13C-NMR中给出12个芳香碳信号包括1个连氧芳香碳信号,提示分子中存在2个苯环;另外还给出2个酰胺碳信号C168.6和168.4以及1个氮甲基碳信号C31.7。以上数据表明化合物5为dioxopiperazine类衍生物,经过与文献进行比对,确定化合物5为(+)-cyclopenol[24](图1)。
化合物4为白色粉末,ESIMS:m/z 268.1 [M + H]+,结合氢谱和碳谱,推测其分子式为C16H13NO3。1H-NMR中H12.07和9.64处给出2个活泼氢信号,分别对应酰胺氢和羟基氢;低场区给出8个芳香氢信号;H3.69信号提示分子中存在1个甲氧基。1C-NMR中C158.5和157.3证明了酰胺碳和连氧芳香碳的存在;C59.5证明了甲氧基的存在。化合物4与2十分相似,不同之处在于多了1个苯环上的羟基。经过与文献数据比对,确定化合物4为3--methylviridicatol[23](图1)。
核磁波谱数据:1H-NMR(500 MHz,CD3OD):H7.55(1H,m,H-8),7.15(3H,m,H-6,H-7,H-9),7.01(1H,t,=7.5 Hz,H-17),6.71(1H,d,=7.5 Hz,H-16),6.12(2H,m,H-14,H-18),5.48(1H,s,15-OH),4.07(1H,s,H-10),3.19(3H,s,H-19);13C-NMR(125 MHz,CD3OD):C168.6(C-2),168.4(C-5),158.4(C-15),136.4(C-11),134.0(C-8),133.5(C-13),132.2(C-6),130.2(C-17),128.0(C-12),126.1(C-7),122. 3(C-9),118.5(C-18),117.0(C-16),113.9(C-14),71.6(C-3),65.9(C-10),31.7(C-19);ESIMS:m/z 311.1 [M + H]+。
化合物6为白色晶体,HRESIMS:m/z 311.1028 [M + H]+,分子式为C17H14N2O4,不饱和度为12。1H NMR中H7.52(1H,dt,=8.0,1.5 Hz),7.14(1H,d,=8.0 Hz),7.09(1H,dt,=8.0,1.0 Hz),7.01(1H,dd,=8.0,1.0 Hz)提示分子中存在1,2-二取代苯环;H6.97(1H,t,=8.0 Hz),6.66(1H,dd,=8.0,1.5 Hz),6.11(1H,m),6.00(1H,d,=8.0 Hz)提示分子中存在1,3-二取代苯环;13C NMR中给出2个酰胺碳信号C166.0和165.4,1个氮甲基信号即与氢谱对应的芳香碳信号。以上数据与化合物5极为相似,且分子量相同,仔细与文献比对其核磁数据,确定化合物6为(-)-cyclopenol[23](图1)。
核磁波谱数据:1H-NMR(500 MHz,DMSO-6):H7.52(1H,dt,=8.0,1.5 Hz,H-8),7.14(1H,d,=8.0 Hz,H-9),7.09(1H,dt,=8.0,1.0 Hz,H-7),7.01(1H,dd,=8.0,1.0 Hz,H-6),6.97(1H,t,=8.0 Hz,H-17),6.66(1H,dd,=8.0,1.5 Hz,H-16),6.11(1H,m,H-14),6.00(1H,d,=8.0 Hz,H-18),4.23(1H,s,H-10),3.06(3H,s,H-19);13C-NMR(125 MHz,DMSO-6):C166.0(C-2),165.4(C-5),156.9(C-15),135.1(C-11),132.4(C-8),132.3(C-13),130.5(C-6),128.9(C-17),126.5(C-12),124.3(C-7),121.1(C-9),117.0(C-18),115.7(C-16),112.8(C-14),70.1(C-3),63.8(C-10),30.9(C-19);HRESIMS:m/z 311.1028 [M + H]+,333.0849 [M + Na]+。
化合物7为黄色粉末,结合其ESIMS、1H和13C NMR,判断分子式为C19H25N3O4,不饱和度为9。1H NMR中H7.54(1H,s)给出1个NH信号,6.16(1H,d,=6.0 Hz,H-8),5.77(1H,s,H-11),5.49(1H,d,=6.0 Hz,H-9),给出3个芳香氢信号;H5.10给出1个连氮氢信号;H3.69给出1个甲氧基氢信号;H1.13、1.11、0.98和0.84处给出4个甲基信号。13C-NMR给出2个酰胺碳信号C167.3和161.4,4个季碳信号,7个次甲基碳信号,1个亚甲基碳信号,1个甲氧基碳信号和4个甲基碳信号。以上数据与文献报道的versicoloid A极为相似,仔细对比核磁数据,确定化合物7为versicoloid A[23](图1)。
核磁波谱数据:1H-NMR(500 MHz,CDCl3):H7.54(1H,s,NH-2),6.16(1H,d,=6.0 Hz,H-8),5.77(1H,s,H-11),5.49(1H,d,=6.0 Hz,H-9),5.10(1H,d,=5.5 Hz,H-15),4.46(1H,s,H-3),3.69(3H,s,H-20),2.62(1H,m,H-16),2.26(1H,m,H-21),1.20(2H,m,H-17),1.13(3H,d,=7.5 Hz,H-19),1.11(3H,d,=7.0 Hz,H-23),0.98(3H,d,=7.0 Hz,H-22),0.84(3H,t,=7.0 Hz,H-18);13C-NMR(125 MHz,CDCl3):C167.3(C-1),161.4(C-13),159.6(C-6),156.8(C-10),152.9(C-4),144.3(C-8),115.5(C-9),109.3(C-12),94.8(C-11),60.6(C-15),59.2(C-3),55.1(C-20),36.9(C-16),32.4(C-21),23.0(C-17),20.0(C-22),17.8(C-23),15.8(C-19),12.0(C-18);ESIMS:m/z 360.2 [M + H]+。
化合物8为白色粉末,根据HRESIMS数据,判断分子式为C20H27N3O4。化合物8的核磁数据与7很相似,主要的区别在于2个化合物的1,2,4-三取代芳香环(8:C/HC/H-7,C/H-8,C/H-10,129.6/7.65, 125.1/7.38,106.4/7.657:C/H-8,C/H-9,C/H-11,144.3/6.16,115.5/5.49,94.8/5.77)。同时,化合物8中多了1个甲氧基信号C/HC/H-7,51.1/3.92。进一步仔细分析其核磁数据,并与文献进行比对,确定化合物8为chrysopiperazine C[25](图1)。
核磁波谱数据:1H-NMR(500 MHz,CDCl3):H7.65(2H,d,=9.0 Hz,H-7,H-10),7.38(1H,d,=9.0 Hz,H-8),6.99(1H,s,NH-2),5.23(1H,d,=9.0 Hz,H-14),3.92(3H,s,H-22),3.27(3H,s,H-23),2.96(1H,m,H-18),2.53(1H,m,H-15),1.27(1H,m,H-20b),1.23(3H,m,H-17),1.10(3H,d,= 7.0 Hz,H-19),1.04(1H,m,H-20a),0.95(6H,m,H-16,H-21);13C-NMR(125 MHz,CDCl3):C170.3(C-1),161.5(C-12),159.2(C-9),144.9(C-4),140.6(C-6),129.6(C-7),125.1(C-8),121.5(C-11),106.4(C-10),88.7(C-3),60.9(C-14),56.0(C-22),51.1(C-23),36.4(C-18),33.6(C-15),25.3(C-20),20.2(C-17),19.8(C-16),12.6(C-21),11.1(C-19)。HRESIMS:m/z 374.2078 [M + H]+,396.1897 [M + Na]+。
将发酵提取物进行减压硅胶柱层析,以乙酸乙酯-石油醚(0—100%)、甲醇-乙酸乙酯(0—100%)为流动相进行梯度洗脱,分为7个组分(Fr.1—Fr.7)。Fr.2(1.6 g)经ODS反相硅胶柱层析梯度洗脱(甲醇-水,60%—100%),后经过Sephadex LH-20凝胶柱层析(二氯甲烷-甲醇,1/1)得到Fr.2-1—Fr.2-5。Fr.2-5经反相HPLC(70%乙腈-水加0.1%三氟乙酸,2 mL·min-1)纯化制备后得到11(28.1 mg)和12(11.5 mg)。Fr.3(4.5 g)经正相硅胶柱层析(乙酸乙酯-石油醚,5%—100%)分离,后经过ODS反相硅胶柱层析梯度洗脱,流动相采用30%—100%甲醇-水,得到Fr.3-1—Fr.3-6。Fr.3-2经过Sephadex LH-20凝胶柱层析(二氯甲烷-甲醇,1/1),得到6(236.3 mg)。Fr.3-4经过与Fr.3-2相同的分离步骤后,得到1(38.1 mg)。Fr.3-5经过Sephadex LH-20凝胶柱层析(二氯甲烷-甲醇,1/1),后经过100﹕1二氯甲烷/甲醇正相硅胶柱层析纯化,得到Fr.3-5-1—Fr.3-5-3。Fr.3-5-1经HPLC(60%甲醇-水,2 mL·min-1)分离纯化后得到7(46.7 mg)。Fr.3-5-2和Fr.3-5-3分别在二氯甲烷-甲醇=1/1溶液中重结晶,得到2(13.6 mg)和3(5.4 mg)。Fr.3-6经过反复的正相硅胶柱层析,最后通过HPLC制备,流动相为75%甲醇-水,得到8(14.0 mg)。Fr.4(3.3 g)经过30%—90%甲醇-水ODS反相硅胶柱梯度洗脱,后经过Sephadex LH-20凝胶柱层析(二氯甲烷-甲醇,1/1)纯化,得到Fr.4-1—Fr.4-4。Fr.4-2在二氯甲烷-甲醇混合液中重结晶,得到5(118.4 mg)。Fr.4-3经过HPLC纯化,流动相为45%甲醇-(水+0.1%三氟乙酸),得到4(5.1 mg)。Fr.4-3经HPLC 50%甲醇-水制备,得到10(35.8 mg)。Fr.5(2.4 g)经过ODS反相硅胶柱层析梯度洗脱(甲醇-水,30%—90%),然后通过Sephadex LH-20凝胶柱层析(二氯甲烷-甲醇,1/1)分离,最后经反相HPLC(55%甲醇-水,2 mL·min-1)制备,得到9(48.0 mg)。
核磁波谱数据:1H-NMR(500 MHz,DMSO-6):H9.05(1H,d,=4.0 Hz,NH-2),8.10(1H,d,=8.0 Hz,H-10),7.83(1H,t,=7.5 Hz,H-8),7.72(1H,d,=8.0 Hz,H-7),7.52(1H,t,=7.0 Hz,H-9),7.39(1H,d,=7.5 Hz,H-27),7.27(2H,m,H-24,H-25),7.07(1H,dd,=7.0,4.5 Hz,H-26),5.57(1H,s,17-OH),5.24(2H,m,H-3,H-14),4.85(1H,s,H-18),4.07(1H,q,=6.5 Hz,H-20),3.05(1H,dd,=15.0,5.0 Hz,H-15b),2.40(1H,d,=15.0 Hz,H-15a),1.47(3H,d,=6.5 Hz,H-29);13C-NMR(125 MHz,DMSO-6):C167.8(C-1),165.6(C-21),159.4(C-12),147.5(C-4),146.7(C-6),139.8(C-28),136.0(C-23),134.5(C-8),129.3(C-25,C-26),127.3(C-7),127.2(C-9),126.2(C-10),124.4(C-27),120.7(C-11),113.8(C-24),79.8(C-18),74.1(C-17),65.5(C-3),63.4(C-20),53.9(C-14),36.1(C-15a),14.8(C-29);ESIMS:m/z 430.2 [M + H]+。
发酵结束后,用纱布将菌体和发酵液过滤分开,发酵液采用乙酸乙酯萃取两遍,浓缩至干;菌体采用乙酸乙酯浸泡菌体一次,后采用二氯甲烷﹕甲醇=1﹕1浸泡一遍,浓缩后,将未干的溶液用乙酸乙酯萃取3遍,浓缩至干,与菌液提取物合并,得到发酵提取物26.8 g。
化合物10为橘红色粉末,质谱中在m/z 361.1处给出 [M + H]+分子离子峰,结合1H-NMR和13C-NMR数据,推断其分子式为C18H16O8,不饱和度为11。其HPLC吸收与TLC特征提示该10为蒽醌类化合物。1H-NMR中低场区给出3个芳香氢信号,高场区给出1个亚甲基、1个次甲基信号和1个甲基信号,同时给出2个连氧亚甲基信号。13C-NMR中给出2个羰基碳信号,12个芳香碳信号,2个连氧碳信号。以上数据经过与文献进行比对,确定化合物10为versiconol[27](图1)。
核磁波谱数据:1H-NMR(500 MHz,DMSO-6):H12.74(1H,s,1-OH),12.09(1H,s,8-OH),11.17(2H,s,3-OH,6-OH),7.14(1H,s,H-5),7.02(1H,s,H-4),6.50(1H,s,H-7),3.67(2H,m,H-1′),3.45(1H,m,H-2′),3.28(2H,m,H-4′),1.90(2H,s,H-3′);13C-NMR(125 MHz,DMSO-6):C189.0(C-9),181.3(C-10),165.0(C-6),164.2(C-8),163.5(C-3),163.1(C-1),135.0(C-11),132.2(C-14),122.9(C-2),108.8(C-4),108.6(C-5,C-8a),108.2(C-9a),108.1(C-7),62.8(C-1′),60.1(C-4′),35.3(C-2′),32.6(C-3′);ESIMS:m/z 361.1 [M + H]+。
(1)标题序号:引言部分序号为0。正文标题序号分别用阿拉伯数字依次编写,如“1”“1.1”“1.1.1”,四级以下可用(1),①等划分层次。
化合物11为橘红色粉末,通过HRESIMS:m/z 367.0819 [M - H]−,判断分子式为C20H16O7,不饱和度为13。其HPLC吸收提示11与10为同系列蒽醌化合物,但不饱和度和碳个数均多了2。1H-和3C-NMR显示2个化合物蒽醌骨架一致,区别仅在于11的分子中多了2个环结构(C101.1(C-5′),66.1(C-1′),35.2(C-2′),27.4(C-4′),26.9(C-6′),15.4(C-3′)H5.15(H-1′),1.40—1.92(H-2′,3′,4′),1.50(H-6′))。仔细分析其核磁数据,确定化合物11为averufin[27](图1)。
核磁波谱数据:1H-NMR(500 MHz,DMSO-6):H12.29(1H,s,1-OH),11.92(1H,s,8-OH),11.30(1H,s,6-OH),6.95(1H,s,H-5),6.83(1H,s,H-4),6.46(1H,s,H-7),5.15(1H,s,H-1′),1.40—1.92(6H,m,H-2′,3′,4′),1.50(3H,s,H-6′);13C-NMR(125 MHz,DMSO-6):C188.6(C-9),180.5(C-10),165.2(C-8),164.2(C-1),159.8(C-6),158.1(C-3),134.6(C-4a),132.9(C-10a),115.9(C-2),108.9(C-5),108.4(C-9a),108.2(C-8a),107.9(C-7),107.1(C-4),101.1(C-5′),66.1(C-1′),35.2(C-2′),27.4(C-4′),26.9(C-6′),15.4(C-3′)。HRESIMS:m/z 367.0819 [M - H]−。
中药学是研究中药的基本理论和常用中药的性能、功效与临床应用规律等知识的一门学科。中药学在高等中医药院校课程体系中具有承前启后的独特作用和地位[1],是学生由理论基础迈向临证实践的桥梁课,其授课水平将对学生今后的从医之路产生较为直接而深远的影响。中药学体系完整、内容丰富、纵贯古今,对主讲教师而言是一个可以“大有作为”的重要平台。笔者认为,在着力提升中药学教学质量的问题上,授课教师应尽全力打造精彩、非凡、卓越的中药课堂,使学生收获知识、思维、技能、文化等多方面、多层次的情感体验,实现专业教育与德育的“双丰收”,为进一步提升教育教学水平提供有益的尝试和探索。
化合物12为橘红色粉末,通过高分辨质谱,推断其分子式为C20H18O7,不饱和度为12。仔细分析12的1H-NMR和13C-NMR数据,发现其也是一个蒽醌类化合物,比10多了1个不饱和度,碳个数比10多了2个,提示10比12多了1个环结构。化合物12蒽醌骨架的核磁数据与10十分相似,不同之处在于两个化合物的高场区。经过与文献进行比对,确定化合物12为noraverufanin[28](图1)。
核磁波谱数据:1H-NMR(500 MHz,DMSO-6):H12.78(1H,s,1-OH),12.10(1H,s,8-OH),11.27(1H,s,6-OH),10.72(1H,s,3-OH),7.11(1H,s,H-5),7.09(1H,s,H-4),6.58(1H,s,H-7),4.96(1H,d,=14.0 Hz,H-1′),3.61(1H,m,H-5′),1.30—1.97(6H,m,H-2′,3′,4′),1.16(3H,d,=7.5 Hz,H-6′);13C-NMR(125 MHz,DMSO-6):C188.8(C-9),181.1(C-10),165.1(C-6),164.2(C-8),162.7(C-3),161.6(C-1),134.9(C-10a),133.3 (C-4a),120.0(C-2),108.8(C-5),108.7(C-9a),108.7(C-8a),108.4(C-4),108.1(C-7),74.6(C-1′),73.0(C-5′),32.4(C-2′),28.2(C-4′),23.4(C-3′),21.9(C-6′)。HRESIMS:m/z 369.0987 [M - H]−。
2.2 抗菌活性
对化合物1—12进行抗燕麦食酸菌胡萝卜软腐欧文氏菌密执安棒形杆菌丁香假单胞菌青枯雷尔氏菌和野油菜黄单胞菌活性测试,发现在初筛浓度为200和100 µg·mL-1浓度下,仅3,6--dimethylviridicatin(3)对青枯雷尔氏菌和野油菜黄单胞菌表现出了显著的抗植物病原细菌活性。进一步测试其MIC,化合物3对青枯雷尔氏菌和野油菜黄单胞菌的MIC分别为50和100 µg·mL-1(表1),阳性药硫酸链霉素的MIC为25 µg·mL-1。3,6--dimethylviridicatin(3)对其余4种植物病原细菌没有明显的抑菌活性。

图1 化合物1—12的化学结构图
3 讨论
本研究从一株海洋杂色曲霉D5发酵提取物中分离鉴定了12个化合物,包括4个2-羰基-4-苯基喹啉生物碱(1—4)、2个双氧代哌嗪生物碱(5—6)、3个喹唑啉fumiquinazolines生物碱及其衍生物(7—9)和3个蒽醌类化合物(10—12)。曲霉是重要的海洋真菌类群,在海洋真菌中占有很大比例,天然产物研究最多的海洋真菌是海洋曲霉。海洋曲霉源天然产物的研究始于1992年,NUMATA等[29]报道了首例海洋曲霉来源的新天然产物fumiquinazolines A-C,至2014年8月,已报道512个海洋曲霉来源的新天然产物。此后,越来越多的化合物从海洋曲霉中分离出来。2015—2018年,共报道了389个海洋曲霉来源新化合物,这不包括红树林来源的海洋曲霉,这些化合物结构类型多样,包括聚酮、生物碱、萜类、甾体、肽类等,且有多种生物活性,包括抗菌、细胞毒、抗氧化等[8,30-32]。本文所获得的4种结构类型化合物在海洋曲霉中均有过报道。
自然界中的2-羰基-4-苯基喹啉生物碱只由真菌产生,生源途径是由邻氨基苯甲酸衍生而来,目前发现的该类化合物大部分来自于青霉菌,亚热带、温带、寒带环境的青霉中均发现了该类化合物的存在,其中也包括海洋青霉[33]。2-羰基-4-苯基喹啉生物碱的生物活性报道较少,多数研究没有发现其明显的生物活性,但该类化合物抗肿瘤活性显著。Wei等[21]从一株红树来源的青霉sp.发酵提取物中分离鉴定了一个新的2-羰基-4-苯基喹啉生物碱viridicatol,通过核磁及单晶衍射确定了其结构,并发现该化合物对人非小细胞肺癌细胞A549、人肝癌细胞HepG2、人乳腺癌细胞MCF7、人白血病细胞K56具有显著的抑制活性,IC50在16.5—80.0 µg·mL-1;He等[34]从一株海水来源的杨奇青霉()中获得了4种化合物,测试了它们对8种肿瘤细胞的细胞毒活性,其中3*,4*-dihydroxy-4-(4′-methoxyphenyl)- 3,4-dihydro-2(1)- quinolinone对人卵巢癌细胞SKOV-3表现出了中等的毒性,quinolinonepeniprequinolone表现出了强的非选择性细胞毒活性。也有研究报道了2-羰基-4-苯基喹啉生物碱对革兰氏阳性菌中等的抑制活性,Pan等[35]从螃蟹来源的杂色曲霉XZ-4发酵物中分离鉴定出3,6-odimethylviridicatin和9-hydroxy-3- methoxyviridicatin,发现它们对大肠杆菌()具有中等的抗菌活性,MIC为32 µg·mL-1。在本研究中所获得的4个2-羰基-4-苯基喹啉生物碱中,只有3,6--dimethylviridicatin(3)表现了显著的抗植物病原细菌活性。分析其结构特征发现,3与1、2、4结构上的不同之处主要体现在C-6多了1个甲氧基,该甲氧基可能是化合物发挥抗植物病原细菌作用的关键基团。同时,文献中报道了9-hydroxy-3- methoxyviridicatin对大肠杆菌的抑菌作用,表明8-OH可能也是该类化合物发挥抗菌作用的重要基团。
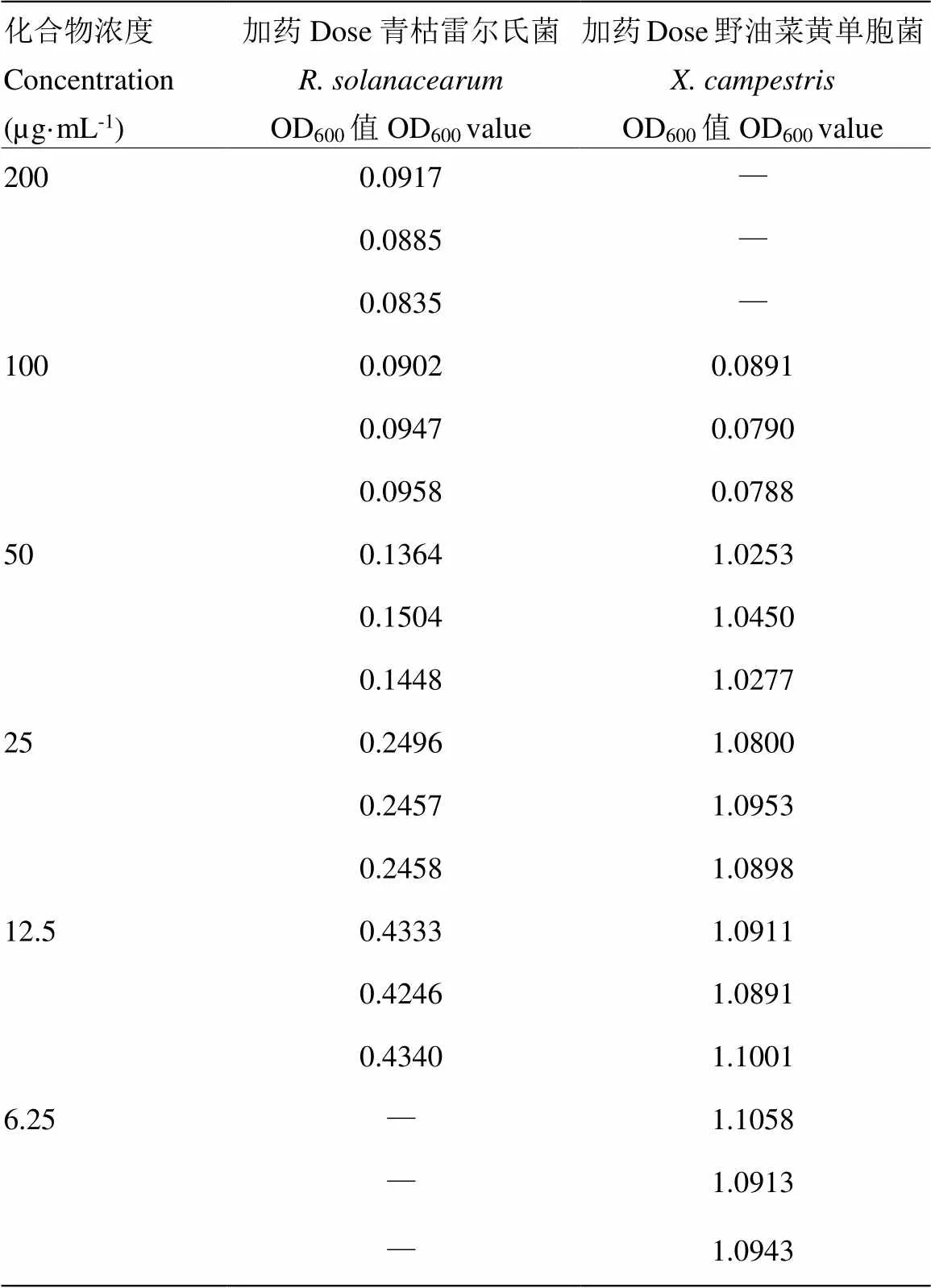
表1 化合物3对青枯雷尔氏菌和野油菜黄单胞菌抑菌数据
未加药菌液OD600分别为0.4733(青枯雷尔氏菌)、1.1362(野油菜黄单胞菌)The OD600of un-treated bacteria solution is 0.4733 () and 1.1362 (), respectively;空白对照OD600分别为0.0711(青枯雷尔氏菌)、0.0763(野油菜黄单胞菌)The OD600of blank control is 0.0711 () and 0.0763 (), respectively。“—”:未测试No test喹唑啉fumiquinazolines生物碱是一类结构新颖独特的化合物,结构特征为包含一个pyrazino [2,1-b] quinazoline-3,6-dione母核,并连接一个吲哚。自1992年首次发现以来,目前共发现了80多个该类化合物,主要由陆地和海洋真菌代谢产生,这类化合物及其前体具有十分显著的生物活性,包括抗肿瘤、抗菌,尤其是在化疗药物方面具有显著疗效[36]。本研究获得了一个喹唑啉fumiquinazolines生物碱(9)和两个未连吲哚的喹唑啉生物碱(7、8),据文献报道,其中8和9的生物活性显著,而并未发现7明显的生物活性。Fremlin等[26]从澳大利亚海沙来源的杂色曲霉中分离获得化合物9,通过核磁及Marfey反应确定了它的结构,活性测试发现了其抗菌作用;Wang等[23]从一株深海来源的杂色曲霉发酵液中获得了化合物8和9,对几种植物病原菌尖孢炭疽菌()、稻瘟病菌()和尖镰孢()表现出了显著的抑菌活性,特别是化合物8对尖孢炭疽菌的抑制效果强于阳性药放线菌酮。本研究发现,所获得的喹唑啉fumiquinazoline生物碱及其衍生物均没有抗植物病原细菌活性,该类化合物结构复杂,新颖度高,且文献报道了它们的抗植物病原真菌活性。因此,值得继续挖掘该类化合物的结构多样性,从中发现抗真菌生物农药先导化合物。
4 结论
从一株海藻来源的杂色曲霉D5发酵培养基中分离鉴定了9个生物碱类化合物(1—9)和3个蒽醌类化合物(10—12)。其中,2-羰基-4-苯基喹啉生物碱3,6--dimethylviridicatin(3)对青枯雷尔氏菌和野油菜黄单胞菌等植物病原细菌具有显著的抗菌活性,6-OCH3可能是该类化合物抗菌作用的关键基团。
[1] GODFRAY H C J, BEDDINGTON J R, CRUTE I R, HADDAD L, LAWRENCE D, MUIR J F, PRETTY J, ROBINSON S, THOMAS S M, TOULMIN C. Food security: The challenge of feeding 9 billion people.,2010, 327(5967): 812-818.
[2] LAMBERTH C, JEANMART S, LUKSCH T, PLANT A. Current challenges and trends in the discovery of agrochemicals.,2013, 341(6147): 742-746.
[3] 钱韦. 《微生物学通报》与中国植物相关细菌研究40年. 微生物学通报, 2014, 41(3): 445-449
QIAN W. Microbiology China and 40 years study on plant-associated bacteria.,2014, 41(3): 445-449. (in Chinese)
[4] SUNDIN G W, CASTIBLANCO L F, YUAN X, ZENG Q, YANG C H. Bacterial disease management: challenges, experience, innovation and future prospects.,2016, 17(9): 1506-1518.
[5] BUTTIMER C, MCAULIFFE O, ROSS R P, HILL C, O’MAHONY J, COFFEY A. Bacteriophages and bacterial plant diseases.,2017, 8: 34.
[6] 冯洁. 植物病原细菌分类最新进展. 中国农业科学,2017, 50(12): 2305-2314.
FENG J. Recent advances in taxonomy of plant pathogenic bacteria.,2017, 50(12): 2305-2314. (in Chinese)
[7] GUAN A, LIU C, YANG X, DEKEYSER M. Application of the intermediate derivatization approach in agrochemical discovery.,2014, 114(14): 7079-7107.
[8] CARROLL A R, COPP B R, DAVIS R A, KEYZERS R A, PRINSEP M R. Marine natural products.,2020, 37(2): 175-223.
[9] WIESE J, IMHOFF J F. Marine bacteria and fungi as promising source for new antibiotics.,2019, 80(1): 24-27.
[10] UCHIDA R, TOMODA H, ARAI M, OMURA S. Chlorogentisylquinone, a new neutral sphingomyelinase inhibitor, produced by a marine fungus.,2001, 54(11): 882-889.
[11] SWATHI J, SOWJANYA K M, NARENDRA K, REDDY K V N R, SATYA A K. Isolation, identification & production of bioactive metabolites from marine fungi collected from coastal area of Andhra Pradesh, India., 2013, 6(6): 663-666.
[12] SILBER J, OHLENDORF B, LABES A, ERHARD A, IMHOFF J F. Calcarides A-E, antibacterial macrocyclic and linear polyesters from astrain.,2013, 11(9): 3309-3323.
[13] WU B, WIESE J, LABES A, KRAMER A, SCHMALJOHANN R, IMHOFF J F. Lindgomycin, an unusual antibiotic polyketide from a marine fungus of the lindgomycetaceae.,2015, 13(8): 4617-4632.
[14] HENRIQUEZ M, VERGARA K, NORAMBUENA J, BEIZA A, MAZA F, UBILLA P, ARAYA I, CHAVEZ R, SAN-MARTIN A, DARIAS J, DARIAS M J, VACA I. Diversity of cultivable fungi associated with Antarctic marine sponges and screening for their antimicrobial, antitumoral and antioxidant potential., 2014, 30(1): 65-76.
[15] NIU S, LIU D, PROKSCH P, SHAO Z, LIN W. New polyphenols from a deep seasp. fungus, and their antibacterial activities.,2015, 13(4): 2526-2540.
[16] WANG R, GUO Z K, LI X M, CHEN F X, ZHAN X F, SHEN M H. Spiculisporic acid analogues of the marine-derived fungus,strain HDf2, and their antibacterial activity.,2015, 108(1): 215-219.
[17] CHEN C J, ZHOU Y Q, LIU X X, ZHANG W J, HU S S, LIN L P, HUO G M, JIAO R H, TAN R X, GE H M. Antimicrobial and anti-inflammatory compounds from a marine fungus,sp..,2015, 56(45): 6183-6189.
[18] ZHAO D L, WANG D, TIAN X Y, CAO F, LI Y Q, ZHANG C S. Anti-phytopathogenic and cytotoxic activities of crude extracts and secondary metabolites of marine-derived fungi.,2018, 16(1): 36.
[19] HUANG R H, GOU J Y, ZHAO D L, WANG D, LIU J, MA G Y, LI Y Q, ZHANG C S. Phytotoxicity and anti-phytopathogenic activities of marine-derived fungi and their secondary metabolites.,2018, 8(66): 37573-37580.
[20] OPPONG-DANQUAH E, BUDNICKA P, BLUMEL M, TASDEMIR D, TASDEMIR D. Design of fungal co-cultivation based on comparative metabolomics and bioactivity for discovery of marine fungal agrochemicals.,2020, 18(2): 73.
[21] WEI M Y, YANG R Y, SHAO C L, WANG C Y, DENG D S, SHE Z G, LIN Y C. Isolation, structure elucidation, crystal structure, and biological activity of a marine natural alkaloid, viridicatol., 2011, 47(2): 322-325.
[22] HODGR R P, HARRIS C M, HARRIS T M. Verrucofortine, a major metabolite ofvar., the fungus that produces the mycotoxin verrucosidin.,1988,51(1): 66-73.
[23] WANG J, HE W, HUANG X, TIAN X, LIAO S, YANG B, WANG F, ZHOU X, LIU Y. Antifungal new oxepine-containing alkaloids and xanthones from the deep-sea-derived fungusSCSIO 05879.,2016, 64(14): 2910-2916.
[24] LI J, WANG J, JIANG C S, LI G, GUO Y W. (+)-Cyclopenol, a new naturally occurring 7-membered 2,5-dioxopiperazine alkaloid from the fungusendogenous with the Chinese mangrove.,2014, 16(5): 542-548.
[25] XU W F, MAO N, XUE X J, QI Y X, WEI M Y, WANG C Y, SHAO C L. Structures and absolute configurations of diketopiperazine alkaloids chrysopiperazines A-C from the gorgonian-derivedfungus.,2019, 17(5): 250.
[26] FREMLIN L J, PIGGOTT A M, LACEY E, CAPON R J. Cottoquinazoline A and cotteslosins A and B, metabolites from an Australian marine-derived strain of.,2009, 72(4): 666-670.
[27] FREDENHAGEN A, HUG P, SAUTER H, PETER H H. Paeciloquinones A, B, C, D, E, and F: new potent inhibitors of protein tyrosine kinase produced by. II. Characterization and structure determination.,1995, 48(3): 199-204.
[28] BRAUERS G, EDRADA R A, EBEL R, PROKSCH P, WRAY V, BERG A, GRAEFE U, SCHAECHTELE C, TOTZKE F, FINKENZELLER G, MARME D, KRAUS J, MUENCHBACH M, MICHEL M, BRINGMANN G, SCHAUMANN K. Anthraquinones and betaenone derivatives from the sponge-associated fungusspecies: Novel inhibitors of protein kinases.,2000, 63(6): 739-745.
[29] NUMATA A, TAKAHASHI C, MATSUSHITA T, MIYAMOTO T, KAWAI K, USAMI Y, MATSUMURA E, INOUE M, OHISHI H, SHINGU T. Fumiquinazolines, novel metabolites of a fungus isolated from a saltfish., 1992, 33(12): 1621-1624.
[30] CARROLL A R, COPP B R, DAVIS R A, KEYZERS R A, PRINSEP M R. Marine natural products.,2019, 36(1): 122-173.
[31] BLUNT J W, CARROLL A R, COPP B R, DAVIS R A, KEYZERS R A, PRINSEP M R. Marine natural products.,2018, 35(1): 8-53.
[32] BLUNT J W, COPP B R, KEYZERS R A, MUNRO M H G, PRINSEP M R. Marine natural products.,2017, 34(3): 235-294.
[33] MICHAEL J P. Quinoline, quinazoline, and acridone alkaloids.,2008, 25(1): 166-187.
[34] HE J, LION U, SATTLER I, GOLLMICK F A, GRABLEY S, CAI J, MEINERS M, SCHUENKE H, SCHAUMANN K, DECHERT U, KROHN M. Diastereomeric quinolinone alkaloids from the marine-derived fungus.,2005, 68(9): 1397-1399.
[35] PAN C, SHI Y, CHEN X, CHEN C T A, TAO X, WU B. New compounds from a hydrothermal vent crab-associated fungusXZ-4., 2017, 15(5): 1155-1163.
[36] RESENDE D I S P, BOONPOTHONG P, SOUSA E, KIJJOA A, PINTO M M M. Chemistry of the fumiquinazolines and structurally related alkaloids.,2019, 36(1): 7-34.
Secondary Metabolites from a Marine-Derived Fungusand Their Anti-Phytopathogenic Bacterial Activity
FU Bing1,2, WANG Mei1, LIU JianYang2, LIN Wei2, ZHANG ChengSheng1, ZHAO DongLin1
(1Marine Agriculture Research Center, Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, Shandong;2Nanping Branch, Fujian Tobacco Company, Nanping 353000, Fujian)
【Objective】Plant bacterial diseases are becoming more and more serious, and lack of control pesticides. The objective of this study is to isolate bioactive compounds from the previously obtained marine-derived fungusD5 with antibacterial activity and abundant secondary metabolites, identify their chemical structures, evaluate their anti-phytopathogenic bacterial activity, so that to clarify the antibacterial components of the target fungus. This research will provide lead compounds for the discovery of new antibacterial pesticides.【Method】The compounds were isolated by silica gel column chromatography (CC), octadecylsilyl silica gel CC, Sephadex LH-20 CC, and semipreparative HPLC, and were identified by modern spectral analysis methods including NMR and MS spectra. In addition, the actibacterial activity of the isolated compounds towards six phytopathogenic bacteria, including,,,,and, was evaluated by double dilution method to obtain the minimum inhibitory concentration (MIC).【Result】Twelve compounds were isolated and identified from the ethyl acetate extract of the marine-derived fungusD5 fermented by potato dextrose water media, including four 4-aryl-quinolin-2-one alkaloids, viridicatin (1), 3--methylviridicatin (2), 3,6--dimethylviridicatin (3), and 3--methylviridicatol (4), two dioxopiperazine alkaloids, (+)-cyclopenol (5) and (-)-cyclopenol (6), three fumiquinazolines alkaloids and their derivatives, versicoloid A (7), chrysopiperazine C (8), and cottoquinazoline A (9), and three anthraquinone derivatives, versiconol (10), averufin (11), and noraverufanin (12). Among them, a 4-aryl-quinolin-2-one alkaloid, 3,6--dimethylviridicatin (3) exhibited an obvious antibacterial activity againstandwith MIC values of 50 and 100 µg·mL-1, respectively. The structure activity relationship analysis revealed that the methoxy group at C-6 might play an important role in anti-phytopathogenic bacterial activity.【Conclusion】The metabolites ofD5 are abundant, which can produce alkaloids and anthraquinones with various structures. Among them, nine alkaloids and three anthraquinones were obtained from cultures of D5. 3,6--dimethylviridicatin (3) exhibited clear antibacterial activities towardsand.
marine-derived fungus;; alkaloid; anthraquinone; structural identification; phytopathogenic bacteria
2020-02-29;
2020-05-08
国家自然科学基金(41806194)、山东省农业重大应用技术创新项目(SD2019ZZ002)、福建省农业科技项目(201735070024072,201735000024112)
付兵,E-mail:fb1501@163.com。通信作者赵栋霖,E-mail:zhaodonglin@caas.cn
(责任编辑 岳梅)

