干燥综合征并发间质性肺疾病与临床免疫学指标的关系
周瑾 殷松楼
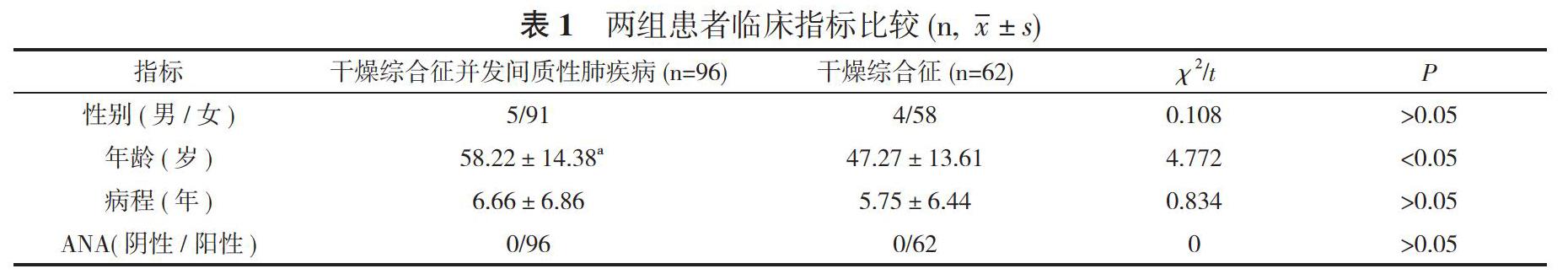
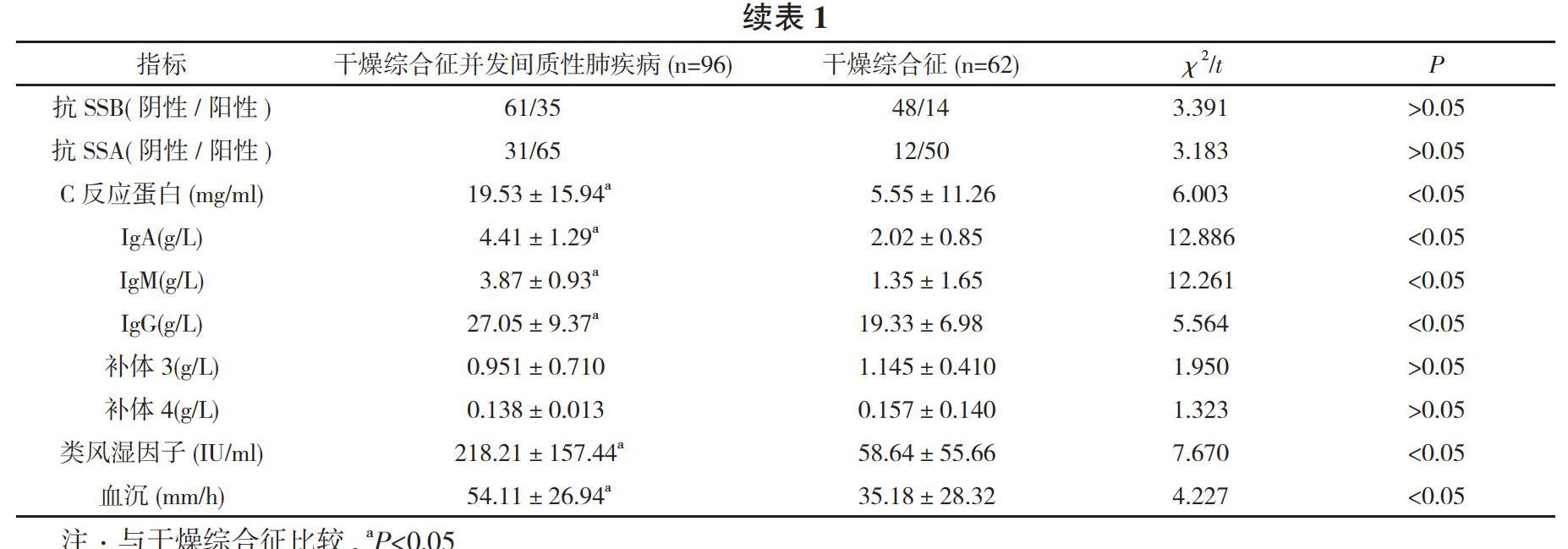
【摘要】 目的 对于干燥综合征并发间质性肺疾病和临床免疫学指标之间的关系进行探讨。方法 选取62例干燥综合征患者和96例干燥综合征并发间质性肺疾病患者作为研究对象, 所选患者均接受实验室检查, 比较两组患者的临床指标[性别、年龄、病程、类风湿因子、血沉、补体、免疫球蛋白、C反应蛋白、抗核抗体(ANA)、抗干燥综合征A抗体(抗SSA)、抗干燥综合征B抗体(抗SSB)]。结果 干燥综合征并发间质性肺疾病患者的年龄、C反应蛋白、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)、类风湿因子以及血沉水平分别为(58.22±14.38)岁、(19.53±15.94)mg/ml、(4.41±1.29)g/L、(3.87±0.93)g/L、(27.05±9.37)g/L、(218.21±157.44)IU/ml、(54.11±26.94)mm/h, 均显著高于干燥综合征患者的(47.27±13.61)岁、(5.55±11.26)mg/ml、(2.02±0.85)g/L、(1.35±1.65)g/L、(19.33±6.98)g/L、(58.64±55.66)IU/ml、(35.18±28.32)mm/h, 差异具有统计学意义(P<0.05);干燥综合征并发间质性肺疾病患者的性别、病程、ANA、抗SSB、抗SSA、补体3、补体4水平与干燥综合征患者比较差异均无统计学意义(P>0.05)。结论 类风湿因子高滴度、高龄、高球蛋白血症患者属于间质性肺疾病的高发人群, 临床中对于干燥综合征患者需要给予积极有效的治疗, 良好控制疾病的活动度。
【关键词】 干燥综合征;间质性肺疾病;C反应蛋白;类风湿因子;免疫球蛋白;补体水平
DOI:10.14163/j.cnki.11-5547/r.2020.25.015
干燥综合征属于导致涎腺功能减退、泪腺功能减退和全身多系统表现的一类慢性炎症性自身免疫疾病[1]。干燥综合征所导致的肺部损害主要病理改变为肺间质病变, 出现几率高达28.0%以上, 严重者会引发患者呼吸衰竭, 现在临床中对于干燥综合征并发间质性肺疾病缺少早期诊断标准[2]。虽然间质性肺疾病属于干燥综合征患者预后不良的主要因素, 但是关于其发病机制还不是十分明确。文献资料显示, 高C反应蛋白能够参与到间质性肺疾病的发病中[3, 4]。对此本文选取2018年7月~2020年3月接诊的62例干燥综合征患者和96例干燥综合征并发间质性肺疾病患者作为研究对象, 对于干燥综合征并发间质性肺疾病和临床免疫学指标之间的关系进行探讨。
1 资料与方法
1. 1 一般资料 选取2018年7月~2020年3月本院接诊的62例干燥综合征患者和96例干燥综合征并发间质性肺疾病患者作为研究对象, 所选患者均符合干燥综合征的诊断标准, 排除感染性疾病、尘肺、恶性肿瘤、结节病以及肺结核。患者均接受肺部高分辨率CT检查, 将蜂窝肺、磨玻璃影以及网格状影作为间质性肺疾病的诊断依据。
1. 2 研究方法 所选患者均接受实验室检查, 检测指标包含ANA、SS抗体(抗SSB、抗SSA)、免疫球蛋白(IgA、IgM、IgG)、类风湿因子、C反应蛋白、补体(补体3、补体4)、血沉水平[5]。比较两组患者临床指标, 包括性别、年龄、病程及实验室指标。
1. 3 统计学方法 采用SPSS23.0统计学软件对数据进行处理。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
干燥综合征并发间质性肺疾病患者的年龄、C反应蛋白、IgA、IgM、IgG、类风湿因子以及血沉水平分别为(58.22±14.38)岁、(19.53±15.94)mg/ml、(4.41±1.29)g/L、(3.87±0.93)g/L、(27.05±9.37)g/L、(218.21±157.44)IU/ml、(54.11±26.94)mm/h, 均顯著高于干燥综合征患者的(47.27±13.61)岁、(5.55±11.26)mg/ml、(2.02±0.85)g/L、(1.35±1.65)g/L、(19.33±6.98)g/L、(58.64±55.66)IU/ml、(35.18±28.32)mm/h, 差异具有统计学意义(P<0.05);干燥综合征并发间质性肺疾病患者的性别、病程、ANA、抗SSB、抗SSA、补体3、补体4水平与干燥综合征患者比较差异均无统计学意义(P>0.05)。见表1。
3 讨论
干燥综合征属于累及人体全身外分泌腺的一类自身免疫性疾病, 比较常见的累及部位包含汗腺、唇腺以及涎腺体, 导致患者出现皮肤干、眼干以及口干等表现症状, 还会累及到患者的血管、肺部以及神经系统等腺外器官, 其中肺部受累的发病率最高, 临床对此需要给予高度的重视[6-8]。
干燥综合征作为一类经常累及患者肺部结缔组织的疾病, 最常见的累及症状为间质性肺疾病, 患者的临床表现不存在典型症状, 属于干燥综合征患者死亡的重要因素[9]。关于干燥综合征并发间质性肺疾病的发病机制目前缺少统一说法, 主要机制为淋巴细胞产生进行性浸润肺间质, 引发腺体上皮增生之后萎缩, 受到增生纤维组织取代, 从而引发病变。病变的出现和肺血管炎密切相关, 血管炎主要是因为冷球蛋白血症以及高球蛋白血症引发, 或是血管壁免疫复合物将补体进行激活, 使其释放中性粒细胞趋化因子, 引发中性粒细胞局部释放氧自由基以及胶原酶, 导致肺实质受到破坏, 进一步产生病变[10-12]。通过本文对比研究资料可见, 选取158例患者作为研究对象, 其中干燥综合征患者62例, 干燥综合征并发间质性肺疾病患者96例。所有患者均接受类风湿因子、血沉、补体、免疫球蛋白、C反应蛋白、ANA、抗SSA、抗SSB检测, 通过统计分析可知, 干燥综合征并发间质性肺疾病患者的年龄、C反应蛋白、IgA、IgM、IgG、类风湿因子以及血沉水平分别为(58.22±14.38)岁、(19.53±15.94)mg/ml、(4.41±1.29)g/L、(3.87±0.93)g/L、(27.05±9.37)g/L、(218.21±157.44)IU/ml、(54.11±26.94)mm/h, 均显著高于干燥综合征患者的(47.27±13.61)岁、(5.55±11.26)mg/ml、(2.02±0.85)g/L、(1.35±1.65)g/L、(19.33±6.98)g/L、(58.64±55.66)IU/ml、(35.18±28.32)mm/h, 差异具有统计学意义(P<0.05);干燥综合征并发间质性肺疾病患者的性别、病程、ANA、抗SSB、抗SSA、补体3、补体4水平与干燥综合征患者比较差异均无统计学意义(P>0.05)。
综上所述, 高球蛋白血症、类风湿因子滴度高在临床诊断干燥综合征并发间质性肺疾病中存在较高的诊断价值, 与此同时年龄较大的患者十分容易产生间质性肺疾病, 所以临床需要对具有上述表现特点的干燥综合征患者提供积极有效的治疗, 严格控制疾病活动度, 从而减慢肺间质纤维化的发病速度, 使患者的预后效果获得改善。
参考文献
[1] 马蕊.一贯煎联合硫酸羟氯喹对干燥综合征肝肾阴虚证患者临床疗效及血清Th17/Treg比率变化影响.辽宁中医药大学学报, 2020, 22(3):116-119.
[2] 刘琳.抗核抗体与抗核抗体谱联合检测诊断自身免疫性疾病的价值分析.中国医药指南, 2020, 18(7):45.
[3] 任云丽.干燥综合征及其相关间质性肺病患者血清25羟维生素D3水平及临床意义.交通医学, 2020, 34(1):32-33, 36.
[4] 顾明年, 郑世江.石斛玉女煎联合艾拉莫德治疗胃热阴虚型干燥综合征疗效及安全性观察.临床合理用药杂志, 2020, 13(5):104-106.
[5] 赵小莹, 白宁, 陈群, 等.干燥综合征患者血清抗α-胞衬蛋白、抗SSA/SSB抗体、IFN-γ及TNF-α与唇腺病理损害相关性研究.陕西医学杂志, 2020, 49(2):241-246.
[6] 冯倩倩, 储晨, 王凤仙, 等. T2 mapping在干燥综合征腮腺损伤早期评估中的应用.医学影像学杂志, 2020, 30(1):27-30.
[7] 张绪利, 郑培兵, 吴昭英, 等.伴原发性干燥综合征的青年缺血性脑卒中2例报道并文献复习.卒中与神经疾病, 2019, 26(6):721-723, 730.
[8] 陈杨畅, 项光博, 金珍木, 等.干燥综合征合并周围神经病变患者T淋巴细胞亚群、CXCL12及CXCR4的变化及意义.现代实用医学, 2019, 31(12):1608-1609, 1622.
[9] 李永明, 陈玥颖, 侯佳奇, 等.解毒通络生津方调控Foxp3~+Treg细胞治疗干燥综合征模型NOD/Ltj小鼠的机制研究.中药药理与临床, 2019, 35(6):125-130.
[10] 刘姣姣, 杨建军, 李海伟, 等.干燥综合征患者服用硫酸羟氯喹引起急性泛发性发疹性脓疱病1例的药学分析.基层医学论坛, 2019, 23(35):5140-5141.
[11] 王娇娇, 张磊, 刘升云, 等.实时剪切波弹性成像联合超声评分在原发性干燥综合征腮腺受损诊断中的价值.中国临床医学影像杂志, 2019, 30(11):773-777.
[12] 許萍.干燥综合征患者的唇腺活检病理表现、自身抗体及其在诊断中的意义.心理月刊, 2019, 14(21):163-164.
[收稿日期:2020-04-26]

