改性钛酸纳米管对锌及共存离子的吸附
马 骏,王雪丽,祁高举,马静慧,周家欢,任宇康
(太原科技大学环境与安全学院,太原 030024)
随着经济的快速发展、工农业等的迅速崛起,越来越多的自然资源被大量开采。尤其是农药、化肥、冶炼等行业,都会造成大量重金属在自然环境中的排放,严重危害人体健康及生态环境[1-3]。锌是仅次于铁、铜、铝的第四“常见”金属,也称亚铅,主要来源于锌矿开采、镀锌、造纸及食品工业,全世界每年通过河流输入海洋的锌约400万吨,严重影响水生生物,同时对人体健康也产生了极大危害[4-5]。
目前,国内外去除水体中重金属离子最主要的方法就是吸附法,但传统的吸附材料如活性炭、沸石、粘土、飞灰和木质素等,由于其杂质较多、吸附时间长、吸附容量低、再生困难等成为了该方法的瓶颈问题[6-9]。本文采用活性炭改性钛酸纳米管复合材料(TNTs@PAC)作为吸附剂,以单一重金属Zn(II)以及Zn(II)、Pb(II)复合离子为目标离子,研究TNTs@PAC对目标离子的吸附效果以及考察共存离子之间的相互影响,通过吸附动力学、吸附等温线以及pH值等实验,分析吸附规律、探讨多种重金属共存时的吸附行为、讨论对重金属离子的吸附机理,在总结研究基础之上,阐明TNTs@PAC作为一种新型吸附材料在重金属污染治理中的应用前景。
1 材料与方法
1.1 材料与仪器
本实验中试剂PbCl2和ZnCl2(化学纯,北京化学试剂公司)、浓HNO3和无水乙醇(分析纯,国药集团化学试剂有限公司)、NaOH(分析纯,国药集团化学试剂有限公司)、P25型纳米TiO2(包含80%锐钛矿和20%金红石,Evonik,德国)、粉末活性炭(100目,DARCO.美国)。
分别称取一定质量的PbCl2和ZnCl2,用去离子水配置1 000 mg/L的储备液,并用硝酸调节pH值约3左右备用,实验中根据实际需要进行稀释。
1.2 材料制备及表征
本实验中使用一步碱热合成法[10-12],将TiO2与100目活性炭粉末等量混合,用10 mol/L的NaOH分散,搅拌24 h后,混合溶液移至高压反应釜,130 ℃下在烘箱内反应72 h,反应后溶液进行离心、水洗、烘干、研磨备用。
用高分辨透射电镜tecnai30 FEG(TEM,美国)进行吸附材料形貌分析;材料晶型结构利用X射线晶型衍射仪(XRD)进行分析;XPS分析在AXIS-Ultra光电子能谱仪(Kratos Analytical,英格兰)上进行;材料的比表面积和孔径采用BET全自动分析仪进行检测。
1.3 实验方法及测定
1.3.1 吸附实验的pH值影响
本实验中,考虑到Zn(II)、Pb(II)的溶度积,为防止过高pH值下重金属离子的沉淀影响,故选取pH值为2~6,初始离子浓度设为50 mg/L,吸附材料用0.2 g/L.吸附平衡之后,取样测定。
1.3.2 吸附动力学实验
该实验中离子初始浓度选取50 mg/L,吸附材料用0.2 g/L,利用稀盐酸和NaOH调节pH值为5,将溶液置于摇床,在常温(25 ℃)、200 r/min下震荡4 h.隔时取样,经0.22 μm的醋酸纤维素膜过滤,稀释后进行离子测定。
吸附平衡后,TNTs@PAC对重金属离子的吸附量(qe,mg/g)和去除率(R%)分别用下式计算:
式中:qe为平衡时重金属离子的吸附量,mg/g;R为重金属离子的去除率,%;Ci和Ce分别为初始时和平衡时重金属离子的浓度,mg/L;V为重金属离子溶液体积,L;m为TNTs质量,g.
1.3.3 等温吸附实验
等温吸附实验设定重金属离子浓度分别为0.1、0.2、0.5、1、2、5 mmol/L,吸附材料量0.2 g/L,调节pH值为5,震荡4 h达到吸附平衡之后,采样进行测定。
1.3.4 实验测定
实验中重金属离子的样品浓度经过稀释和酸化后,通过电感耦合等离子体-原子发射光谱仪(ICP-OES,710-ES,Varian,美国)进行测定。
2 结果与分析
2.1 表征结果分析
如图1改性材料TNTs@PAC所示,碱热之后形成的钛酸纳米管附着于活性炭的颗粒表面,对于钛酸纳米管来讲,其内径约4 nm~5 nm、外径约10 nm的中空管的构型,一端开口或者两端开口,管壁大约5层左右。由于其管径较小,因此部分的纳米管可以镶嵌进活性炭的孔道中,另外的活性碳颗粒也可能附着在钛酸纳米管的管壁而实现对钛酸纳米管的改性。
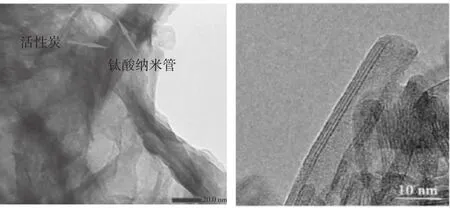
图1 TEM形貌分析Fig.1 TEM images of TNTs@PAC
由改性材料的XRD图中可知,TNTs@PAC在对应位点的衍射峰值与钛酸钠盐的的晶格衍射一致,说明在该结构中Ti、Na+、H+之间的排列相对应,组成的基本骨架相同。只是在26°峰值处观察到了活性炭的石墨晶型,由于被钛酸纳米管覆盖而使其峰值减弱,但证明了改性材料中活性炭的存在[13]。

图2 XRD衍射图Fig.2 XRD patterns of TNTs@PAC
通过对改性材料XPS进行光谱分析(如图3),得出该材料中各元素质量百分比,结果表明,TNTs@PAC的元素组成包括Na(4.8%)、C(58.6)、O(26.8)、Ti(9.8)。通过BET分析可知,改性材料TNTs@PAC的比表面积可达635 m2/g.
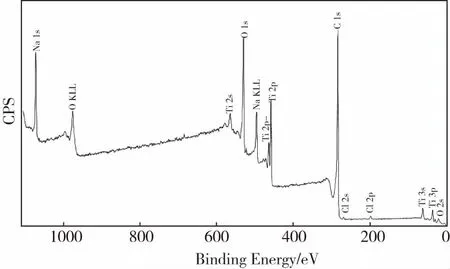
图3 XPS光谱分析图Fig.3 Survey XPS spectra of TNTs@PAC
2.2 改性材料的吸附重金属离子结果分析
2.2.1 吸附动力学
从图4中可以看出,改性材料对锌离子在前60 min内属于一个快速的吸附阶段,之后逐渐趋于平缓,在240 min后达到吸附平衡,吸附量最高达到了94.53 mg/g,前期的快速吸附和改性材料较大的比表面积呈正相关性。

图4 TNTs@PAC的动力学吸附曲线Fig.4 Adsorption kinetics of Zn(II) by TNTs@PAC
通过准一级和准二级反应动力学模型计算分析该吸附实验的结果,模型式如下:
qt=qe-qeexp(-k1t)
此处qt和qe(mg/L)分别是Zn(II)的吸附时间和平衡时污染物的吸附量;k1(min-1)和k2(g/(mg·min))分别是准一级和准二级动力学模型常数。
拟合后吸附材料对Zn(II)的动力学参数见表1,准二级动力学模型更好的描述了吸附剂对于Zn(II)的吸附特征,通过拟合系数和实测值的分析来看,改性材料对Zn(II)的吸附属于化学吸附,表现为溶液中的金属阳离子通过静电作用迁移到TNTs@PAC表面后,与层间H+、Na+进行离子交换。

表1 TNTs@PAC吸附Zn(II)的动力学参数Tab.1 Kinetic parameters for adsorption of Zn(II)
2.2.2 溶液pH值对吸附性能的影响
溶液pH值对吸附反应来讲是一个重要的影响因素,pH值的变化直接会影响溶液中离子的存在状态,也会影响反应中吸附剂与离子的相互作用。从图5中可知,低pH值时,改性材料对Zn(II)的吸附量较小,仅为80.7 mg/g;随着pH值的增加,到pH=5时,吸附量呈现最高值,达到138.3 mg/g;过高的pH值由于会使Zn(II)产生沉淀而出现吸附量降低的情况。共存离子条件下,TNTs@PAC对Zn(II)、Pb(II)的吸附量也是随着pH值增大而逐渐增大,同样的Zn(II)在pH=5时出现拐点,这与Zn(II)单独存在时pH值的影响趋势相同,只是由于Pb(II)的出现而使得TNTs@PAC对复合离子的吸附量都有所减少。共存离子条件下未改变对Zn(II)在pH=5时的最大吸附量。
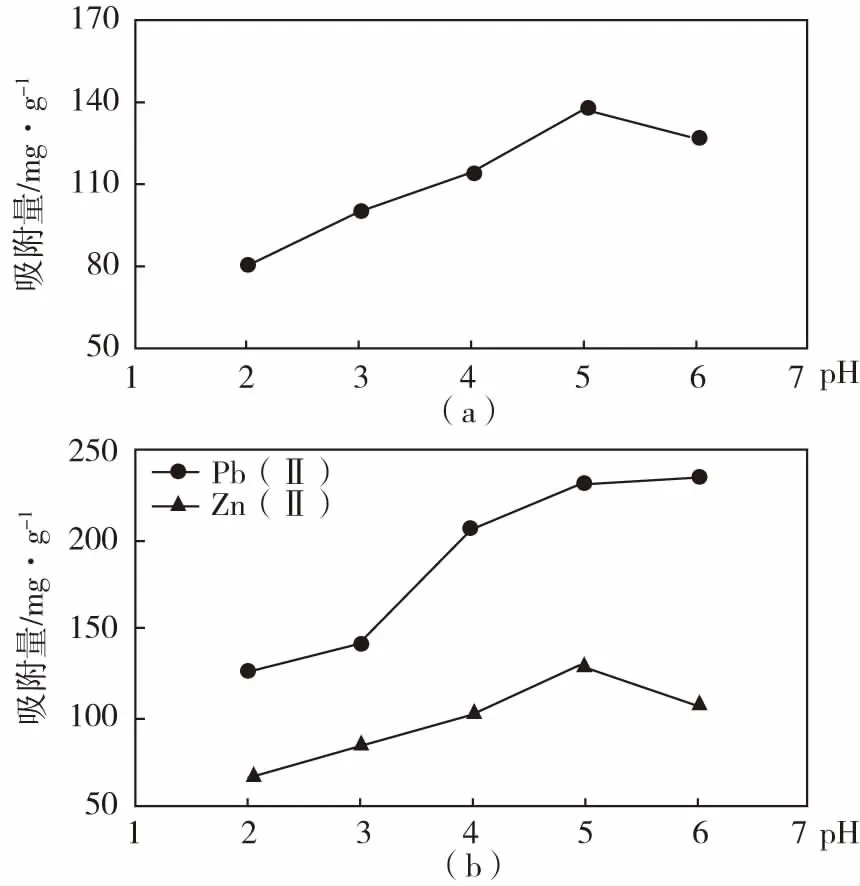
图5 pH值对TNTs@PAC吸附Zn(II)(a)和吸附Zn(II)、Pb(II)复合离子的影响(b)Fig.5 Effect of pH on adsorption of Zn(II)(a) and multiple metal ions Zn(II)、Pb(II)(b) by TNTs@PAC
2.2.3 等温吸附实验
从图6(a)中可以看出,随着Zn(II)离子浓度从0.1~1 mmol/L的增大,反应平衡后TNTs@PAC对Zn(II)的最大吸附量由32.62 mg/g增加至了143.45 mg/g。通过经典Langmuir和Freundlich等温吸附模型拟合分析(见表2),Langmuir模型更好的描述了TNTs@PAC对Zn(II)的等温吸附结果,相关系数R2=0.970 0,单层最大饱和吸附容量达到了161.6 mg/g.

表2 TNTs@PAC吸附Zn(II)的等温吸附模型参数Tab.2 Isotherm model parameters for adsorption of Zn(II) by TNTs@PAC
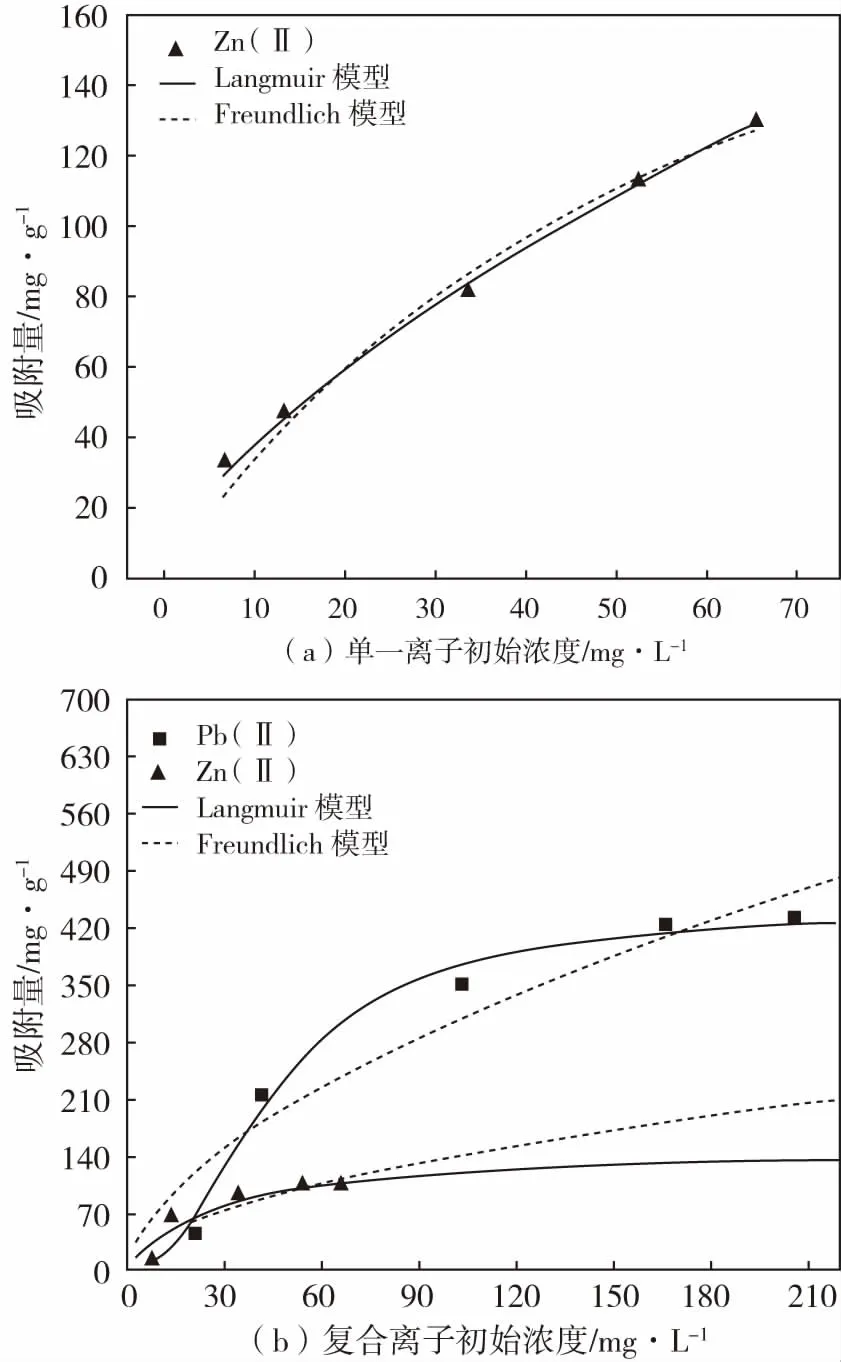
图6 等温吸附中TNTs@PAC对Zn(II)(a)和对Zn(II)、Pb(II)复合离子的吸附量(b)Fig.6 Adsorption isotherms of Zn(II)(a) and multiple metal ions Zn(II)、Pb(II)(b) by TNTs@PAC
对于复合离子的等温吸附同样符合Langmuir模型(如图6b),表明TNTs@PAC对两种重金属离子的吸附都属于单层吸附,随着溶液初始浓度的增加,共存离子的最大吸附量都在增加,直至达到最大值,明显的对Pb(II)的吸附量要远远大于对Zn(II)的吸附量,这与两种离子的水合能大小有关,Pb(II)(1 500.6 kJ/mol)
3 结论
利用一步碱热合成法将纳米TiO2和颗粒活性炭制备出改性复合材料TNTs@PAC,对于重金属离子来讲,展现出了较高的吸附性能,同时对于复合离子的吸附也有较好的效果,对于实际工业废水的治理有很好的指导意义。其中改性材料TNTs@PAC是由钛酸纳米管附着于活性炭的颗粒表面组成;在对重金属Zn(II)的吸附动力学中能够快速吸附,并符合准二级动力学模型,说明该吸附属于化学吸附;pH=5时达到最大吸附,共存离子Pb(II)未能影响对Zn(II)的吸附规律;等温吸附中随着Zn(II)离子浓度从0.1~1 mmol/L的增大,反应平衡后TNTs@PAC对Zn(II)的最大吸附量由32.62 mg/g增加至了143.45 mg/g,Langmuir 模型更好的描述了等温吸附结果,但是对于共存离子来讲,由于Zn(II)水合能大于Pb(II),进而使Pb(II)的存在较大的影响着Zn(II)的去除。

