Fe3O4纳米微球的制备、性能及其在重金属吸附中的潜在应用评估
官小玉,王 梓,常金明,安 盟,陈咏梅,范浩军
(1.陕西科技大学 轻工科学与工程学院,陕西 西安 710021;2.陕西科技大学 中国轻工业皮革清洁生产重点实验室,陕西 西安 710021;3.西华师范大学 化学合成与污染控制四川省重点实验室,四川 南充 637009;4.陕西科技大学 机电工程学院,陕西 西安 710021;5.四川大学 皮革化学与工程教育部重点实验室,四川 成都 610065)
0 引言
改革开放以来,我国工业化水平快速增长,取得的成就及带来的经济效应令世界惊叹,到2017年,国内生产总值跃居世界第二.值得注意的是,我们主观的经济建设在客观上对生态环境造成了破坏,在经济快速发展的同时,环境问题日益突出.在众多的环境问题中,水污染是重中之重,而重金属污染是水污染问题的突出表现形式,对我国水资源及环境安全带来极大的威胁.重金属是比重大于或等于5(ρ≥5.0 g/cm3)的金属,如汞(Hg)、铅(Pb)、锰(Mn)、锌(Zn)、镍(Ni)、钴(Co)、铬(Cr)、镉(Cd)、铜(Cu)等.
近些年来,重金属污染事件在我国不断曝出,例如广西龙江镉污染事件、凤翔血铅事件、嘉陵江铊污染事件、云南曲靖铬污染事件以及甘肃跨省锑污染事件等,这些无一不破坏生态环境、危害公众身体健康,对社会造成极大的负面影响[1-3].当务之急,除了严格管控重金属废水的产生,快速有效治理重金属污染也尤为紧迫.
目前处理重金属废水的方法主要有化学沉降[4]、离子交换[5]、膜处理[6,7]、吸附[8-11]等.吸附法因操作简单、选择性好、效率高、生物可兼容等优点被广泛应用于水体中低浓度重金属的去除[12,13],而研究开发高效低成本吸附剂是吸附法的关键所在.
四氧化三铁(Fe3O4)是一种传统的磁性材料,在我国古代时期就出现了Fe3O4的使用记录,随着社会的进步和科学技术的快速发展,人们对Fe3O4的研究更加深入,对其性能要求也越来越多.对于Fe3O4的研究经历了从微米到纳米的过程,当Fe3O4处于纳米级别时,在结构上不同于固态物质且与单个原子存在较大的区别,正是这种独特的结构使Fe3O4纳米微球具有独特、新颖的物理和化学性能,使得Fe3O4在磁传感器、磁记录、染料、催化剂、生物技术等众多领域都有潜在的应用价值[14-16].
近年来,磁性Fe3O4复合微球广泛应用于水体中重金属离子的吸附[17-21],以纳米Fe3O4为吸附基材具有三大优势:首先,纳米Fe3O4具有小尺寸大比表面积特性,用其作为载体可大大提高吸附剂的吸附效能;其次,Fe3O4表面性能活跃(通常带有活性基团羟基),可为后续的修饰改性提供切入点,因此,Fe3O4基复合材料表面性能具有可调控性;最后,纳米Fe3O4通常具有优良的磁性能,相比于一般的吸附剂(通常需要自然沉降、离心、过滤等分离方法),磁性材料更利于吸附剂与吸附质的有效分离.然而,Fe3O4的磁性与其尺寸和形貌密不可分,尺寸与形貌又与实验条件息息相关,实验条件的变化会影响Fe3O4的生产环境,进而改变Fe3O4的动力学生长状态.因此,合成方法与合成条件的改变对Fe3O4的形貌与性能有很大的影响[22].
本文分别采用共沉淀法、热降解法以及溶剂热还原法合成Fe3O4,并从其形貌、结构、组成、磁性能以及成本等方面对比评估Fe3O4基纳米复合微球吸附剂在重金属吸附领域的潜在应用.
1 实验部分
1.1 材料
七水硫酸亚铁(FeSO4·7H2O)、六水合氯化铁(FeCl3·6H2O)、氨水溶液(NH3·H2O (28.0%~30.0% NH3))、乙酰丙酮铁(Fe(acac)3)、二苄醚(Dibenzyl ether)、油酰胺(Oleamide)、乙二醇(Ethylene glycol,EG)、醋酸钠(Sodium acetate,NaAc)、聚乙二醇(Polyethylene glycol,PEG,Mn=1 500)、无水乙醇、正己烷,均为分析纯,购于成都科龙化工试剂厂.
1.2 仪器及设备
多功能电动搅拌器(DW-2),巩义市予华仪器有限责任公司;电子天平(FA1004),北京赛多利斯天平公司;真空干燥箱(DZF-6020),上海一恒科技有限公司;磁力搅拌油浴锅(DF-101S),巩义仪器厂;旋转涂布仪(SPIN coater,EZ 4),美国Schwan有限公司;场发射扫描电子显微镜(FE-SEM,JSM-7500F),日本电子公司;原子力显微镜(AFM,SPM-9600),日本岛津公司;高分辨透射电子显微镜(HRTEM,JEM-2010),日本电子光学公司;低温氮吸附/脱附试验仪(ASAP 2020),美国麦克公司;振动样品磁强计(VSM,No.735),美国Lakeshore公司;X射线衍射仪(XRD,Philips X′ Pert pro MPD),荷兰 PANalytical分析仪器公司;傅立叶变换红外光谱仪(FT-IR,Nicolet iS10),美国PE公司;能量色散X射线光谱仪(EDS,X-MAX50)日本电子公司;X射线光电子能谱仪(XPS,XSAM800),美国曼彻斯特Kratos公司.
1.3 四氧化三铁(Fe3O4)合成
1.3.1 共沉淀法合成Fe3O4(CP-Fe3O4)
采用化学共沉淀法(chemical coprecipitation)制备四氧化三铁(Ferroferric oxide,Fe3O4)纳米微球具体操作步骤如下[18]:取一定量的六水合氯化铁(FeCl3·6H2O)和七水硫酸亚铁(FeSO4·7H2O),将其溶解于除氧的超纯水(18.2 MΩ cm,25 ℃)中,混合均匀形成Fe3+∶Fe2+摩尔比为1.75∶1的反应液.在连续搅拌及N2保护下,缓慢滴加适量的氨水溶液(NH3·H2O,28.0%~30.0% NH3)直到最终pH接近10,反应液由原来的橙红色变为黑色,然后升温至80 ℃再孵育30 min.反应结束后,黑色沉淀物用磁铁分离,然后用超纯水和无水乙醇交替洗涤5次,最后得到CP-Fe3O4固体,于80 ℃的真空烘箱中干燥至恒重,密封保存以备后续使用.
1.3.2 溶剂热还原法合成Fe3O4(SR-Fe3O4)
溶剂热还原法(solvothermal reduction)制备Fe3O4纳米微球具体步骤如下[23]:1.0 g FeCl3·6H2O 溶解于30 mL的乙二醇(Ethylene glycol,EG)溶液中搅拌均匀以后,再加入0.75 g聚乙二醇(Polyethylene glycol,PEG,Mn=1 500)以及2.7 g醋酸钠(Sodium acetate,NaAc).得到的混合液在室温下(25 ℃)搅拌30 min后转移到聚四氟乙烯反应釜中,200 ℃反应8 h.待反应釜冷却后,用无水乙醇清洗固体产物3次,然后置于60 ℃真空烘箱中干燥至恒重,得到SR-Fe3O4.
1.3.3 热降解法合成Fe3O4(TD-Fe3O4)
热降解法(thermal decomposition),也叫高温还原降解法,通常是以有机铁为前驱体,具体合成步骤如下[24]:取0.796 g乙酰丙酮铁溶解于10 mL的油酰胺与10 mL的二苄醚中,于真空烘箱中110 ℃脱水处理1 h,后加热到300 ℃反应2 h,整个反应过程在N2保护下进行.待反应容器冷却至室温后加入50 mL无水乙醇沉降,分离(离心处理)得到反应产物后再加入正己烷重新分散,如此沉降-离心-再分散过程重复5次以洗涤纯化Fe3O4,最后置于50 ℃真空烘箱中干燥至恒重得到TD-Fe3O4.
1.4 Fe3O4结构表征与性能检测
1.4.1 扫描电子显微镜观察
将CP-Fe3O4和SR-Fe3O4分别分散于无水乙醇中形成10μg/mL的分散液,用毛细管取出适量分散液滴于经食人鱼洗液处理并干燥后的洁净硅片抛光面,后将硅片置于旋转涂布仪样品座上,以2 000 rpm的转速转动20 s将其平铺在硅片表面,N2吹扫干燥.不喷金处理,随即采用扫描电子显微镜(Scanning electron microscope,SEM)进行形貌观察和图像采集,观察CP-Fe3O4和SR-Fe3O4的表面形貌、结构特征和纳米颗粒团聚情况.放大倍率为10万倍,加速电压为5 kV.该扫描电子显微镜同时安装有能量色散X射线光谱仪(Energy dispersive X-ray spectroscopy,EDS),可用来定性及半定量比较并分析材料的元素组成.
1.4.2 原子力显微镜观察
取适量的TD-Fe3O4分散于无水乙醇中形成10μg/mL的分散液,再用毛细管取适量分散液置于载有云母片的铁片上,放置于旋转涂布仪样品座上,以2 000 rpm的转速维持20 s将其平铺在云母片表面,N2吹扫干燥.然后利用原子力显微镜(Atomic force microscope,AFM)探针轻触模式进行表面形貌观察和图像采集.
1.4.3 透射电子显微镜观察
扫描电子显微镜以及原子力显微镜图像虽然立体但仅局限于材料的表面,而透射电子显微镜(Transmission electron microscope,TEM)可以反映材料的内部结构,因此,进一步利用透射电子显微镜观察CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4的形貌结构.将它们分别分散于无水乙醇中形成10μg/mL的分散液,取5μL分散液滴于经辉光放电处理的400目透射电子显微镜碳膜铜网上,N2吹扫干燥后,置入样品室,采集图像.放大倍率为40万倍,加速电压为100 kV.此外,选择区域电子衍射图谱(selected-area electron diffraction (SAED) patterns)可从透射电子显微镜中得到.
1.4.4 氮吸附-脱附测量
气体吸附-脱附法被广泛用来测量纳米微球的比表面积.在本研究中,采用低温氮吸附-脱附法,利用加速表面积和孔隙率分析仪(ASAP 2020,Micromeritics,U.S.)测定CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4的比表面积.实验前,样品在100 ℃条件下真空干燥24 h.
1.4.5 X-射线衍射光谱分析
通过X-射线衍射图谱分析,可以得到材料的结构和形态等多种信息.在本研究中,使用X-射线衍射仪(X-ray diffraction,XRD)测定CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4的衍射图谱,分析样品的物相组成和结构.检测时采用连续扫描模式,扫描电压为40 kV,扫描电流为30 mA,辐射靶源为Cu,波长λ=0.154 056 nm,扫描范围为10 °~70 °,扫描速度为0.06 (°)/s.
1.4.6 傅里叶变换红外光谱分析
固体试样的傅里叶变换红外(Fourier transform infrared,FTIR)光谱检测制样方法包括压片法、薄膜法、石蜡糊法.在本研究中,采用溴化钾(KBr)压片法,具体操作步骤如下:分别取2 mg上述制备的CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4和200 mg光谱级的KBr(200 ℃下脱水处理24 h)混合碾磨均匀,随后,分别取90 mg混合物在不锈钢模具中压制成约1 mm厚的直径为13 mm的圆片.使用红外光谱仪在室温(25 ℃)下于400~4 000 cm-1波数范围内以4 cm-1的分辨率扫描32次收集样品光谱信息.以空白KBr压片作为参考,消除KBr杂质、水和CO2对光谱结果的影响.整个操作在红外灯下进行并且迅速完成,防止空气中的水汽影响实验结果.
1.4.7 X-射线光电子能谱检测
X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)被广泛用于固体材料表面化学或元素组成、化合物结构分析.这里使用X射线光电子能谱仪定性分析CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4结构中铁元素的化学键合情况,实验过程采用单色Al-Kα(1 486.6 eV)辐射源,以恒定40 eV传递能量模式记录电子能谱图,分析室内腔的压力保持在2×10-7Pa,结合能(Binding energy,BE)通过污染碳C 1s跃迁(284.6 eV)进行校正,BE值的精度为±0.2 eV.
1.4.8 振动样品磁强计测量
磁响应性是磁性可回收型吸附剂最为重要的性能之一.反映磁响应性最为重要的参数是饱和磁化强度(Ms).本文利用振动样品磁强计(Vibrating sample magnetometer,VSM)测定室温下(25 ℃)相同质量CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4的直流磁滞回线,施加磁场强度的范围为-15 000~+15 000 Oe,从磁滞回线中能得出磁性材料的饱和磁化强度值.
2 结果与讨论
2.1 Fe3O4形貌观察
化学共沉淀法、溶剂热还原法、高温降解法是制备Fe3O4纳米微球常见的三种方法,只要反应条件合理控制,Fe3O4颗粒的尺寸、形貌以及组成在一定范围内可调控.
图1是CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4的扫描电子显微镜图(a1、b1)、原子力显微镜图(c1)、透射电子显微镜图(a2、b2、c2)以及粒径分布直方图(a3、b3、c3).从三维电镜图片中,首先,可以看出三种Fe3O4均呈现标准的球状体,除了SR-Fe3O4,其他两种Fe3O4尺寸大小都较集中;其次,当分散溶剂挥发以后,CP-Fe3O4纳米粒子倾向聚集在一起,而SR-Fe3O4以及TD-Fe3O4的单分散效果依然很好;最后,可以看出SR-Fe3O4的表面非常粗糙,究其原因,可从其生长原理分析.
在溶剂热还原法(SR)中,Fe3O4的成长是靠凝聚初级的纳米晶体然后再自组装形成一个较大的球体,这种方式形成的产物通常也叫次级或二级Fe3O4[25].二维透射电子显微镜的结果与三维电镜结果类似,只是TD-Fe3O4的球状效果不是特别明显.进一步,利用商业化图像处理软件Image J(National Institutes of Health,NIH,U.S.)将扫描电镜以及原子力显微镜图像转换为8位灰度图像,基于合理灰度阈值进行颜色分割,获取Fe3O4纳米颗粒直径大小分布直方图.如图1(a3)所示,CP-Fe3O4颗粒的平均直径为21.8 nm,直径最大不超过30 nm,与文献报道的氨水共沉淀法制备的Fe3O4粒径范围大致相当[26].SR-Fe3O4的平均直径为280.5 nm,尺寸波动较大,介于150~370 nm之间,与电镜结果吻合.针对溶剂热还原法,在特定的反应温度下(200 ℃),反应时间长短对SR-Fe3O4最终尺寸影响很大,时间越长,得到的产物其尺寸越大.TD-Fe3O4的平均粒径为10.3 nm,且粒径分布较窄.一般情况下,纳米微球尺寸越小会越容易团聚,因此,高温还原降解法是制备小尺寸与单分散兼具的理想方法.进一步采用低温氮气吸附/解吸法测得CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4的比表面积分别为55.2 ± 1.2 m2/g,32.2 ± 0.8 m2/g和70.6 ± 1.9 m2/g.纳米微球尺寸越小,其比表面积越大,该结果与各Fe3O4尺寸大小相吻合.

(a1)CP-Fe3O4 SEM图 (a2)CP-Fe3O4 TEM图 (a3)CP-Fe3O4粒径分布图

(b1)SR-Fe3O4 SEM图 (b2)SR-Fe3O4 TEM图 (b3)SR-Fe3O4粒径分布图
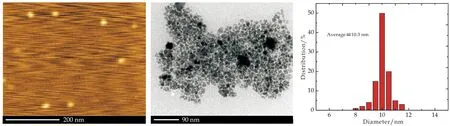
(c1)TD-Fe3O4 AFM图 (c2)TD-Fe3O4 TEM图 (c3)TD-Fe3O4粒径分布图图1 CP-Fe3O4、SR-Fe3O4、TD-Fe3O4电镜图及粒径分布直方图
2.2 Fe3O4结构分析
理论上,通过X射线衍射测试可获得物质物相组成、内部原子或分子的结构形态等信息,因此从其图谱中能明确材料的晶体结构.Fe3O4是一种晶体,通过XRD谱图可以判断本研究采用三种不同方法合成Fe3O4的晶型及纯度.从图2可以看出,三种方法得到的Fe3O4在2θ=30.0 °、35.4 °、43.0 °、53.4 °、57.0 °和62.5 °处均出现强衍射峰,分别对应于Fe3O4的(220)、(311)、(400)、(422)、(511)和(440)六个晶面,其峰位和相对强度与标准JCPDS(74-748)数据[27,28]吻合,证明CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4均是反式尖晶石结构,因此,合成方法的差异并不影响Fe3O4的晶型结构.另外,除了这六个明显的衍射峰,基本上无其他杂质峰,说明本研究合成的四氧化三铁纯度较高.值得注意的是,在Fe3O4合成过程中一定要严格控制反应条件,否则很容易变性,体现在XRD谱峰中存在杂质峰,且Fe3O4的磁性能、表面性能等受到影响.除了X射线衍射技术,本研究还采用选择区域电子衍射图谱(selected-area electron diffraction (SAED) patterns)来进一步分析Fe3O4的晶体结构,结果如图2右侧所示.通过分析可知,SAED谱图的衍射圈刚好与XRD谱图完全对应,进一步说明本研究合成的Fe3O4是反式尖晶石结构且纯度高.
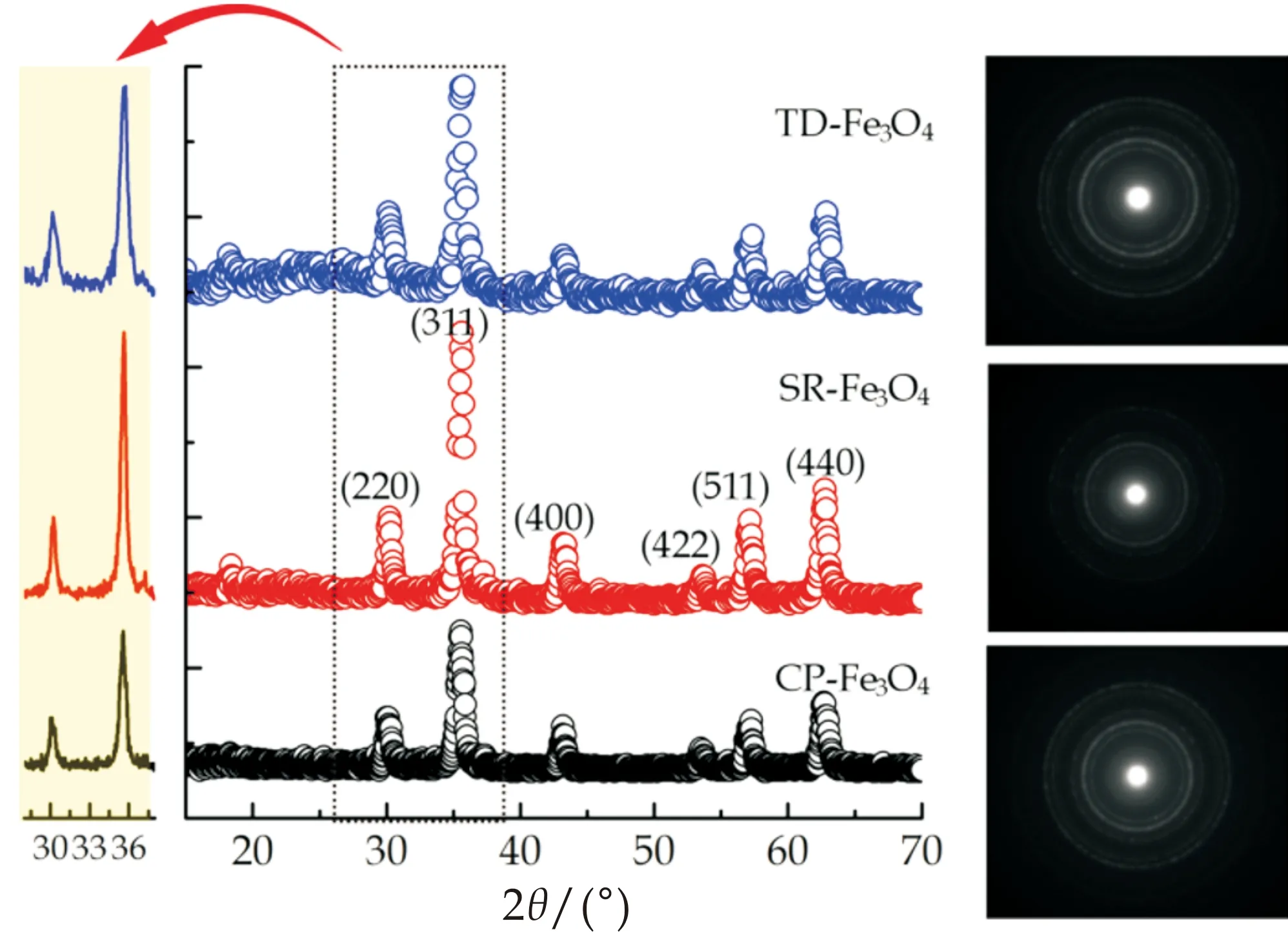
图2 CP-Fe3O4,SR-Fe3O4以及TD-Fe3O4的X射线衍射图谱以及相应的选择区域电子衍射图谱(图右侧)
基于XRD谱峰衍射角度θ和对应的衍射峰的半峰宽(Full Width at Half-Maximum,FWHM),Fe3O4的晶体粒子尺寸可采用Debye-Scherrer(德拜-谢乐)公式(1)进行估算:
D=Kλ/βcosθ
(1)
式(1)中:D代表晶体粒子的平均直径,λ为入射X光的波长,K为谢乐常数,θ为衍射角,当β为半峰宽时K取0.89.在这里,波长λ=1.540 6 Å,β代表FWMH,因此K的值取为0.89.另外,计算晶体尺寸一般采用较低角度的衍射峰.于此,选择2θ=30.0 °和35.4 °衍射峰,进一步根据式(1)计算得到CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4的平均粒径分别为19.1 nm、256 nm以及11.2 nm,与图像处理软件Image J得到的结果比较吻合.
2.3 Fe3O4组成成分检测
预对Fe3O4进一步改性并应用于废水中重金属离子的吸附,对其组成成分的检测与分析是非常必要的.在本研究中,采用能量色散X射线光谱(EDS)、傅里叶变换红外(FTIR)光谱以及X射线光电子能谱(XPS)来分析.EDS具有定性与半定量分析材料组成成分的功能,从图3(a)可以看出,这三种Fe3O4除了检测到Fe和O元素之外,没有检测到第三种元素,说明其纯度很高,与晶体结构分析的结果吻合.另外,分析Fe和O的相对含量,发现CP-Fe3O4与SR-Fe3O4中O/Fe的原子百分含量接近于2(67.3/32.7),远大于1.33,而在TD-Fe3O4中,O/Fe值为1.49(59.8/40.2),与1.33比较接近.实际上,通过不同方法得到的Fe3O4虽然晶体结构没有区别,但是其表面性能是有差异的.共沉淀法以及溶剂热还原法合成Fe3O4的铁源、溶剂以及其他催化剂、还原剂等都是亲水的,因此,它们的产物,即CP-Fe3O4与SR-Fe3O4也是亲水性的,表面含有大量的羟基(-OH)功能基团,这就是O/Fe的原子百分含量大于1.33的原因.采用热降解法合成Fe3O4,整个过程在疏水环境中进行,其表面基本不含有-OH,所以O/Fe值接近于1.33.表面性能不同将影响Fe3O4后续改性及其进一步应用.
图3(b)是Fe3O4的FTIR谱图,发现CP-Fe3O4、SR-Fe3O4以及TD-Fe3O4在570 cm-1处均出现吸收峰,归因于Fe-O伸缩振动,这与文献报道的Fe-O伸缩振动吸收一致[29];此外,在CP-Fe3O4和SR-Fe3O4谱图中,出现了-OH吸收峰(~3 400 cm-1),而在TD-Fe3O4结构中并不明显,该结果与EDS相吻合.
XPS是一种多功能的表面分析技术,通常用于材料的元素组成及其化学状态分析,分为XPS全谱图和高分辨图:全谱图用于样品中元素组成分析,高分辨图则用于元素的化学状态分析.针对Fe3O4元素组成,已经通过EDS证明含有Fe和O两种元素,因此,在本研究中,主要利用XPS的高分辨图分析Fe元素的存在状态.据文献记载,Fe元素的自旋运动与电子轨道运动分别产生自旋磁矩和轨道磁矩,二者间存在电磁相互作用,使Fe元素2P轨道分裂为2p1/2与2p3/2,Fe 2p1/2与Fe 2p3/2的XPS峰位取决于Fe元素的离子态,另外,Fe 2p1/2与Fe 2p3/2卫星峰的位置能反映该铁化合物的氧化态[30-32].理论上,Fe3O4的Fe 2p轨道没有卫星峰,而FeO和Fe2O3中的Fe3+与Fe2+有卫星峰[33,34](Fe3+卫星峰位于718.8 eV[28],Fe2+的卫星峰在714.8、729.5 eV左右).从图3(c)可以看出,CP-Fe3O4、SR-Fe3O4和TD-Fe3O4结构中的Fe 2p高分辨XPS中出现了712.3 与 724.9 eV的信号峰,分别对应于Fe3O4的Fe 2p3/2和Fe 2p1/2.除此之外,没有检测到其他卫星峰,再一次证明本研究合成的Fe3O4纯度很高,并没有被氧化成其它铁化合物,如FeO、γ-Fe2O3等.

(a)能量色散X射线光谱
2.4 Fe3O4磁响应性能
作为吸附材料,磁响应性能非常重要,是实现利用磁场控制吸附剂从水相中分离的关键,也是磁性吸附剂与其它传统吸附剂相比的最大优势所在.前已述及,衡量材料磁性的主要参数是饱和磁化强度,值越大,磁性分离时间越短.图4是CP-Fe3O4、SR-Fe3O4和TD-Fe3O4的磁滞回线图,进一步可得到它们的饱和磁化强度值分别为78.3 emu/g、93.4 emu/g以及87.5 emu/g.磁性微球的饱和磁化强度值受多种因素影响,包括材料粒径大小、表面性能、纯度等.一般情况下,尺寸越大、纯度越高、材料表面无包覆层,其饱和磁化强度值越高,磁性能越好.因此,SR-Fe3O4的饱和磁化强度值最高,可归因于其较大的尺寸;虽然CP-Fe3O4尺寸大于TD-Fe3O4的,但可能由于CP-Fe3O4表面具有一层含-OH的保护层,所以减弱了CP-Fe3O4的磁性能.另外,如图4中插图(以CP-Fe3O4为例)所示,CP-Fe3O4可均匀分散在溶液中,一旦施加外部磁场,CP-Fe3O4便全部聚集在磁铁周围,表现出灵敏的磁场刺激-响应性,当所有纳米颗粒聚集后,原来呈现黑色的分散液变成澄清透明的溶液.
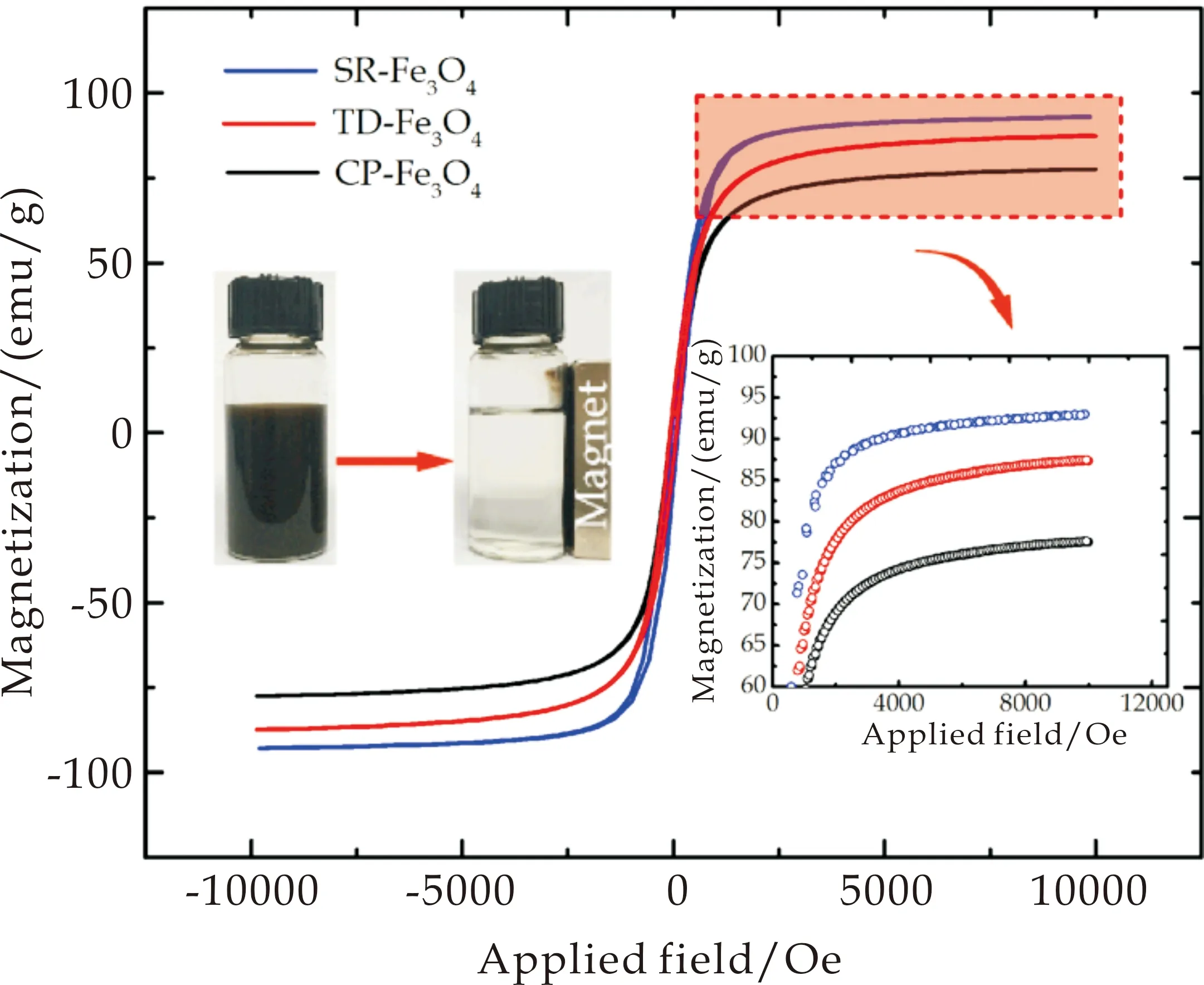
图4 CP-Fe3O4,SR-Fe3O4和TD-Fe3O4的磁滞回线
2.5 Fe3O4纳米微球在重金属吸附中的潜在应用评估
在本研究中,采用了三种方法合成Fe3O4,分别是化学共沉淀法(chemical coprecipitation,CP)、溶剂热还原法(solvothermal reduction,SR)以及热降解法(thermal decomposition,TD),分别简写成CP-Fe3O4、SR-Fe3O4和TD-Fe3O4.通过结构、组成与性能检测分析,得到它们的基本性质与参数,包括尺寸大小、比表面积、分散性、饱和磁化强度值以及亲疏水性能,结果见表1所示.那么,将这三种Fe3O4分别用于水体中重金属离子的吸附,其潜在应用如何呢?以下,本文将进行深入分析:
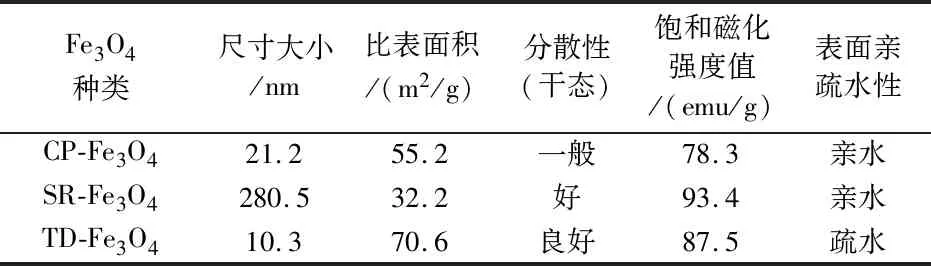
表1 采用化学共沉淀法(CP- Fe3O4)、溶剂热还原法(SR- Fe3O4)以及热降解法(TD-Fe3O4)合成Fe3O4的基本性质与参数
首先,由于TD-Fe3O4表面的疏水性能,很难在水体中分散,因此必须先对其进一步改性才能应用于水体中重金属离子的吸附.当然,不管Fe3O4表面亲疏水性能如何,很少有研究将Fe3O4直接用作吸附剂,因为Fe3O4在自然环境下比较容易被氧化且不耐酸腐蚀.基于此,对裸核Fe3O4表面改性是研究热点,除了能保护核结构,可进一步赋予Fe3O4更多的表面功能性质.然而,表面疏水化的Fe3O4(TD-Fe3O4)改性步骤往往要多于亲水性的(如CP-Fe3O4和SR-Fe3O4),例如通常用正硅酸乙酯包覆TD-Fe3O4,使其表面带有活性-OH以后进一步后续的改性,而CP-Fe3O4和SR-Fe3O4本身带有-OH,可直接功能化改性.因此,从后续改性方面考虑,表面亲水性的CP-Fe3O4和SR-Fe3O4更适合用于水体中的重金属离子吸附.
众所周知,共沉淀法是制备Fe3O4纳米微球最普遍的方法之一,这种方法突出的优点是成本低、操作方便、条件易控制且能大批量生产;而热降解法需要高温设备、成本高(包括试剂原料以及设备等)、操作麻烦、反应条件严苛且难以大批量生产;溶剂热还原法各方面居中.因此,从反应条件、成本、生产剂量等角度考虑,CP-Fe3O4最适合用于水体中重金属离子的吸附,且最有希望实现工业化;很明显,TD-Fe3O4大多集中于实验室研究.
由于Fe3O4的尺寸大小、比表面积、分散性、饱和磁化强度值性能息息相关,即粒径大小会影响比表面积、分散性、饱和磁化强度值,于此,综合考虑这些性能.作为吸附材料或基材,大比表面积有利于后续功能基团的固定,从而大大提高吸附剂的吸附效能.理论上,尺寸越小,比表面积越大,但由于尺寸太小微球本身容易团聚,也可能会影响其比表面积.所以,微球吸附剂的尺寸、比表面积、分散性往往难以平衡.就本研究来讲,若从吸附效能考虑,TD-Fe3O4最好,CP-Fe3O4次之,SR-Fe3O4最差;若从磁性分离效果考虑,SR-Fe3O4最好,TD-Fe3O4次之,CP-Fe3O4最差.另外,值的注意的是,SR-Fe3O4表面较粗糙,不同于TD-Fe3O4和CP-Fe3O4的,可潜在用作特殊功能材料改性的基材,如需要较大构象转变的光敏化合物.
最后,再探讨下重金属离子的种类是否有影响?前已述及,Fe3O4在吸附剂中往往只充当基材的功能,即需要对Fe3O4进行后续改性再应用于重金属离子吸附,因此,Fe3O4基复合微球吸附剂表面的功能基团将直接决定其能否吸附某种特定金属离子.例如,羧基、酚羟基等表面功能基团能吸附溶液中绝大多数的金属离子.
综上所示,CP-Fe3O4、SR-Fe3O4和TD-Fe3O4用于水体中重金属离子的吸附各有其突出优点:如CP-Fe3O4应用成本低,TD-Fe3O4吸附效能好,SR-Fe3O4分散性好且磁性分离效果好,因此,选择何种方法来合成Fe3O4需要根据具体情况进行综合考虑.
3 结论
在本研究中,采用化学共沉淀法、溶剂热还原法以及热降解法合成Fe3O4,分别得到CP-Fe3O4、SR-Fe3O4和TD-Fe3O4三种纳米微球.利用SEM、TEM、AFM、XRD、SAED、EDS、FTIR、XPS以及VSM技术对其形貌、结构、组成、磁性能进行详细表征,结果表明:CP-Fe3O4、SR-Fe3O4和TD-Fe3O4均呈现球状体,具有反式尖晶石结构且纯度很高,但这三种Fe3O4的尺寸、比表面积、分散性、磁性能、亲疏水性有一定差异.CP-Fe3O4平均粒径大小为21.2 nm,比表面积是55.2 m2/g,分散性较差,饱和磁化强度值为78.3 emu/g,表面含亲水基团-OH;SR-Fe3O4平均粒径较大,高达280.5 nm,对应比表面积很小,低至32.2 m2/g,分散性很好,磁性能很好,饱和磁化强度值高达93.4 emu/g,表面也含亲水基团-OH;TD-Fe3O4平均粒径最小,为10.3 nm,因此比表面积很高,为70.6 m2/g,分散性较好,磁性能中等,饱和磁化强度值为87.5 emu/g,但表面是疏水的.
最后,结合上述各参数以及反应成本、操作条件等综合分析这三种Fe3O4用于水体中重金属离子的吸附,结果表明,CP-Fe3O4、SR-Fe3O4和TD-Fe3O4各有其优势与劣势,最终选择何种方法来合成Fe3O4需要视实际情况而定.

