嗜纤维杆菌厌氧发酵正丁醇葡萄糖和木糖的配比优化
郭文瑶,龚国利,刘荣杰,吴 咪,薛志飞,田 露
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
生物丁醇具有燃烧值高、疏水性强、挥发性低以及可与汽油以任意比例混合等优点,成为仅次于燃料乙醇的新一代可再生生物燃料.它的能量密度、汽化热、空气燃料比和辛烷值与汽油相似[1,2],且丁醇比乙醇有更高的能量密度、更低的挥发性、水的混溶性、可燃性和腐蚀性,可与现有的燃料基础设施配套使用,直接替代汽车发动机中的汽油,无需对汽车进行任何改造[3].此外,丁醇还可应用在生活中的大部分塑料制品及染料产品,如安全玻璃、涂料、洗涤剂等.因此,利用生物质发酵生产正丁醇具有很高的研究价值[4].但是可用于生物丁醇生产的发酵底物成本相对较高[5,6],且常见的丙酮丁醇发酵,原料通常占总生产成本的50%以上[7],所以在难以找到可广泛利用的原料的情况下降低成本,探索原料的配比尤为重要.
能进行丁醇生产的微生物主要是一些产溶剂梭菌,如丙酮丁醇梭菌、拜式梭菌、糖丁酸梭菌等[8],其中丙酮丁醇梭菌的发酵过程分为两个阶段:产酸阶段(细胞生长期)和产溶剂阶段.在产酸阶段,菌株迅速生长,产生大量的H2和CO2,乙酸和丁酸逐渐积累,pH下降.当pH下降到一定值时,代谢转向产溶剂阶段,乙酸和丁酸被消耗,pH回升.在溶剂产生后期,由于营养物质的缺乏及代谢产物的毒性作用,菌体逐渐衰亡,产生芽孢(如图1所示).目前丙酮丁醇梭菌产生丁醇的最高产量仅为30 g/L.此外,还会产生乳酸和乙酸等有机酸的副产物,造成能量消耗,增加了下游工艺产品纯化的难度.同时,其他丙酮丁醇梭菌无法同时利用葡萄糖和木糖,有严重的CCR(碳代谢物阻遏效应)现象,且不能直接利用纤维素做底物.

图1 丁醇发酵途径[9-12]
微生物作为生物燃料生产中的重要参与者,其性能好坏直接影响产品的产量和质量[13].嗜纤维杆菌具有很高的产纤维素和乙酸/丁酸能力,是生产正丁醇的理想原料.但是目前自然界存在的天然微生物菌株不能满足丁醇商业化生产的需求,需要采用代谢工程和基因工程手段构建能够高效利用木糖的菌株[14].Teng Bao等[15]从丙酮丁醇梭菌中引入三种不同的由bdhB、adhE1和adhE2基因编码的醛/醇脱氢酶到嗜纤维杆菌中,其中过表达adhE2菌株的正丁醇产量最高,达4.0 g/L,产率为0.22±0.01 g/g.在木质纤维素的水解产物中,产乙醇微生物对木糖等五碳糖的利用率非常低,有些微生物虽然能利用这些五碳糖,但不能将它们转变成乙醇.
因此,本文拟通过实验室改造的嗜纤维杆菌(C.cellulovorans)adhE2菌株进行厌氧发酵,探究葡萄糖和木糖同时使用的抑制情况.利用不同比例的葡萄糖和木糖检测该发酵方法是否有碳代谢物阻遏效应(CCR)反应.该结果对实现重复分批发酵的长期稳定运行及将来对菌株的进一步代谢改造有一定意义.
1 材料和方法
1.1 实验材料及设备
1.1.1 菌株
本文以嗜纤维杆菌adhE2为实验菌株,该菌株是以嗜纤维杆菌为底盘细胞通过基因改造加入编码醛/醇脱氢酶adhE2(aldehyde-alcohol dehydrogenase)的基因,可直接利用纤维素,且经过代谢改造已实现CBP生产丁醇.CBP将酶生产、纤维素水解、发酵三步合成为一个工艺步骤,大大减少了资金投入,是工业应用中最经济、最理想的方法[16].改造后的嗜纤维杆菌adhE2能将丁基辅酶a转化为正丁醇,将乙酰辅酶a转化为乙醇[17].且该菌株可以利用多种底物,包括纤维素、木糖、果胶、纤维二糖、葡萄糖、半乳糖、蔗糖、乳糖和甘露糖.使用经改造的嗜纤维杆菌adhE2一定程度缓解了ABE生产正丁醇成本高的限制.总的来说,该菌株能够提高丁醇生产强度和对木质纤维素生物质的利用能力.
1.1.2 培养基
种子培养基:TGY(Tryptone Glucose Yeast)培养基:胰蛋白胨30.0 g,葡萄糖20.0 g,酵母粉1.0 g,L-半胱氨酸1.0 g,水1 000 mL,pH 6.5,121 ℃湿热灭菌20 min.
发酵培养基:K2HPO4·3H2O 2.9 g/L,KH2PO41.5 g/L,(NH4)2SO41.3 g/L,酵母膏2.0 g/L,蛋白胨4.0 g/L,MgCl2·6H2O 0.2 g/L,CaCl2·2H2O 0.075 g/L,FeSO4·7H2O 0.001 25 g/L,微量元素溶液(FeCl2·4H2O 1.5 mg/L,ZnCl20.07 mg/L,MnCl2·4H2O 0.1 mg/L,CoCl2·6H2O 0.19 mg/L,CuCl2·2H2O 0.002 mg/L,NiCl2·6H2O 0.024 mg/L,H3BO30.006 mg/L,Na2MoO4·2H2O 0.036 mg/L,HCl(25%,7.7M)0.0.1 mg/L),刃天青染色剂0.001 g/L.将该溶液置于沸水煮30 min至粉色,加入0.5 g/L半胱氨酸,再煮15 min至溶液变为黄色.抽取50 mL至血清瓶,充入氮气15 min,用丁基橡胶塞和铝盖封口后121 ℃高压湿灭35 min.高压灭菌后加入Na2CO31.5 g/L(150 g/L预配原液)和甲砜霉素25 mg/L,使用HCl调节pH至6,约1.5 mL/L HCl.
在上述培养条件下,按照试验需求加入不同比例的五碳糖和六碳糖的代表作为碳源模拟利用粗底物,即葡萄糖/木糖溶液,或加入可生成还原反应的水溶性物质甲基紫精(Methyl Viologen,MV),考察其对嗜纤维杆菌产正丁醇的影响.
1.1.3 仪器
气相色谱(中国,Jie Dao GC1600),高效液相色谱(Agilent Technology,USA),HWS型恒温恒湿培养基箱(上海比朗仪器有限公司),TGL-16M型高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),TX B622L型电子天平(捷久计量衡器上海有限公司),PHS-25型pH计(上海科学精密仪器有限公司),YXQ-LS-50SⅡ型立式压力蒸汽灭菌锅(上海博迅实业有限公司),HY-5回旋多用振荡器(金坛市华峰仪器有限公司).
1.2 实验方法
1.2.1 菌种活化
将甘油保存菌种从-80℃低温冰箱取出后,室温缓慢融化,使用一次性无菌注射器将种子菌以5%(v/v)的接种量接入发酵培养液中,均匀混合后pH为6.04,OD值为2.06,活化条件根据前期实验选择37 ℃恒温下活化16.5小时.无特别说明时装液量均为100 mL厌氧瓶中装50 mL.
1.2.2 发酵过程及检测
厌氧瓶发酵:选用100 mL规格厌氧瓶,加入50 mL培养液培养活化好的菌株,接种量为2.5 mL,发酵10 d.使用0.5 mol/mL NaOH溶液调节pH值到6.5左右.在发酵过程中,每天同一时间取三组平行样测OD600值,并使用气相及液相对发酵液丁醇和乙酸等副产物的含量进行检测.
发酵罐发酵:选用1 000 mL小型发酵罐,发酵10 d,通过自动pH调节器加0.5 mol/mL NaOH溶液控制pH在6.5左右.每天取5 mL发酵液监测其pH和OD600值,并通过气相和液相对发酵产物成分进行检测.
光密度检测:紫外-可见分光光度计在波长600 nm处以蒸馏水为空白对照用分光光度法测定生物量.
气相检测:采用FID检测器,N2流速为50 mL/min,检测器温度为250 ℃,柱温为160 ℃.以实验室自配混合GC标准液(丙酮、乙醇、丁醇、乙酸和丁酸)作内标物进行定量检测.
液相检测:采用高效液相色谱-示差折光检测器法进行测定.色谱柱为Nucleosil-120 C18柱(250 nm×4 nm,5μm)或效能相当的色谱柱,以浓硫酸-双蒸水(0.026∶1,v/v)为流动相,流速0.6 mL·min-1,柱温和检测器温度均为65 ℃,进样量为10μL.采用不同浓度标准品进行标准曲线的制作以便定量检测.
所有检测均为一式三份,平行实验三次,重复试验两次.
1.2.3 配比优化
采用葡萄糖和木糖的混合糖作为碳源进行丁醇发酵试验,尝试以3∶1、2∶1、1∶1、1∶2和1:3五种配比进行发酵,寻找对葡萄糖和木糖利用率相对较高且丁醇产率最高的比例.
1.2.4 数据分析
葡萄糖及木糖转化率是指底物经酶水解后得到的葡萄糖(或木糖)的质量与原料葡萄糖(木糖)含量的百分比.菌体的比生长速率指单位时间内,单位菌体消耗基质或形成产物或形成菌体的量.丁醇产率即丁醇浓度与消耗的糖浓度之比.葡萄糖比生长速率可用公式(1)表示:
(1)
式(1)中:χ为菌体(g/L),t为时间(h).
本实验使用Microsoft Excel 2010进行作图和分析,主要通过SPSS(Statistical Product and Service Solutions)对数据分析.
2 结果与讨论
为了更好地研究六碳糖和五碳糖的比例调控丁醇的产量,从而对今后的分子实验提供依据和参考.本文尝试不同的底物配比进行发酵,寻找对葡萄糖和木糖利用率相对较高且丁醇产率最高的配比.
2.1 单一底物
首先利用气相色谱和高效液相色谱检测发酵产物,观察以不同配比的葡萄糖或木糖为底物时对嗜纤维杆菌adhE2发酵的影响,对该菌株进行初次发酵性能评价.结果发现,木糖消耗的速率缓慢降低,与葡萄糖发酵相比,木糖发酵显著提高了丁醇/乙醇的比例,如图2和表1所示.
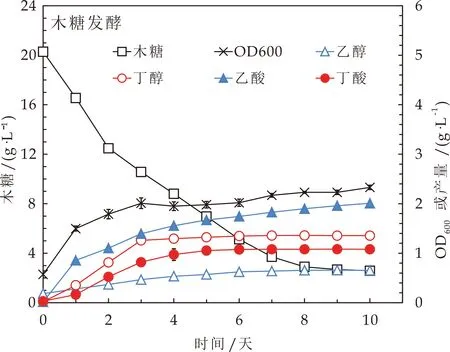
图2 以木糖为底物发酵
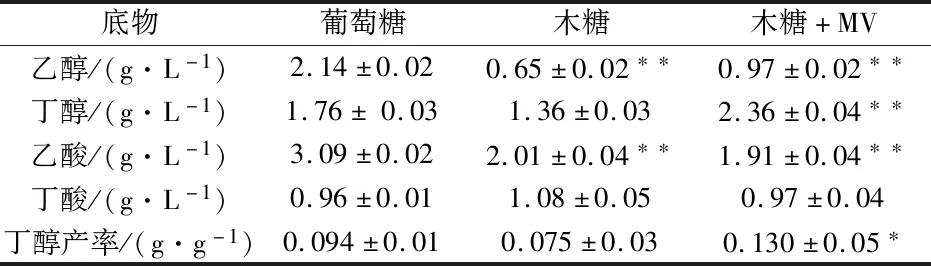
表1 以葡萄糖或木糖(+MV)为底物发酵
为了提高丁醇产量,本文在原有的木糖底物基础上添加MV进行试验.其中MV是细胞内产生氧化逆境的促进剂.据文献报道微量的MV可以提高丁醇的产率[18].结果显示,添加MV后(如图3所示),丁醇含量进一步增加到2.4 g/L,除乙醇产量略有增加,从0.65 g/L增加到0.97 g/L,其他副产物均没有增加趋势,如图3和表1所示.这可能是因为木糖降解途径不仅依赖于辅酶Ⅰ(NADH),还依赖于还原型辅酶Ⅱ(NADPH).因此,NADH的冗余促进了碳通量从乙酰辅酶a向丁基辅酶a的方向发展,导致丁醇的积累.

图3 以木糖(添加MV)为底物发酵
2.2 葡萄糖与木糖协同利用
为了寻找对葡萄糖和木糖利用率相对较高且丁醇产率最高的比例.本文采用葡萄糖/木糖配比为3∶1、2∶1、1∶1、1∶2和1∶3等不同配比底物在50 mL血清瓶发酵,并对其发酵产物进行分析.结果发现,当葡萄糖和木糖配比为3∶1和2∶1的时候,嗜纤维杆菌在发酵初期大量消耗葡萄糖,一段时间之后木糖和葡萄糖消耗的速率开始接近,如图4和图5所示.

图4 葡萄糖与木糖为3∶1作底物发酵
将葡萄糖和木糖比例为1∶1作为界限,如图6所示,随后增加木糖在发酵底物中的占比,可以明显观察到该菌株消耗木糖的时间开始提前,如图7和8所示.当葡糖糖和木糖比例为1∶3时,细菌仅代谢葡萄糖24小时后即会开始主要消耗木糖,如图8所示.当葡萄糖和木糖比例为3:1时,细菌代谢葡萄糖96小时后才会主要消耗木糖,如图4所示.另外葡萄糖浓度在碳源中占比高时,可能会产生较多的乙酸和丁酸等,如图4~8所示.相比于其他菌株,本次实验所用的嗜纤维杆菌同时使用葡萄糖和木糖,可以提高对水解酶抑制剂的耐受性,有利于从木质纤维素生物质中生产正丁醇.

图6 葡萄糖与木糖为1∶1作底物发酵

图7 葡萄糖与木糖为1∶2作底物发酵

图8 葡萄糖与木糖为1∶3作底物发酵
有研究表明,纤维素在葡萄糖存在下消耗的木糖量可以忽略不计或有限,因为碳代谢物阻遏效应(CCR)常发生在大多数菌株中.从表2中可以看出,葡萄糖和木糖同时被嗜纤维杆菌消耗.在不同的葡萄糖和木糖比下,菌株表现出不同的比生长率、葡萄糖和木糖摄取率.当葡萄糖和木糖比例为3∶1时,即使葡萄糖消耗殆尽,细菌也能以较高的速率摄取葡萄糖,但木糖消耗可忽略不计.可见,在高糖浓度下,CC在木糖代谢中仍受CCR的影响.随着木糖浓度的增加,CCR瓶颈得到缓解,木糖吸收速率由0.007提高到0.046.当葡萄糖与木糖比达到1∶1时,丁醇的效价最高.

表2 不同比例葡萄糖与木糖为底物发酵
2.3 发酵罐发酵
在之前的实验中,本课题组发现在葡萄糖和木糖比例为1∶1时,丁醇产率最高,所以本文优化了葡萄糖与木糖的比例,将发酵规模由50 mL血清瓶扩大到250 mL生物反应器.与血清瓶厌氧发酵相比,生物反应器发酵产生大量乙醇.使用1 mL MV作为诱导剂处理后,发现MV对丁醇发酵产生了较强的促进作用,乙醇和丁醇的产量均提高到了3.5 g/L左右,且副产物乙酸明显下降,如表3、图9和图10所示.推测是该菌受到MV诱导,抗氧化酶系统被激活,反应生成了一些抗氧化分子,即MV激活了该菌的抗氧化防护系统[19,20].

表3 扩大规模后木糖与葡萄糖(+MV)为底物发酵

图9 葡萄糖与木糖为1∶1作底物发酵罐中发酵

图10 葡萄糖与木糖为1∶1(添加MV)作底物发酵罐中发酵
3 结论
本文使用前期实验室通过基因工程手段改造的嗜纤维杆菌adhE2菌株,以葡萄糖和木糖作为碳源进行丁醇发酵研究.通过探索不同比例的葡萄糖与木糖,发现当葡萄糖和木糖比例为1∶1时,该菌株对葡萄糖和木糖的利用率相对较高且丁醇产率(0.097 g/g)最高.同时,利用发酵罐扩大规模或是加入MV,丁醇产率均会增加,最高达到3.6 g/L左右,几乎实现了以葡萄糖和木糖为原料的正丁醇稳定生产.表明了葡萄糖和木糖比例为1∶1可以作为一种丁醇的生产工艺,提高了该菌株对底物的利用效率,探究了葡萄糖和木糖同时使用的抑制情况,实验结果显示CCR反应不是很大,进一步证明嗜纤维杆菌可以很好地利用粗底物,后续希望利用不同的粗底物进行发酵,对实现重复分批发酵的长期稳定运行有一定及将来对菌株的进一步代谢改造有一定意义.

