糖尿病大鼠模型视网膜VEGF 的变化研究
李 娜 孙先勇 高荣玉 徐鑫彦 娄华东(通讯作者) 山东省潍坊眼科医院(山东,潍坊,261041)
糖尿病视网膜病变(DR)已经成为国内外糖尿病患者致盲的主要原因之一。 在临床工作中,医生重点关注增生期糖尿病视网膜病变的治疗,对于背景期糖尿病视网膜病变的关注较少; 而一部分患者,在糖尿病视网膜病变的早期即开始出现视力下降、黄斑水肿。VEGF 因子是目前重点治疗的生物因子和药物靶点, 该因子在DR 早期即已经产生。 但是,VEGF 因子随病程的变化以及对视网膜的影响如何研究较少。 本实验拟通过大鼠糖尿病视网膜病变动物模型,研究VEGF 的变化情况。
1 材料与方法
1.1 实验动物与分组
采用健康6 周龄雄性SD 大鼠32 只, 体重为300-350g,由潍坊医学院实验动物中心提供。 本实验所有操作及实验动物的使用和饲养遵循NIH 颁布的实验动物使用规范。 将入选实验大鼠分为4组,分别为:空白对照组、糖尿病4 周组、糖尿病8周组、糖尿病12 周组。
1.2 实验方法
1.2.1 糖尿病动物模型制作
以0.1mmol/L、pH4.4 的枸橼酸缓冲液配制成质量分数为2%的链脲佐菌素(STZ)溶液,按照65mg/kg剂量进行大鼠腹腔注射。 注射后4 天,自大鼠尾部采血,做血糖检测,以高于16.67mmol/L 为造模成功标准。 并观察注射前后大鼠体重及饮食、饮水表现。
1.2.2 检测方法
分别检测空白对照组、4 周组、8 周组、12 周组的视网膜厚度、免疫荧光、免疫荧光双重染色等的情况。
(1)视网膜厚度:用FFA 和OCT 一体机(Heidelberg Engineering Spectralis HRA+OCT;德国Heidelberg 公司)对实验鼠左眼进行检查。 大鼠称体质量后给予小剂量质量分数10%水合氯醛腹腔内注射(约50 mg/kg),双眼用托吡卡胺滴眼液点眼扩瞳,然后以甲基纤维素涂在角膜表面,保持角膜湿润状态。待大鼠反应迟钝后,包裹全身,置于OCT 检查台上,暴露待检眼,使眼球前后径线与扫描指示光源一致。 所有大鼠均使用Spectralis HRA+OCT 进行FFA 和OCT 检查。FFA 检查时大鼠腹腔注射质量分数20%荧光素钠 (0.012ml/g), 快速进行视盘及上方、下方、鼻侧、颞侧、鼻上、鼻下、颞上、颞下视网膜9 个方位检查;OCT 检查时测量距离视盘上方、下方、鼻侧、颞侧2 个视盘直径(disc diameter,DD)处的视网膜厚度。 使用检测系统的自带软件手动测量视网膜内界膜至视网膜色素上皮 (retinal pigment epithelium,RPE)高反射层定义为总视网膜厚度,然后测量内界膜至外界膜之间的厚度,定义为内外界膜间厚度。
免疫荧光染色:10%水合氯醛麻醉后, 摘除眼球。 将鼠眼固定于中性福尔马林中48 小时,去除眼球前部及玻璃体,经乙醇脱水,二甲苯透明后常规浸蜡包埋处理,连续4um 切片。 切片脱蜡至水,3%H2O2-甲醇阻断液阻断10min,非免疫动物血清室温孵育10min, 一抗分别以神经胶质纤维酸性蛋白(glial fibriliary acid protein,GFAP)多克隆抗体(稀释度1∶40,福州迈新公司)及VEGF 多克隆抗体(稀释度1∶40,福州迈新公司)室温孵育1 h,二抗以羊抗兔IgG-Cy3(稀释度1∶80,武汉博士德公司)避光孵育40min。 磷酸盐缓冲盐水PBS 振荡冲洗10min,激光共聚焦显微镜 (LSM880,ZEISS)536 nm 激发观察、采集图象。
免疫荧光双重染色:滴加一抗分别为VEGF 鼠抗人单克隆抗体 (稀释度1∶20, 福州迈新公司);GFAP 兔多克隆抗体(稀释度1∶40)37℃共孵育1h。二抗分别为:羊抗免IgG-Cy-3(稀释度1∶50);马抗鼠IgG-FITC(稀释度1∶20,武汉博士德公司)共孵育40min,其余步骤与免疫荧光染色相同。
1.2.3 结果判定免疫荧光染色:胞浆内出现红色荧光为阳性。 免疫荧光双重染色;GFAP 阳性细胞呈红色荧光,VEGF 阳性细胞呈绿色荧光。
1.2.4 统计学方法确定各个时间点的数据与空白对照,比较其差别,分析其可能的影响因素。 不同组之间采用t 检验,以P<0.05 为有统计学意义,采用统计学软件SPSS16.0 进行统计学分析。
2 结果
2.1 制造模型成功后,测量大鼠的体重,在4 周时体重明显下降,较对照组有明显差异,P<0.05。
2.2 经过HE 染色后,发现正常大鼠视网膜各层组织紧密,细胞排列整齐,形态正常;糖尿病大鼠各层组织排列疏松,细胞间隙增大(见图1)。测量厚度后发现,糖尿病大鼠4 周时视网膜厚度无明显变化,8周、12 周时厚度逐渐增大。 (见表1、图2)。
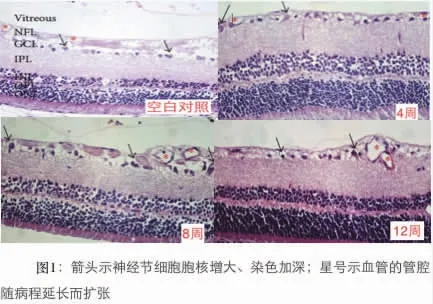
图1 箭头示神经节细胞胞核增大、染色加深;星号示血管的管腔随病程延长而扩张。
表1 不同组大鼠视网膜厚度变化比较(±s)(μm)
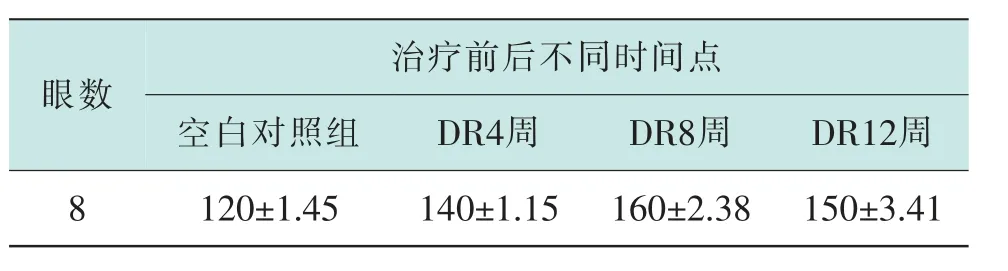
表1 不同组大鼠视网膜厚度变化比较(±s)(μm)
眼数治疗前后不同时间点空白对照组 DR4周 DR8周 DR12周8 120±1.45 140±1.15 160±2.38 150±3.41
2.3 免疫荧光染色: 在激光共聚焦显微镜下观察,对照组的VEGF 主要出现在神经纤维层、神经节细胞层、内网状层;而在糖尿病大鼠中,VEGF 的标记在视网膜各层细胞均有出现,主要出现在神经节细胞层。 (见图3)。

图2 随时间延长,各试验组视网膜厚度增加。
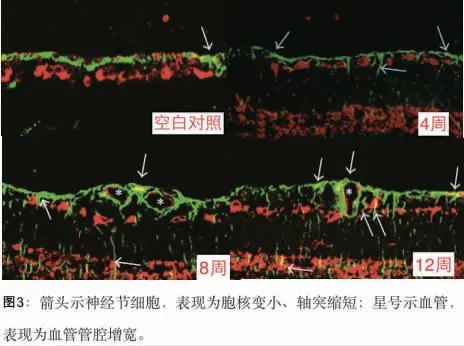
图3 箭头示神经节细胞,表现为胞核变小、轴突缩短;星号示血管,表现为血管管腔增宽。
2.4 GFAP 及VEGF 免疫荧光双重标记:对照组中,可被识别的细胞为Müller 细胞,主要局限在神经纤维、神经节细胞中;在4 周、8 周、12 周糖尿病大鼠中,Müller 细胞表达VEGF 明显增加。 (见图4)。
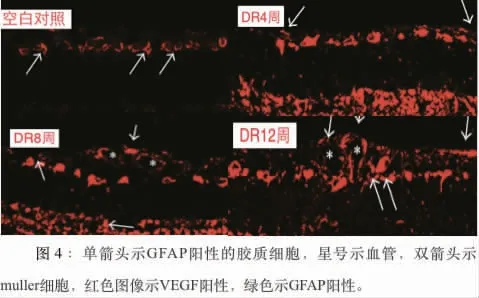
图4 单箭头示GFAP阳性的胶质细胞,星号示血管,双箭头示muller细胞,红色图像示VEGF阳性,绿色示GFAP阳性。
3 讨论
目前糖尿病患病率呈上升趋势,2010 年患病率约为2.85 亿,预计到2030 年将增至4.39 亿。 糖尿病性视网膜病变(DR)是糖尿病最常见的并发症之一,全世界约有9 300 万人患有DR[1]。 临床上,DR分为两种形式:非增殖型DR (NPDR)和增殖型DR(PDR)[2]。 糖尿病性黄斑水肿(DME)和视网膜新生血管是糖尿病性黄斑水肿患者视力障碍和失明的主要原因。 其病理特征包括血管通透性增加、Bruch膜破裂、新生血管形成(NV)、毛细血管无灌注区、内皮细胞损伤和死亡[3]。
本实验中发现,随着糖尿病病程的延长,大鼠视网膜的厚度是逐步增加的,并且与糖尿病病程呈正相关性。这表明在早期DR 中,视网膜相关病理损害已开始出现,这也在后续的免疫实验中得到证实。
据报道,VEGF 在血管发育、血管生成、细胞存活和炎症中发挥着不同的作用。首先,VEGF 表达下调,在胚胎期和出生后血管发育过程中都被认为是负调控因子[4,5]。 其次,VEGF 在一些原发性肿瘤和湿性年龄相关性黄斑变性(wet age-related macular,AMD)的实验模型中被证明是病理血管生成的积极调节因子[6]。 此外,VEGF 信号通路在调节炎性细胞的趋化过程中发挥作用[7-9]。 本实验中,糖尿病大鼠VEGF 的标记在视网膜各层细胞均有出现,并随着时间的增加,表达增加,这与相关报道是一致的[10-12];同样也证明了VEGF 在早期视网膜中即开始起到病理作用,是否在早期糖尿病视网膜病变中引起黄斑水肿还需要进一步研究。
VEGF 表达上调后,主要引起视网膜血管损伤,通透性增加,炎症物质积聚[13]。 本实验中,随着糖尿病视网膜病变病程的增加, 糖尿病8 周、12 周大鼠视网膜厚度增加,证明随着病程延长,视网膜病变在加重,可能与VEGF 持续高表达有关;免疫荧光实验同样发现,VEGF 主要在视网膜神经上皮层面表达,在此层面主要是视网膜血管层,而VEGF 的持续高表达,侧面证实视网膜血管、结构损伤,以及视网膜内炎症物质的堆积。 糖尿病引起的生理生化的改变,是引起VEGF 高表达的因素[14-15]。
Müller 细胞贯穿于视网膜全层, 是主要的神经胶质细胞。本实验中,采用GFAP 及VEGF 免疫荧光双重标记, 发现VEGF 主要表达在Müller 细胞,从而引起视网膜内免疫环境的破坏,也进一步表明视网膜功能破坏的开始。 Müller 细胞主要是通过旁分泌的形式引起视网膜内免疫环境的变化,从而影响其他细胞的作用和功能,为进一步引起形态的破坏创造了条件[16]。
通过实验发现,随着病程的增加,糖尿病大鼠视网膜厚度开始出现显著变化,同时视网膜各层结构出现改变,主要表现在视网膜神经节细胞和视网膜血管的变化上。 免疫荧光及免疫荧光双重标记技术可以发现VEGF 主要体现在神经纤维层,同时在Müller 细胞中集中表达。 本实验的缺点是仅从免疫方面证实了VEGF 随病程发展可持续引起视网膜结构的改变,缺乏实际眼内测量数据的支持,在后续实验中继续补充改进。

