WNK1基因rs11611246位点多态性与云南汉族儿童急性淋巴细胞白血病关联性研究①
武 坤 苏艳丹 杨金荣 王雪娇 曾 云⑥
(昆明医科大学第一附属医院医学检验科,昆明 650032)
急性淋巴细胞白血病(acute lymphocytic leukemia,ALL)是1~14岁儿童最多发恶性肿瘤,其发病机制复杂、恶性程度高,传统“形态学-免疫学-病理学”观点认为ALL发病涉及众多信号传递通路改变[1]。随着分子生物学理论、技术的发展,加之流行病学调查佐证,发现ALL可能与特殊环境暴露及多种遗传因子变化有密切关系,部分基因多态性可能在ALL发病过程中发挥重要作用[2-4]。赖氨酸缺乏激酶1(WNK1)主要存在于高等哺乳动物体内,是WNK家族主要成员,由位于12号染色体上一段150 kb的基因组序列指导合成,含有28个外显子及多个转录起始位点。WNK1在细胞内外信号转导,细胞增殖、活化、迁移等方面具有重要作用,通过磷酸化有丝分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)调控MAPK级联反应可能参与肿瘤发病[5]。WNK1存在多个基因多态性位点,其不同变异也与多种疾病相关,但WNK1基因多态性与ALL有无相关性目前尚未见报道,本研究选择WNK1基因rs11611246位点进行多态性分析,探讨其与ALL易感性、环境交互作用及预后关联性,以期为ALL发病机制研究、治疗提供新的理论依据。
1 资料与方法
1.1资料
1.1.1一般资料 选择2012年1月~2014年1月昆明医科大学第一附属医院血液科收治的初诊汉族ALL患儿86例为研究对象,均常住于云南,其中男49例,女37例,年龄1~14岁,中位年龄4岁。诊断标准:所有患儿临床表现、外周血常规及骨髓指标等相关检查均符合中华医学会儿科学会血液学组关于ALL制订的诊断标准[6]。排除标准:①骨髓增生异常综合征、再生性障碍性贫血等其他血液系统疾病;②合并唐氏综合征等遗传疾病患儿。随访时间22~72个月。选择同期健康汉族儿童95例为对照组,均常住云南,其中男55例,女40例,年龄1~14岁,中位年龄4岁。本研究得到医院伦理委员会支持,所有患儿及对照组家属均知情同意。
1.1.2仪器与试剂 DNA抽提试剂盒,北京艾德莱生物公司(中国);PCR扩增仪、TaqMan-MGB Universal PCR试剂盒(批号:A15299)、TaqMan-MGB等位基因分型试剂盒(批号:A12303),Applied Biosystems公司(美国);引物合成:上海生物工程有限公司(中国);兔抗人WNK1单克隆抗体(批号:ab137687),Abcam公司(美国);兔抗人β-actin抗体(批号:AF0003)、辣根过氧化物酶偶联二抗(批号:A0208),碧云天生物公司(中国)。
1.1.3环境暴露资料 环境暴露主要包括:出生后居室装修、放射性物质接触史(放疗、核素治疗,或X光照射、CT等影像学检查,其中发病前1年内影像学检查为有效放射性物质接触)、化学性物质接触史(化肥、汽油、杀虫剂、农药等)、住房500 m内有工厂,这些资料被认为是白血病最主要的室内、室外致病环境因素[2]。
1.2方法
1.2.1基因组DNA提取 ALL患儿与健康儿童均取空腹静脉血标本2 ml(EDTA抗凝),保存于-20℃冰箱待测。采用外周血全基因组DNA抽提试剂盒(北京艾德莱生物公司)提取标本总DNA,严格按照试剂盒操作说明书设定的反应条件及操作步骤进行,分光光度仪测定总DNA在260/280吸光度值,1.6~2.0为合格DNA待测样本,保存于-80℃冰箱待测。
1.2.2基因分型 PCR扩增引物:上游:5′-CTAACTGATTGTTGAACTTGGGC-3′,下游:5′-TGCAAGGTGGGTACAGGATAAACT-3′,PCR反应体系:1.5 μl 基因组DNA、5 μl PCR Master Mix、1.5 μl的40×TaqMan SNPs Genotyping Assay Mix、2 μl的ddH2O。PCR扩增条件:95℃激活Ampli Taq酶10 min,95℃变性15 s,60℃延伸1 min,共 40个循环。扩增后采用TaqMan-MGB等位基因分型试剂盒对DNA样本进行分型,根据各自VIC、FAM荧光强度对不同等位基因进行区分。
1.2.3WNK1检测 免疫印迹法测定骨髓组织WNK1。取ALL患儿骨髓组织并用磷酸盐缓冲溶液冲洗细胞,以RIPA裂解液(含蛋白酶抑制剂)裂解、150 000 g离心10 min后收集上清液,保存于-20℃冰箱待测。在聚丙烯酰胺凝胶电泳,转膜至PVDF膜,50 g/L脱脂奶粉脱脂后,以兔抗人WNK1单克隆抗体1∶1 000于4℃孵育24 h,然后以辣根过氧化物酶偶联的二抗1∶5 000室温孵育2 h,以β-action为对照。
1.3统计学分析 采用SPSS13.0软件进行统计学分析。采用拟合优度皮尔森卡方检验对ALL组、对照组基因型分布是否符合Hardy-Weinberg遗传平衡进行检测;计数资料采用χ2检验;非条件Logistic回归模型分析基因多态性与ALL易感性、基因多态性与环境因素交互作用,以比值比(odds ratios,OR)及95%可信区间(confidence intervals,CI)进行描述;采用Kaplan-Meier法分析患儿5年无复发生存(relapse free survival,RFS)、5年无事件生存(event free survival,EFS)及5年总生存(overall survival,OS)情况。以P<0.05为差异有统计学意义。
2 结果
2.1Hardy-Weinberg遗传平衡分析 纳入研究的86例ALL患儿中,GG型45例(52.3%),GT型32例(37.2%),TT型9例(10.5%),纳入研究的95例对照儿童中,GG型31例(32.6%),GT型47例(49.5%), TT型17例(17.9%), 两组儿童基因分布均符合Hardy-Weinberg遗传平衡规律(P>0.05),表明数据来自同一蒙德尔群体。
2.2ALL易感性分析 GG型、GT型、TT型在ALL组与对照组儿童中存在显著差异(P=0.024),较之于对照组,等位基因相对风险分析显示,GG型基因会增加ALL患病风险。合并分析显示,ALL患儿G等位基因占比显著高于对照组(P=0.007),合并后分析显示G等位基因较之T等位基因会显著增加ALL患病。见表1。

表1 基因分布及ALL易感性分析
2.3ALL患儿化疗缓解及生存分析 GG型患儿第1疗程诱导治疗完全缓解率为91.1%(41/45),GT/TT型患儿为90.2%(37/41),二者无显著差异(χ2=0.019,P=0.890)。Kaplan-Meier生存分析显示,GG型患儿5年RFS为71.5%,显著低于GT/TT型患儿的86.1%(P=0.031);GG型患儿5年EFS为67.3%,显著低于GT/TT型患儿的81.8%(P=0.027);在5年OS比较中,GG型患儿为78.6%,显著低于GT/TT型患儿的92.5%(P=0.012)。见图1。

图1 ALL患儿5年生存情况分析Fig.1 Analysis of five-year survival for children with ALLNote:A.Comparison of relapse-free survival rates of children with different genotypes; B.Comparison of event-free survival rates of children with different genotypes; C.Comparison of total survival rates of children with different genotypes.
2.4基因多态性与环境因素交互作用 非条件Logistic多元回归模型分析WNK1基因rs11611246位点基因多态性与环境因素有无交互作用,结果显示GG基因型与“出生后居室装修”、“放射性物质接触”具有协同交互作用,携带GG基因型儿童在出生后居室装修(OR:3.085,95%CI:1.963~3.597,P=0.016)、放射性物质接触(OR:3.571,95%CI:2.628~4.277,P=0.008)会显著增加ALL发病风险,与“化学性物质接触”、“住房500 m内工厂”无显著交互作用(P>0.05)。见表2。
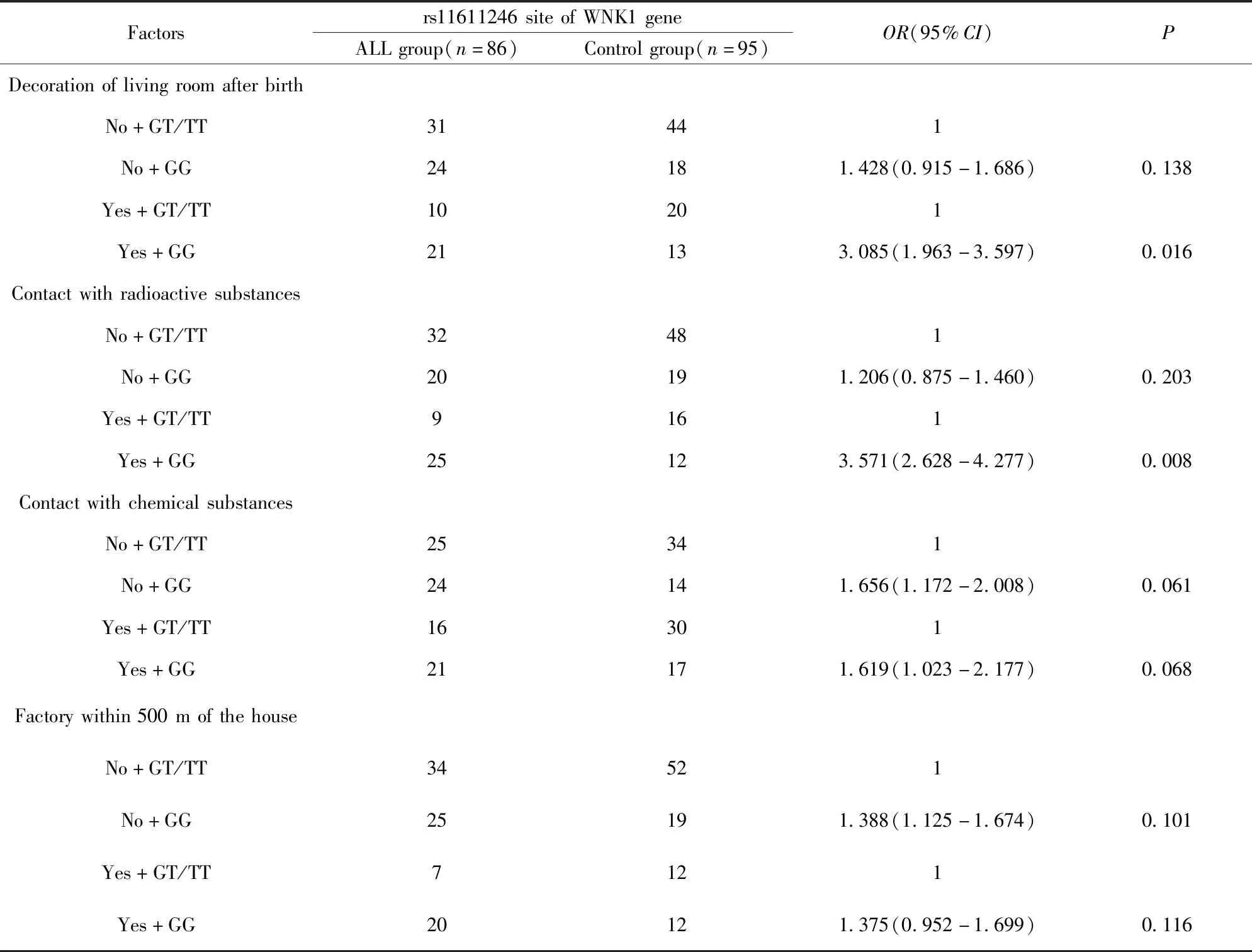
表2 基因多态性与环境因素交互作用
2.5ALL患儿WNK1表达 对不同基因型ALL患儿WNK1蛋白表达检测,以相对于β-action灰度值表达WNK1表达量,结果显示GG型ALL患儿WNK1在骨髓表达显著低于GT型、TT型患儿(P<0.05),而GT型、TT型患儿间表达差异无统计学意义(P>0.05)。见图2。

图2 ALL患儿WNK1蛋白表达图(免疫印迹)及相对灰度值Fig.2 WNK1 protein expression map (immunoblot) and relative gray value in ALL children
3 讨论
WNK1基因位于12号染色体12p13.3位置,由28个外显子及多个转录起始位点构成,其指导合成的WNK1包含2 382个氨基酸,是病理生理应答过程中重要因子。WNK1可以上调或下调钾耦合氯转运蛋白参与钾、钠离子在细胞内外转移,同时还可激活上皮细胞钠通道蛋白调控内环境电解质平衡[7]。WNK1内含子突变后的过表达可抑制WNK家族另一成员WNK4,继而影响Na-Cl协同转运蛋白SLC12A3调节功能,这是发生假性2C型高血压(PHA2C)的主要原因之一[8]。此外,WNK1还可能参与卵巢癌、乳腺癌、肺癌等恶性肿瘤发病[9]。WNK1基因部分片段与剪接的RAD52基因反义,这使得RAD52转录能力会受到WNK1基因影响,导致染色体乳腺癌和卵巢癌等位基因危险突变位点12p12.2-p13位点DNA双链断裂修复能力下降引起相关肿瘤发生与进展[10]。ALL发病机制复杂,遗传因子的改变成为该病不可忽略的诊断、治疗因素,Hui等[11]研究认为基因突变后干扰下游信号传递是ALL发病主要路径之一。PI3K/AKT/mTOR信号通路异常活化在ALL及部分急性髓性白血病中常见,WNK1作为丝氨酸/苏氨酸激酶可以使MAPK磷酸化,磷酸化的MAPK能够激活PI3K/AKT/mTOR信号通路[12,13]。故本研究选择WNK1基因rs11611246为研究对象,分析其基因位点多态性与ALL关联性,目前尚未见相关报道。
研究结果显示,rs11611246位点GG型、GT型、TT型在ALL患儿、健康儿童中呈显著差异表达,GG型比例在ALL患儿中显著升高,其OR达到2.002,进一步合并分析显示G等位基因OR为2.189,提示G等位基因可能是ALL易感基因。除了表观遗传学因素外,环境因素可能是ALL发病另一重要原因,这得到众多流行病学研究证实[14,15]。但越来越多的学者认为在环境、遗传因素同时存在的情况下,二者之间是否存在交互作用可能是ALL发病与否的关键调节机制[16]。本研究分析了rs11611246位点多态性与环境因素交互作用,结果显示GG基因型与出生后居室装修、放射性物质接触存在协同交互作用。居室装修材料可能会含有甲醛、苯及易挥发有机物,而这些有害物质具有强致病性,部分物质还具有致癌性,其中油漆含有的甲苯是已知基因毒物质,这可能是“居室装修”与基因多态性存在协同交互作用的主要原因。“放射性”物质可致DNA碱基排列改变、碱基缺失及异常修复能力减弱,是导致恶性肿瘤发生的主要环境因素之一。本研究提示这两种环境均可与rs11611246位点GG基因发生协同交互作用,在日常生活中应尽量避免。
基因多态性分析在恶性肿瘤诊治中的重要作用之一即判断预后。白血病复发是总体环境下多重因素作用的结果,包括白血病宿主免疫能力、化疗药物敏感性及反应性、骨髓微环境对白血病细胞抑制或支持作用等,基因突变可能通过复杂通路下调肿瘤抑制因子、凋亡调节因子等参与白血病复发而受到众多学者关注[17]。本研究结果显示rs11611246位点不同基因型ALL患儿第1疗程诱导治疗完全缓解率无明显差异,表明该位点基因型可能对ALL早期治疗并无明显影响。进一步Kaplan-Meier生存分析发现,GG型患儿5年RFS、EFS及OS等预后指标均显著低于GT/TT型患儿。WNK1具有抑制细胞增殖的能力,Ding等[18]通过转染不同基因型WNK1发现,突变型较之于野生型WNK1基因指导合成WNK1蛋白能力下降,导致突变型WNK1宿主细胞增殖能力显著增强,这可能是WNKI影响恶性肿瘤预后机制之一。本研究结果显示,GG型患儿WNK1蛋白在骨髓表达显著下降,与GG型患儿生存预后情况相符,提示rs11611246位点多态性可能通过干扰WNKI表达来影响ALL预后。
综上所述,本研究发现WNK1基因rs11611246位点多态性与ALL患病风险存在一定相关性,并且与“出生后居室装修”、“放射性物质接触”有协同交互作用,虽然对患儿短期治疗效果无明显影响,但是GG型患儿5年生存指标更差。由于基因内部单核苷酸多态性可以影响基因转录、转录后修饰、翻译及蛋白修饰等蛋白表达流程,本课题组后续还需从基础研究进一步阐释WNK1基因对ALL的影响机制。

