通过矿化提高蛋白疫苗稳定性的研究①
闵娅君 肖云菊 肖江明 胥文春 尹一兵 张雪梅
(重庆医科大学检验医学院临床检验诊断学教育部重点实验室,重庆 400016)
肺炎链球菌 (streptococcus pneumoniae,S.pn) 作为社区获得性肺炎的主要致病菌,还可引起肺炎、脑膜炎、败血症等严重的侵袭性疾病,而疫苗是预防传染性疾病最经济、有效的手段[1]。蛋白疫苗因其保守性高、抗原性强、易于制备且能有效激活B、T细胞免疫等优点,已成为下一代肺炎链球菌疫苗的研究重点[2,3]。但蛋白疫苗对温度极其敏感,从生产到运输全过程都需要严格低温保存,极大地增加了疫苗的使用成本,限制了疫苗的广泛应用[4]。因此,提高蛋白质的稳定性对蛋白质疫苗的应用具有重要意义。
肺炎链球菌溶血素(pneumolysin,PLY)是肺炎链球菌的一种重要毒力因子,作为胆固醇依赖性细胞溶血素(CDCs)的家族成员,可广泛作用于宿主组织细胞,发挥细胞毒性作用。ΔA146PLY 作为PLY的无溶血活性突变体,被证明是一种安全高效的肺炎链球菌候选疫苗[5]。本研究拟以肺炎链球菌ΔA146PLY为研究对象,利用原位仿生矿化技术为其包裹上一层磷酸钙外壳,通过酶解反应和热处理观察其稳定性,并通过细胞实验及动物实验评估矿化疫苗ΔA146PLY@CaP的免疫保护效果,以进一步确定其稳定性。
1 材料与方法
1.1材料
1.1.1菌株与动物 WT-PLYE.coliBL21和ΔA146PLYE.coliBL21菌株由重庆医科大学临床检验诊断学教育部重点实验室制备与保存;大肠杆菌感受态细胞BL21(DE3)购自擎科生物科技有限公司;肺炎链球菌临床菌株CMCC31693(血清型19F型)购自中国医学微生物菌种保藏管理中心;野生昆明鼠购自重庆医科大学实验动物中心;6~8周龄C57BL/6雌性小鼠购自北京华阜康生物科技股份有限公司,饲养于SPF级清洁动物房。
1.1.2试剂 Ni-NTA 树脂购自GE healthcare中国公司;去内毒素试剂盒购自南京金瑞斯生物科技;氯化钙、氯化镁购自生工生物工程(上海)股份有限公司;磷酸氢二钠、磷酸二氢钠购自重庆川东化工(集团)有限公司;考马斯亮蓝(G-250,R-250)购自生工生物工程(上海)股份有限公司;Protein Molecular Weight Marker购自宝生物工程(大连)有限公司(TaKaRa)公司;预染marker购自Thermo Fisher SCIENTIFIC公司;SDS-PAGE试剂盒,青链霉素、卡那霉素购自碧云天生物公司;RMPI1640培养基购自Hyclone 公司;胎牛血清购自ScienCell;红细胞裂解液购自天根生化科技有限公司;ELISA MAXTMDeluxe SET mouse IL-6、TNF-α试剂盒购自Biolegend公司;辣根过氧化物酶(HRP)标记山羊抗小鼠IgG购自北京中杉金桥公司。
1.1.3仪器 扫描电镜(FESEM,Hitachi SU8010)、透射电镜(TEM,Hitachi H-7500),能量色散X射线光谱仪(EDS,Oxford Instruments);紫外分光光度计(Thermo Scientific,Nanodrop 1000);冷冻干燥机(CHRIST,RVC2-18); 酶标仪(Gene Company Limited,EON)。
1.2方法
1.2.1蛋白WT-PLY和ΔA146PLY的表达纯化与内毒素去除 将E.coliBL21-WT-PLY和E.coliBL21-ΔA146PLY 菌株活化于5 ml含50 ng/ml卡那霉素的LB液体培养基,置于摇床,37℃,180 r/min。A600≈0.5(约7 h)时将5 ml活化菌液加入到含卡那霉素终浓度为50 ng/ml的500 ml LB培养基中,置于摇床,37℃,180 r/min。摇床培养约4 h后加入1 mol/L IPTG至终浓度0.5 mmol/L,25℃,120 r/min诱导蛋白表达8 h。5 000 r/min,4℃离心收集细菌,超声破菌后以4℃ 12 000 r/min离心30 min并收集上清,0.22 μm滤器过滤;Ni-NTA亲和层析法进行蛋白纯化,超滤后用试剂盒去内毒素并用10%SDS-PAGE进行纯度鉴定。使用紫外分光光度计检测所得蛋白浓度,分装后于-80℃保存备用。
1.2.2蛋白WT-PLY和ΔA146PLY的生物矿化 将 360 μg蛋白WT-PLY和ΔA146PLY分别与8.8 μmol CaCl2、8.8 μmol MgCl2以及5.28 μmol Na2HPO4/NaH2PO4(pH=7.5)缓冲液混合,其余体积用ddH2O(pH=7.5)补足至1 ml。用DEPC处理过的磁珠与矿化体系盛放于烧杯,4℃搅拌4 h后备用。分别取矿化悬浊液40 μl,4℃ 3 000 r/min 离心5 min,分离上清和沉淀,40 μl上清中加入10 μl 5×loading buffer,沉淀中加入50 μl 1×loading buffer,沸水煮10 min,分别取20 μl样本进行SDS-PAGE分析。另外取部分矿化液,分离上清,用BCA蛋白测定试剂盒检测上清中残余的蛋白含量。
1.2.3矿化纳米颗粒WT-PLY@CaP和ΔA146PLY@CaP的表征
1.2.3.1TEM 将WT-PLY@CaP和ΔA146PLY@CaP矿化悬浊液分别用PBS稀释50倍后,滴于200目铜网上,自然晾干,随后在透射电镜中检测矿化蛋白的大小。
1.2.3.2FESEM 将WT-PLY@CaP和ΔA146PLY@CaP矿化悬浊液分别用无水乙醇稀释10倍后,滴于二氧化硅玻片上,自然晾干后喷金,随后扫描电镜检测矿化蛋白的表面形貌。
1.2.3.3EDS 将WT-PLY@CaP和ΔA146PLY@CaP矿化悬浊液3 000 r/min离心后,弃上清,沉淀用无水乙醇清洗2遍后,置于冷冻干燥机冻干后将粉末送去检测:将其铺于碳胶带上,采用EDS检测矿化颗粒表面的元素组成。
1.2.4蛋白与纳米颗粒的稳定性检测
1.2.4.1蛋白酶K降解实验 将WT-PLY蛋白和矿化后的WT-PLY@CaP悬浊液用40 μg/ml的蛋白酶K分别处理0、1、5、10、15 min,ΔA146PLY蛋白和ΔA146PLY@CaP用15 μg/ml的蛋白酶K分别处理0、1、5、10、15 min。加入1 μl FMSF终止酶解反应,之后加入loading buffer,煮沸10 min后取20 μl上样于SDS-PAGE的上样孔中,80 V×40 min后120 V×80 min 跑胶。用考马斯亮蓝染色后再用洗脱液洗脱。
1.2.4.2溶血实验 取野生昆明鼠心脏血制备2%红细胞悬液备用。将WT-PLY和WT-PLY@CaP分别放置在45℃、55℃处理不同时间后取20 μl蛋白及处理后的悬浊液到300 μl 2%红细胞悬液中,反应10 min,800 g离心5 min,取上清150 μl加入至96孔板,在545 nm处比色。
1.2.5小鼠巨噬细胞的提取与体外培养 吸取无菌石蜡1 ml,注入小鼠腹腔以刺激腹腔巨噬细胞产生;5 d后断颈处死小鼠于75%乙醇浸泡5 min;从下腹部侧缘破开腹腔,分别用7 ml+8 ml预冷的PBS冲击腹腔,回收的PBS 1 000 r/min离心5 min,弃去上层石蜡,PBS洗1次之后,加入红细胞裂解液5 ml,作用2 min,PBS洗3次,加入新鲜含双抗(青霉素和链霉素)培养基(DMEM)5 ml,计数并稀释后铺板于24孔板(5×105个/孔,500 μl/孔);置于37℃、5%CO2培养箱,培养过夜后每孔加入15 μl分别用45℃和55℃处理的ΔA146PLY和ΔA146PLY@CaP,以等量LPS作为阳性对照,无菌PBS作为阴性对照。
1.2.6动物实验
1.2.6.1皮下免疫小鼠 将C57BL/6小鼠随机分为8组,1.5%戊巴比妥钠麻醉,共免疫 3次,每次免疫间隔14 d。
1.2.6.2鼻腔定植 末次免疫7 d后取20 μl含有1×108CFU的19F以滴鼻的方式攻毒,每组6只,72 h后在小鼠被麻醉的状态下收集鼻腔灌洗液(100 μl/只)及肺匀浆(每组>4只),分别铺板计算细菌载量;肺匀浆12 000 r/min离心10 min后收集上清以检测细胞因子含量。
1.2.7酶联免疫法检测细胞因子及抗体水平 于末次免疫7 d后取小鼠尾静脉血,分离血清用于检测抗体效价;用抗原包被液将蛋白ΔA146PLY稀释至5 μg/ml,加入96孔板,100 μl/孔,4℃过夜;洗板(洗液:0.05%PBST)3次,加入封闭液(2%BSA),200 μl/孔,37℃×2 h;洗板3次后加末次免疫7 d后所得血清,进行连续倍比稀释,100 μl/孔,最后一孔(100 μl,2%BSA)为阴性对照,37℃×1 h;洗板6次后加HRP标记的山羊抗小鼠二抗,100 μl/孔,37℃×45 min;洗板6次后分别加入A、B显色液各50 μl,37℃15 min;100 μl/孔、2 mol/L硫酸终止反应;450 nm测定吸光度值;以A空白×2.1为临界值,计算各小鼠的抗体效价滴度。IL-6、TNF-α的浓度均由ELISA MAXTMDeluxe SET mouse IL-6、TNF-α、试剂盒按其说明书进行检测,在450 nm处比色测定吸光度值,并依据标准曲线计算出相应细胞因子含量。
1.3统计学分析 数据的作图及统计学分析均使用软件Graphpad Prism(Prism 5;Graphpad Software,La Jolla,CA,USA)完成。抗体效价使用Mann-WhitneyU检验进行分析;细菌载量、细胞因子使用非配对t检验进行分析,P<0.05表示差异具有统计学意义。
2 结果
2.1蛋白的表达与纯化 通过肺炎链球菌溶血素PLY溶血活性的变化观察蛋白矿化后的稳定性,在表达ΔA146PLY的同时也表达其具野生型蛋白WT-PLY,以便于后续研究。以1 mol/L IPTG,20℃×120 r/min诱导表达蛋白WT-PLY和ΔA146PLY,Ni-NTA柱纯化并用去内毒素试剂盒去除蛋白的内毒素(LPS<0.1 EU/μg)后以10% SDS-PAGE分析所得蛋白,G-250染色后于53 kD处见目的条带,大小与相应蛋白相对分子量相符,灰度分析显示纯度均达90%以上(图1),可用于后续实验。

图1 蛋白WT-PLY和ΔA146PLY原核表达、纯化后SDS-PAGE分析Fig.1 Prokaryotic expressions of WT-PLY and ΔA146 PLY and SDS-PAGE analysis after purificationNote:A.Protein WT-PLY; B.Protein ΔA146PLY.M.DL 200 kD marker; 1.WT-PLY protein;2.Protein ΔA146PLY.

图2 矿化后蛋白纳米颗粒的表达效果及SDS-PAGE、BCA结果Fig.2 Expression of protein nanoparticles after mineralization and SDS-PAGE,BCA resultsNote:A.Comparison of WT-PLY mineralization effect (1.WT-PLY; 2.WT-PLY@CaP); B.WT-PLY@CaP SDS-PAGE analysis (M.Protein marker; 1.WT-PLY; 2.WT-PLY@CaP supernatant; 3.WT-PLY@CaP precipitation); C.WT-PLY@CaP BCA test result chart; D.Comparison of ΔA146PLY mineralization effect (1.ΔA146PLY; 2.ΔA146PLY @CaP); E.ΔA146PLY@CaP SDS-PAGE analysis (M.Protein marker; 1.ΔA146PLY;2.ΔA146PLY@CaP supernatant; 3.ΔA146PLY@CaP precipita-tion);F.ΔA146PLY@CaP BCA test results.
2.2蛋白的生物矿化及包封率分析 矿化结果显示:蛋白矿化后呈悬浊液,与蛋白溶液相比,呈现比较明显的半透明状(图2A、D)。分离矿化液上清和沉淀,进行SDS-PAGE,灰度分析结果显示WT-PLY@CaP上清中蛋白含量为51.3%,沉淀中为40.6%;ΔA146PLY@CaP蛋白含量为51.6%,沉淀中为44.7%(图2B、E)。将矿化悬浊液的上清液用BCA试剂盒检测, WT-PLY上清中含量为55.6%,ΔA146PLY含量为47.8%,即生物矿化之后的包封率分别为44.4%和52.2%(图2C、F)。
2.3矿化纳米颗粒的生物表征
2.3.1TEM 可溶性蛋白WT-PLY和ΔA146PLY是柔性分子,分子直径约20 nm,因其不能承受普通透射电子显微镜高速的电子束轰击,所以无法通过TEM观测其大小。但是经过原位矿化之后,矿化颗粒具有一定的厚度和体积,在电子束轰击下不会降解分离,可以在电镜下呈现出一定的大小和形态。通过TEM观察产物大小和形状(图3),发现磷酸钙-蛋白质的复合物呈现为单分散的近球形纳米颗粒,大小不一,直径约100 nm。


图3 WT-PLY@CaP和ΔA146PLY@CaP的TEM图


图4 WT-PLY@CaP和ΔA146PLY@CaP的FESEM图
2.3.2FESEM 通过FESEM观察产物表面形貌(图4),发现磷酸钙-蛋白质的复合物呈现为表面较光滑的近球形纳米颗粒,尽管大小不一,但是大多数直径100 nm左右,同TEM的结果相似。


图5 WT-PLY@CaP和ΔA146PLY@CaP的EDS图
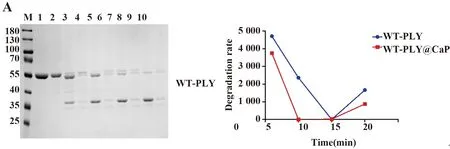
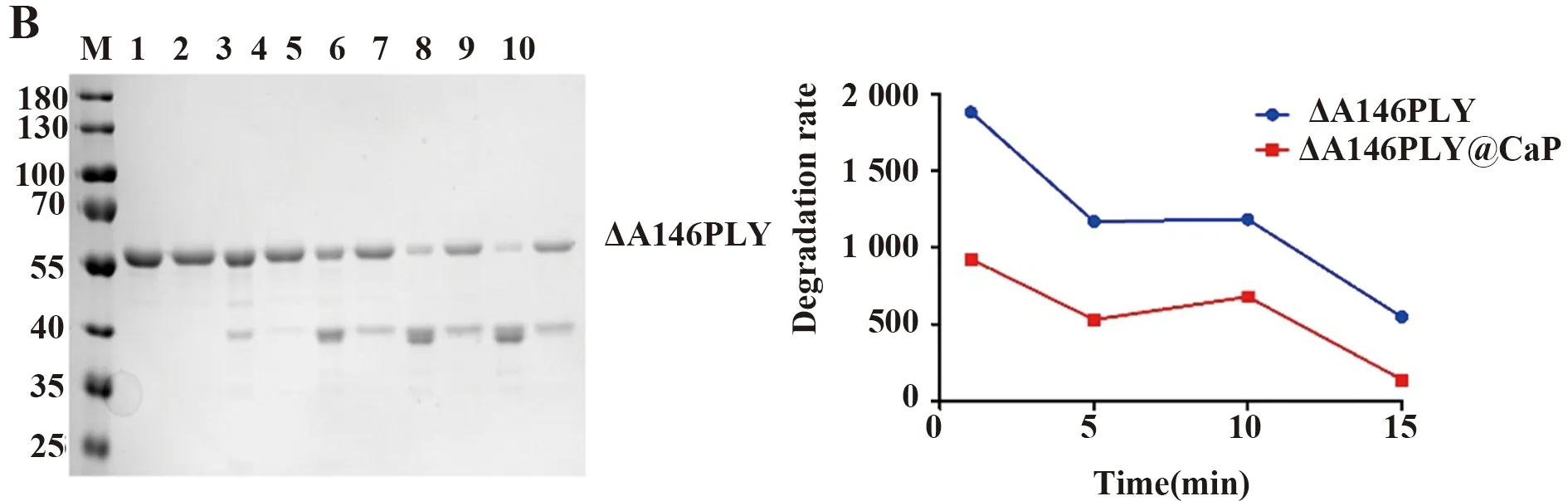
图6 蛋白WT-PLY、ΔA146PLY及其矿化颗粒蛋白酶K处理后SDS-PAGE结果分析
2.3.3EDS EDS分析结果(图5)表明蛋白磷酸钙纳米复合物中含有Ca、Mg、P等元素,其中WT-PLY@CaP Ca、Mg、P的含量分别为41.94%、15.86%、42.21%;ΔA146PLY @CaP Ca、Mg、P的含量分别为49.38%、7.69%、42.93%(钙磷比约为1∶1),这也进一步证明生物矿化确实将磷酸钙包裹于自身。
2.4蛋白与矿化颗粒的稳定性评估
2.4.1蛋白酶K降解实验 对蛋白WT-PLY和矿化颗粒WT-PLY@CaP蛋白酶K处理后,可以看出,随着时间的延长,蛋白基本降解,但是矿化颗粒仍然残留部分;同理,蛋白ΔA146PLY在15 min后几乎无残余,但是矿化颗粒相较于游离蛋白仍剩余较多(图6),而且降解速度上,无论WT-PLY@CaP还是ΔA146PLY@CaP,其抵抗蛋白酶作用的耐受性仍然高于游离蛋白WT-PLY以及ΔA146PLY。

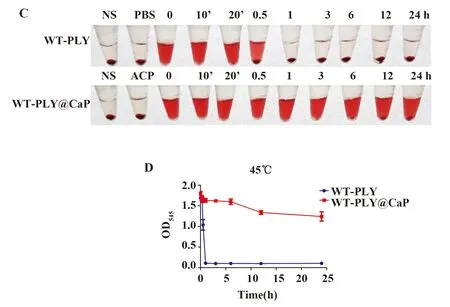
图7 热处理后WT-PLY和WT-PLY@CaP的溶血对比图
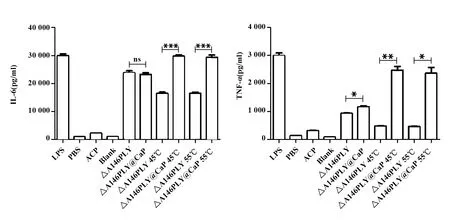
图8 不同温度处理ΔA146PLY和ΔA146PLY@CaP后刺激巨噬细胞分泌细胞因子IL-6和TNF-αFig.8 Treatment of cytokines IL-6 and TNF-α by macrophages after treatment with ΔA146PLY and ΔA146PLY@CaP at different temperaturesNote:*.P<0.05;**.P<0.01;***.P<0.001.

图9 矿化蛋白热处理后小鼠的免疫保护效应Fig.9 Immune protective effect of mice after heat treatment of mineralized proteinNote:A.Anti-ΔA146PLY IgG antibody titer of subcutaneous immunized mice after heat treatment of mineralized protein;B.Colony count of nasal lavage fluid after 72 h of nasal infection;C,D.Inflammation of the lung produces IL-6 and TNF-α levels after 72 h of nasal infection.Compared with the PBS group,*.P<0.05,**.P<0.01,***.P<0.001;compared with the ΔA146PLY group,★.P<0.05;compared with the ΔA146PLY inactivation treatment group,#.P<0.05,##.P<0.01.
2.4.2溶血实验 采用溶血实验进行蛋白的热稳定性评估,结果显示在55℃处理后,WT-PLY蛋白在3 min后完全失活,而WT-PLY@CaP在20 min之后仍保留部分溶血活性;45℃处理后,WT-PLY蛋白在0.5 h后完全失活,而WT-PLY@CaP在24 h后仍然保留有部分溶血活性。结果显示,生物矿化后的WT-PLY@CaP可以提高WT-PLY蛋白在较高温度下的热稳定性(图7)。
2.5矿化蛋白热处理后仍可有效激活巨噬细胞 采用疫苗蛋白对巨噬细胞的激活效应探索矿化蛋白对热的稳定性,结果显示:在较高温度处理后的蛋白基本失去刺激活性,但是进行生物矿化之后的ΔA146PLY@CaP仍然可以刺激巨噬细胞分泌较高的IL-6和TNF-α,具有明显的差异(图8),提示ΔA146PLY进行生物矿化之后可显著提高蛋白在较高温度下的热稳定性。
2.6矿化蛋白热处理后仍可诱导小鼠的免疫保护效应 采用免疫保护作用进行蛋白热稳定性评估,结果显示(图9A)热处理之后的ΔA146PLY@CaP(45℃和55℃)与未经处理组蛋白ΔA146PLY相比无差异,都具有较高的抗体效价,热处理后的ΔA146PLY抗体效价较未处理组显著降低,提示生物矿化之后的蛋白确实能抵抗较高的温度,且在处理后仍具有生物活性。
鼻腔灌洗液结果显示(图9B),热处理之后的ΔA146PLY@CaP(45℃和55℃)与未处理组蛋白ΔA146PLY的菌落计数无显著差异(P>0.05),都较PBS组和蛋白灭活处理组显著降低(P<0.01);热处理之后的ΔA146PLY@CaP(45℃和55℃)与未处理蛋白ΔA146PLY的IL-6和TNF-α水平差异无统计学意义,都较对照组(灭活蛋白组、ACP加蛋白组和PBS组)的水平显著降低。这些结果提示,热处理后的ΔA146PLY@CaP可以降低肺炎链球菌鼻咽部定植量,仍可以保持与原蛋白相当的免疫保护效应。
3 讨论
目前,提高蛋白质热稳定性的方法主要有以下几种:①非共价修饰,主要是通过物理方法提高蛋白质的稳定性,包括反相胶束法、冻融法和冻干法等[6,7];②化学修饰,主要是通过化学手段将其他分子共计连接到蛋白质分子上,以改变它们的生物分配行为和溶解行为,从而增强药物的物理、化学和生物稳定性,包括化学交联、聚合物修饰、小分子修饰等[8-12];③添加蛋白质稳定剂,最简单有效的添加剂是离子化合物的盐类,离子的结合能增加蛋白质的热稳定性,盐类通过与蛋白质非特异性结合,减缓蛋白质的变性;④蛋白质工程,通过化学、物理、分子生物学手段对基因进行修饰或合成新的基因,对现有蛋白质进行高度专一的改造,从而起到增强蛋白质稳定性的作用[13];⑤在液体状态,利用矿化技术直接在蛋白表面形成磷酸钙矿化外壳以提高蛋白质的稳定性。然而,方法①在冻融或冻干蛋白过程中易使蛋白分解失活;方法②③④一般需要复杂的处理过程且普适性低;方法④尚不能产生良好的保护效果,而且可能会改变蛋白质的性质,影响蛋白质的效果。方法⑤的策略是模拟自然现象给蛋白分子加上一层具有保护作用的矿化外壳。生物矿化在自然界中普遍存在,生物体通过生物矿化形成具有一定结构的有机-无机复合组分,为较脆弱的本体提供机械支持和保护,提高它们在不利环境中的稳定性[14]。该法相对简便易行,在病毒和细菌等活的生物体中都有良好的效果[15,16]。目前被用于矿化研究的物质有多种类型,包括磷酸钙、碳酸钙、二氧化硅等,其中磷酸钙为生物体内所熟知的骨骼、牙齿的主要成分,以磷酸钙作为药物材料具有优良的生物相容性和生物可降解性[17-22]。同时磷酸钙也可以作为佐剂来促进免疫抗原的作用效果,且不会像铝佐剂一样引起较大的局部组织刺激[23,24]。纳米级的蛋白磷酸钙制剂因具有可被免疫细胞摄取和递呈引发免疫反应等优势而具有广阔的应用前景[25]。因此,采用磷酸钙制备生物矿化壳是一种良好的选择。
在实验过程中,蛋白质的原位矿化是分别取360 μl WT-PLY蛋白和ΔA146PLY蛋白(1 mg/ml)与88 μl CaCl2(0.1 mol/L,pH=7.5)和Na2HPO4/NaH2PO4(0.1 mol/L,pH=7.5)以及ddH2O(pH=7.5)组成1 ml矿化体系,用搅拌子在4℃匀速搅拌4 h形成WT-PLY@CaP和ΔA146PLY@CaP矿化颗粒。因为前期实验发现矿化体系不稳定,所以在矿化反应体系中加入88 μl MgCl2(0.1 mol/L)作为矿物无定形相的稳定剂,抑制矿物发生相转变[26]。Mg2+可以通过掺杂于无定形磷酸钙颗粒内部或吸附于颗粒表面起到稳定矿物无定形态的作用[27]。
但是遗憾的是,虽然镁离子可以提高矿化体系的稳定性,但是矿化颗粒在37℃放置14 d后以及25℃放置60 d后并没有表现出更好的稳定性,其可能与本研究的体系尚不完全稳定有关。本研究发现放置多天后,矿化颗粒聚集沉淀,颗粒显著增大,且不能恢复成纳米状态。因此,拟采用添加稳定剂的方法来提高,之前尝试添加蔗糖、聚乙二醇(不同分子量、不同浓度)、PVP等,都没有显著提高矿化体系的稳定性。所以,本课题组拟再选择其他稳定剂或是将以上稳定剂的浓度更改之后再进一步研究。另外,也可能是蛋白自身的结合能力较弱,本课题组拟偶联矿化肽提高其磷酸钙的结合能力,或许能获得更稳定的矿化蛋白。
本研究通过较为简便的原位矿化技术进行生物矿化后,蛋白可以形成具有矿化外壳的纳米颗粒,该纳米颗粒具有一定的抗蛋白酶K降解能力和高温耐受性。△A146PLY疫苗蛋白形成的矿化纳米颗粒在45℃和55℃处理后仍保持与原蛋白一致的免疫活性。本研究也为稳定性蛋白质制剂的制备提供了有价值的实验依据和理论参考。

