28色流式对中轴型脊柱关节炎患者外周血中T细胞亚群差异的鉴定①
李 捷 赵志斌 王崧榕 卞振华 廉哲雄
(南方医科大学第三附属医院,广州 510000)
中轴型脊柱关节炎(axial spondyloarthritis,ax-SpA)是以骶髂关节和脊柱附着点炎症为主要症状,四肢大关节,椎间盘纤维环及其附近结缔组织纤维化和骨化,以及关节强直为病变特点的慢性自身免疫性疾病。某些微生物(如克雷伯杆菌)与易感者自身组织有共同抗原,可引起一系列异常免疫应答[1]。明确引起异常免疫应答的疾病特异性免疫细胞,及时给予早期干预,对抑制ax-SpA的发展有积极作用。多通道流式技术结合大数据分析法为发现新的致病性细胞小亚群提供了可能。本文通过高通量流式细胞术检测我院5例ax-SpA患者外周血样本,并对其出现的特异性T细胞小亚群进行分析。
1 材料与方法
1.1材料
1.1.1临床样本信息 5例符合国际脊柱关节炎评估协会(ASAS)评估标准的ax-SpA患者和5例健康志愿者来自南方医科大学第三附属医院风湿免疫科,参与者知情同意,每人抽取外周血2 ml用于后续实验。5例ax-SpA患者平均年龄(32.8±10.89)岁,男女比例为2∶3,血C-反应蛋白(CRP)平均水平为(3.47±1.19)mg/L,红细胞沉降率(ESR)为(31.00±17.46)mm/h,Bath AS疾病活动指数(BASDAI)、Bath AS测量指数(BASMI)、Bath AS功能指数(BASFI)分别为2.20±1.98、2.16±1.68、2.64±2.79;5例健康志愿者包括3例男性和2例女性,平均年龄(25.6±1.14)岁。
1.1.2主要试剂与仪器 28色流式抗体(表1)、BD FACSymphony流式细胞仪购自BD公司;Ficoll溶液购自STEMCELL Technologies公司。
1.2方法
1.2.1外周血PBMC细胞的分离 临床患者及健康对照者外周静脉穿刺取血2 ml保存于乙二胺四乙酸-K3(EDTA-K3)真空采血管,在管内加入缓冲液(PBS+1%BSA)稀释至4 ml,混匀。将4 ml Ficoll溶液加到15 ml离心管底部,血液稀释液缓慢加入Ficoll上层,密度梯度离心(500 g×20 min,升6降2),离心后吸管收集中间白膜层细胞,加入新的15 ml 离心管中,450 g离心5 min收集细胞。
1.2.2FACS检测细胞表面标志 收集细胞用1 ml PBS缓冲液(含1%BSA)重悬,混匀,吸取10 μl 细胞悬液,按照1∶1 的比例与台盼蓝混匀后显微镜下计数。收集细胞(1×106个/管),用30 μl小鼠血清稀释液(含10 μl小鼠血清和10 μl PBS缓冲液)重悬细胞封闭,4℃封闭15 min。加入30 μl含有特异性表面标记荧光抗体混合液,4℃避光标记20 min。 加满PBS缓冲液(含1%BSA)混匀,3 000 g离心2 min,收集细胞,并用300 μl PBS缓冲液(含1%BSA)重悬,上机检测。
1.2.3FlowJo结合R语言数据分析 首先使用FlowJo把需要进行降维分析的数据导出为带有校正通道的CSV表格,利用R脚本读取数据形成带有样品标识的混合矩阵,并进行降维前的数据预处理,包括去除空通道以及FSC、SSC等通道,对混合矩阵进行标准化和均一化处理。完成数据预处理后,利用seurat包进行后续分析,首先写入样品信息,可选择利用Harmony包以分组或批次为单位校正数据,利用FindVariableFeature函数寻找细胞间差异,再次对混合矩阵数据均一化处理后进行主成分(PCA)分析,选择主成分数量进行细胞间空间距离的计算以及聚类,最后进行TSNE以及UMAP降维。
FlowJo结合R语言进行流式数据降维,最大优势在于可以利用二维平面展示多维流式抗体数据,可以更加清晰直观地展示细胞群抗体表达情况及实验组和对照组同一抗体的表达差异。同时结合R语言去除批次效应,可将不同批次的流式数据整合到一起分析,极大地提升了流式数据的利用率以及所得结果的可靠性。
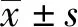
2 结果
2.128色流式细胞组合搭建 28色流式细胞技术应用于分析人类外周血中淋巴细胞表型。本研究根据已报道疾病相关蛋白表达情况及部分测序数据结果,结合现有T细胞相关免疫学知识建立了一套新的28色T细胞相关流式检测方案(表1、图1),不仅包括一系列T细胞亚群的分化标记物(CD45,CD3,CD4,CD8等),还包括3种TCR(TCR γδ,TCRγ7.2,TCR Vα24-Jα18)[2-5]。在功能方面,一系列趋化因子受体分子,如CXCR家族(CXCR3、CXCR5、CXCR6),CCR家族(CCR4、CCR6、CCR7),激活相关分子 (CD69、CD314、HLA-DR),耗竭相关分子(PD-1等)及细胞成熟与归巢受体分子(CD45RO,CD103)等也都涵盖在整个抗体组合中,抗体信息组合见表1[6]。

表1 28色流式抗体信息
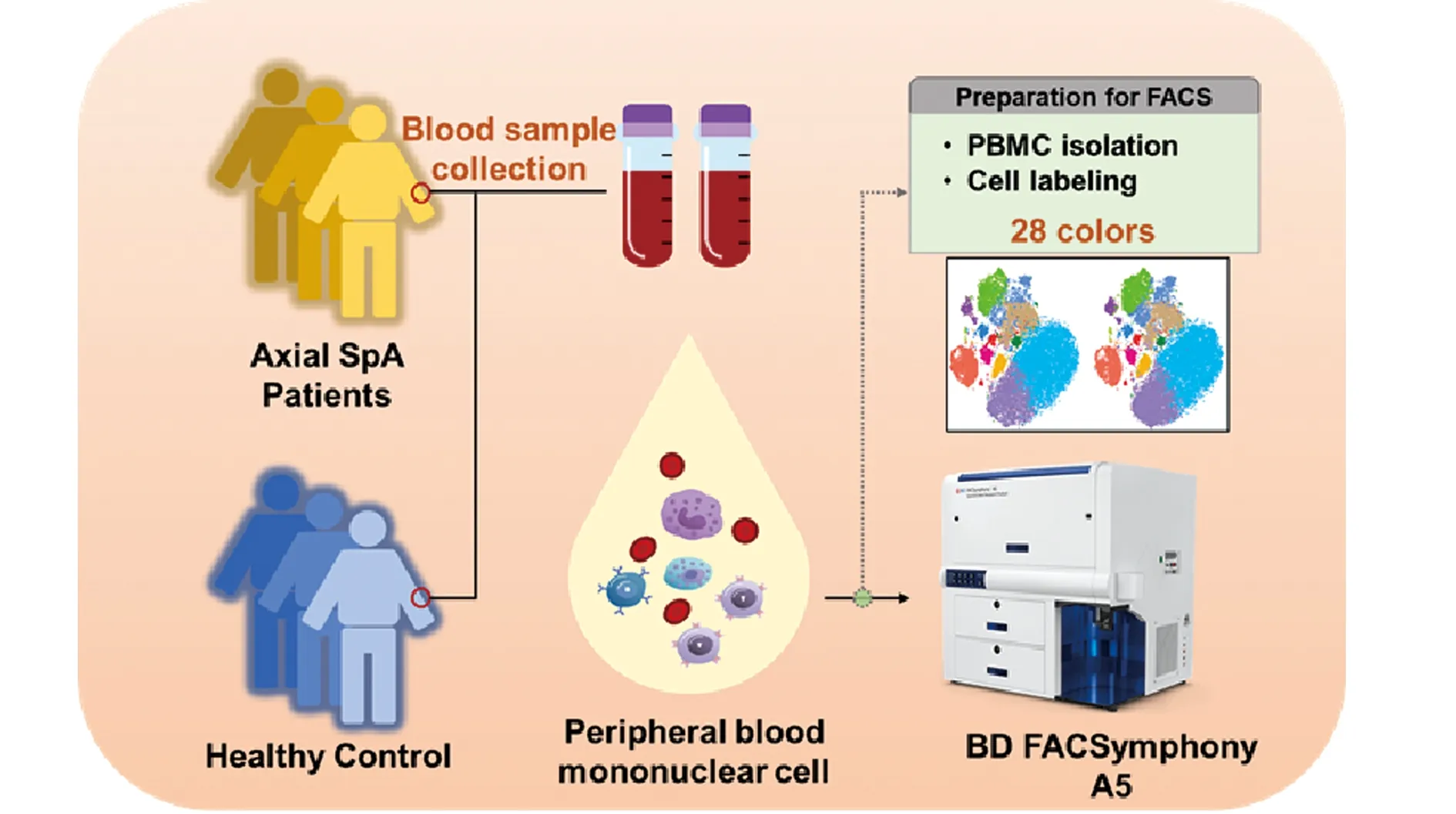
图1 利用FACSymphony分析外周血中免疫细胞亚群差异的流程Fig.1 Schematic overview for analysis of difference of immune cell subsets in peripheral blood by FACSymphony
2.2Ax-SpA患者与健康对照外周血中CD4+T细胞与CD8+T细胞差异分析 获得数据后,经过FlowJo结合R语音进行流式数据降维等一系列分析,并输出可视化结果。在外周血CD4+T细胞可根据细胞表面标记分为10个亚群,分别为:Cluster 0~9(图2A)。相比健康对照,10个细胞亚群的比例并没有发生明显变化(图2B)。
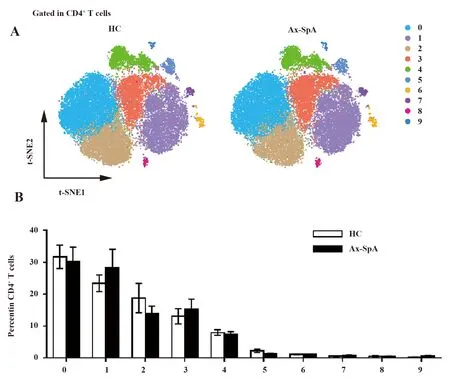
图2 CD4+ T细胞在ax-SpA患者与健康人外周血中亚群的比较Fig.2 Comparison of CD4+ T cell subsets in PBMCs between ax-SpA patients and healthy controlsNote:A.CD4+ T cell subsets are divided into 10 clusters (cluster 0-9) based on FACS marker expression level;B.Percentage of cluster 0-9 in ax-SpA patients and healthy controls.
同样的,对CD8+T细胞的进一步分析得到14个小亚群(图3A),对比健康对照,其中Cluster8在ax-SpA患者中比例明显升高(图3B)。
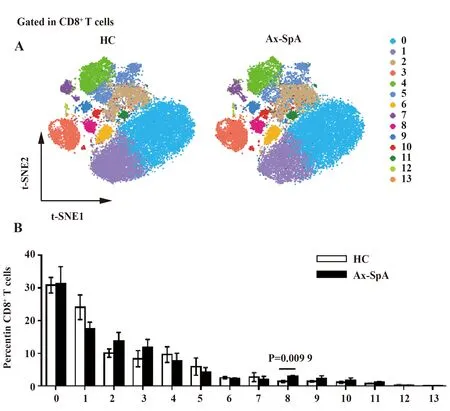
图3 CD8+ T细胞在ax-SpA患者与健康人外周血中亚群的比较Fig.3 Comparison of CD8+ T cell subsets in PBMCs between ax-SpA patients and healthy controlsNote:A.CD8+ T cell subsets are divided into 14 clusters (cluster 0~13) based on FACS marker expression level;B.Percentage of cluster 0~13 in ax-SpA patients and healthy controls.
2.3CD103+CD8+T细胞在ax-SpA患者外周血中比例升高 本研究对杀伤性CD8+T细胞亚群进行了进一步的分析,通过热图把每个细胞亚群的各标记蛋白的表达量进行了可视化展示(图4A),进一步在t-SNE降维图中展示跟T细胞驻留相关的分子标记CD69和CD103(图4B)。
Ax-SpA患者中明显增高的Cluster8 亚群中,结合其功能分子的表达进一步分析发现其主要为一群表达CD103的CD8+T细胞,即在ax-SpA患者中,CD103+CD8+T细胞比例明显增多。
进一步用传统流式分析方法验证了ax-SpA患者与健康对照细胞的比例(图4C)。可以发现在ax-SpA患者中,CD103+CD8+T比例明显上升(P<0.05)(图4D),这与通过R语言分析得到的结果一致。

图4 CD103+CD8+ T细胞在ax-SpA患者外周血中增多Fig.4 CD103+CD8+ T cells are increased in PBMCs of ax-SpA patientsNote:A.Heat map shows expression level of each protein marker;B.CD69 and CD103 expression level in merged CD8+ T cell;C.CD69 and CD103 expression on CD8+ T cell of each ax-SpA patients and healthy controls;D.Percentage of CD103+CD8+ T cells in CD8+ T cells.
3 讨论
Ax-SpA是一种慢性的,主要累及脊柱关节的自身免疫性疾病,其致病机制尚不清楚。有部分文献报道T细胞HLA-B27基因突变会诱导疾病发生并对治疗效果产生影响[7-9]。区别于传统对CD8+T细胞免疫学知识与理解的方法,本文利用R语言聚类分析算法,结合28色流式细胞术对于ax-SpA患者及健康对照外周血的T细胞亚群进行了较为细致的分析,CD4+T细胞的10个小亚群中没有明显变化,但在CD8+T的14个小亚群中,表达CD103的CD8+T细胞在ax-SpA患者中明显升高,并对其进行了传统流式分析方法的验证。
CD103(也称为Integrin,alpha E)是一种整合素蛋白,在T细胞归巢中起到重要作用,被认为是组织驻留免疫细胞的重要标志子[10]。CD103广泛表达于上皮内淋巴细胞(IEL) T细胞(αβT细胞和γδT细胞)和一些调节性T细胞亚群,部分肠道固有层也有T细胞表达[11,12]。有文献报道,在自身免疫性肠道疾病(IBD)中,肠黏膜中的T细胞高表达整合素E7(E 7 integrin),并与关节部位的损伤有密切的联系,提示归巢受体CD103也可能在肠道炎症相关的关节炎症中发挥作用[13]。在肿瘤免疫微环境中, CD103+CD39+CD8+T细胞在原发和转移性肿瘤中明显升高。研究表明,头颈癌患者CD103+CD39+CD8+T的比例越高,总体生存率也越高[14],提示CD103+CD8+T细胞在区域特异性微环境中发挥重要的作用。
在治疗方面,FDA已经批准那他珠单抗阻断整合素蛋白α4β1 (CD49d,CD29)治疗多发性硬化症,2016年已有临床个案报道利用那他珠单抗治疗AS并取得了一定效果。这也提示整合素蛋白家族在自身免疫性疾病的发生发展中起到了重要作用,在未来可能通过阻断CD103来实现对于疾病的干预。
随着流式细胞术技术的不断发展,流式细胞标记技术已经可以实现同时标记数十种细胞外标志物并在一次实验完成全部检测,这对于临床较少的样本量下获得更多的信息非常重要。2018年以来,文献陆续报道28色流式细胞技术应用于分析人类外周血中淋巴细胞的表型[15,16]。此研究通过搭建多通道(28色)流式细胞术检测平台,应用R语言,大数据可视化分析了ax-SpA患者外周血中T细胞两个大亚群CD4+T细胞、CD8+T细胞下的24个亚群比例及功能蛋白分子表达量,发现与健康对照相比,ax-SpA患者中的CD103+T细胞比例明显上升,这可能为未来临床工作中ax-SpA的诊断和治疗起到一定的启示。
致谢:感谢BD公司Total solution团队张新梅、钟娜、姚丹丹、石丹露在28色方案设计、方法学优化等方面提供的帮助。

