基于miR-155/SOCS1轴研究复方甘草酸苷治疗特应性皮炎小鼠的作用机制①
常 晶 姚战非 张 铎 王 琳
(内蒙古民族大学附属医院皮肤科,通辽 028000)
特应性皮炎(atopic dermatitis,AD)是以剧烈瘙痒、湿疹样皮损为主要特征的慢性复发性皮肤炎症,可引发口唇炎、全身皮肤干燥、手足炎等并发症[1]。近年来,AD全球发病率呈上升趋势,严重影响患者生活质量及身心健康[2]。目前治疗AD的常用药物为糖皮质激素,但长期使用不良反应较大[3]。复方甘草酸苷具有类皮质醇化学结构及活性,可作为激素替代药物发挥抗过敏、抗炎作用,用于AD治疗,但作用机制尚未明确[4-6]。miR-155是一种不编码蛋白的小分子RNA,可调节炎症反应,参与AD发生发展,在AD小鼠皮损部位及血清中表达显著高于正常小鼠[7,8]。SOCS1是一种对炎症因子通路有负向调节作用的蛋白,调节AD、银屑病等皮肤炎症性疾病,是治疗AD的靶点[9]。miR-155可抑制SOCS1表达,促进炎症发展,但目前复方甘草酸苷治疗AD的作用机制是否与miR-155、SOCS1有关尚未明确[10]。本文通过建立AD小鼠模型研究复方甘草酸苷治疗AD的作用抑制,为AD药物研发提供依据。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级BALB/c小鼠购自广东双林生物制药有限公司,雌雄各半,体质量20~25 g,许可证号:SCXK(粤)2018-0003。饲养于清洁、安静、通风良好环境,自然光照,自由饮水、摄食,22℃、相对湿度50%,定时更换垫料,清理、消毒鼠笼,暂养1周后进行实验。
1.1.2主要试剂 MC903购自北京绿源伯德生物科技有限公司(货号:R019162);复方甘草酸苷购自哈药集团三精制药股份有限公司(25 mg/粒);miR-155 agomir、miR-155 agomir阴性对照由上海吉玛制药技术有限公司合成;miR-155、U6、SOCS1、GAPDH引物由上海生工生物工程股份有限公司合成;HE染色试剂盒购自上海生工公司(货号:E607218-0200);小鼠IgE、TNF-α、IL-6 ELISA试剂盒、兔源GAPDH一抗、兔源SOCS1一抗、羊抗兔二抗均购自美国Abcam公司(货号分别为:ab157718、ab208348、ab100712、ab181602、ab62584、ab6721);RNAiso Plus、逆转录试剂盒、荧光定量PCR试剂盒均购自日本Takara公司(货号分别为:9108、RR037Q/A/B、639519);蛋白裂解液、BCA试剂盒均购自上海碧云天公司(货号分别为:P0013K、P0011)等。
1.1.3主要仪器 石蜡切片机购自德国Leica公司;RM2235实验室教学生物显微镜购自日本尼康公司;3900高通量DNA合成仪购自美国应用生物系统公司;荧光定量PCR仪、酶标仪、蛋白电泳仪、半干转膜仪均购自美国Bio-Rad公司;2500凝胶成像系统购自上海天能公司等。
1.2方法
1.2.1建模及分组给药 参照文献[11]:MC903溶于无水乙醇配制为2 nmol/L 的溶液,每天均匀涂布于小鼠两耳背部,各20 μl,持续10 d,当小鼠耳部皮肤出现红斑出血、结痂鳞屑、水肿、抓痕、糜烂时,提示造模成功。随机分为模型组、miR-155 agomir组、miR-155 agomir阴性对照组、复方甘草酸苷组、复方甘草酸苷+miR-155 agomir组,每组12只,另取12只小鼠两耳耳背涂布等体积无水乙醇作为对照组。复方甘草酸苷、miR-155 agomir、miR-155 agomir阴性对照均用生理盐水溶解,分别配制为9.1 mg/ml、20 μmol/L、20 μmol/L溶液备用。参照文献[12]进行剂量换算,复方甘草酸苷组小鼠灌胃给予复方甘草酸苷;参照说明书及文献[13],miR-155 agomir组、miR-155 agomir阴性对照组小鼠尾静脉注射miR-155 agomir、miR-155 agomir阴性对照5 ml/(kg·d);复方甘草酸苷+miR-155 agomir组小鼠在复方甘草酸苷组基础上尾静脉注射给予5 ml/(kg·d) miR-155 agomir;对照组和模型组小鼠每天灌胃、尾静脉注射等体积生理盐水,持续14 d。
1.2.2小鼠耳部皮损临床症状观测 末次给药24 h后,观察各组小鼠耳部皮损情况,根据红斑/出血、水肿/糜烂、剥脱/干燥3个症状的严重程度进行皮炎评分,最终得分为3个症状得分之和,最高为9分,评分标准如表1[14]。
1.2.3小鼠耳部组织病理学标本采集 末次给药24 h后,断头处死小鼠,腹主动脉取血约2 ml,3 000 r/min,4℃离心15 min,收集上清(血清)储存于-80℃备用。剪下小鼠耳部组织,一侧储存于-80℃备用,另一侧以4%多聚甲醛固定、梯度酒精(由低至高)脱水、二甲苯透明、石蜡包埋后,切片机切片,脱蜡、梯度酒精浸泡(由高到低),置于蒸馏水中,HE染色,漂洗、脱水、透明、封片后光学显微镜下观察小鼠耳部组织病理学情况。
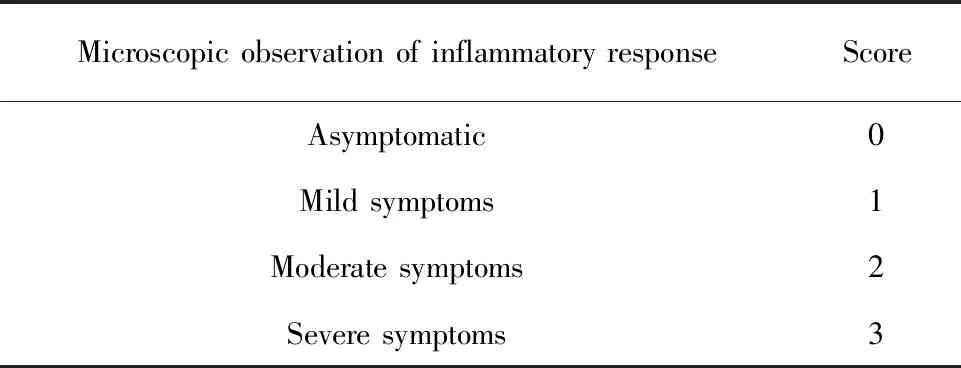
表1 Holfbauer病理评分标准[14]
1.2.4ELISA检测血清IgE、TNF-α,IL-6水平1.2.3中血清4℃解冻后,分别使用ELISA试剂盒测定血清IgE、TNF-α、IL-6水平,按照说明书操作。
1.2.5qRT-PCR检测耳部组织miR-155、SOCS1 mRNA水平 取1.2.3中冻存的耳部组织约0.5 g剪碎,参照RNAiso Plus说明书采用RNAiso Plus提取总RNA,逆转录为cDNA、荧光定量PCR试剂盒进行荧光定量PCR反应,miR-155以U6为内参,SOCS1以GADPH为内参,2-ΔΔCt法计算,引物序列见表2。
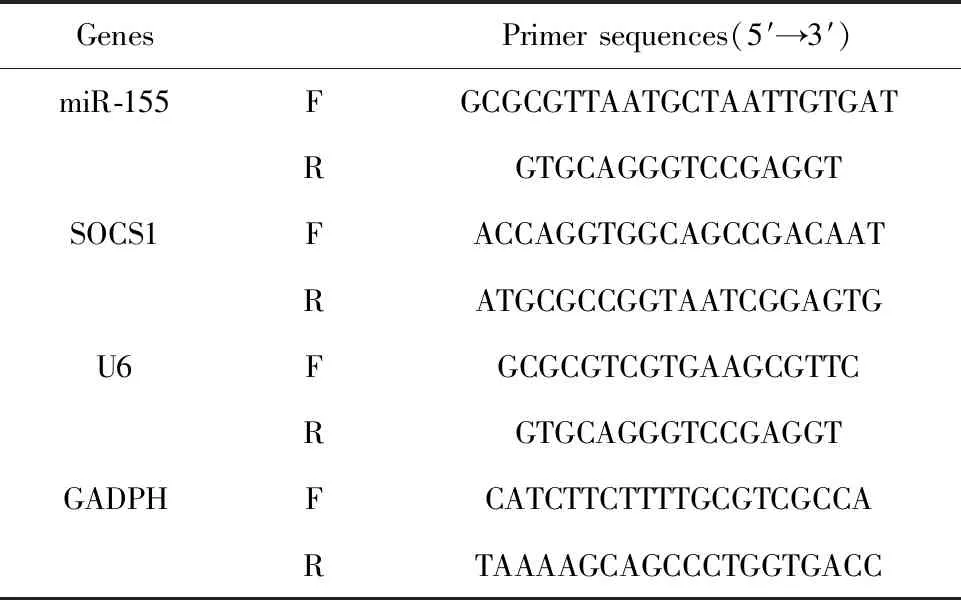
表2 qRT-PCR引物序列
1.2.6Western blot检测耳部组织miR-155、SOCS1蛋白表达 取1.2.3中冻存的耳部组织约0.5 g剪碎,加入蛋白裂解液(已加蛋白酶抑制剂),冰浴匀浆、离心后BCA试剂盒测定蛋白总浓度,煮沸变性,各组取20 μg总蛋白进行SDS-PAGE电泳,转移至蛋白硝酸纤维膜,根据蛋白分子量截取目的蛋白条带,置于5%脱脂奶粉,室温封闭2 h,SOCS1一抗4℃孵育过夜,羊抗兔二抗室温孵育 2 h,TBST漂洗,ECL显色,凝胶成像系统拍摄蛋白条带并以Tanon软件分析蛋白相对表达量。
2 结果
2.1各组小鼠耳部形态变化 对照组小鼠耳部无皮炎症状,皮炎评分为0分;模型组小鼠双侧耳背出现皮肤增厚、明显红斑、充血水肿、干燥鳞屑等皮炎症状,皮炎评分显著升高(P<0.05)。与模型组相比,miR-155 agomir组小鼠皮炎症状加重,皮炎评分升高(P<0.05);复方甘草酸苷组小鼠皮炎症状减轻,皮炎评分降低(P<0.05)。与miR-155 agomir组相比,复方甘草酸苷+miR-155 agomir组小鼠皮炎症状减轻,皮炎评分降低(P<0.05)。与复方甘草酸苷组相比,复方甘草酸苷+miR-155 agomir组小鼠皮炎症状加重,皮炎评分升高(P<0.05),见图1、表3。
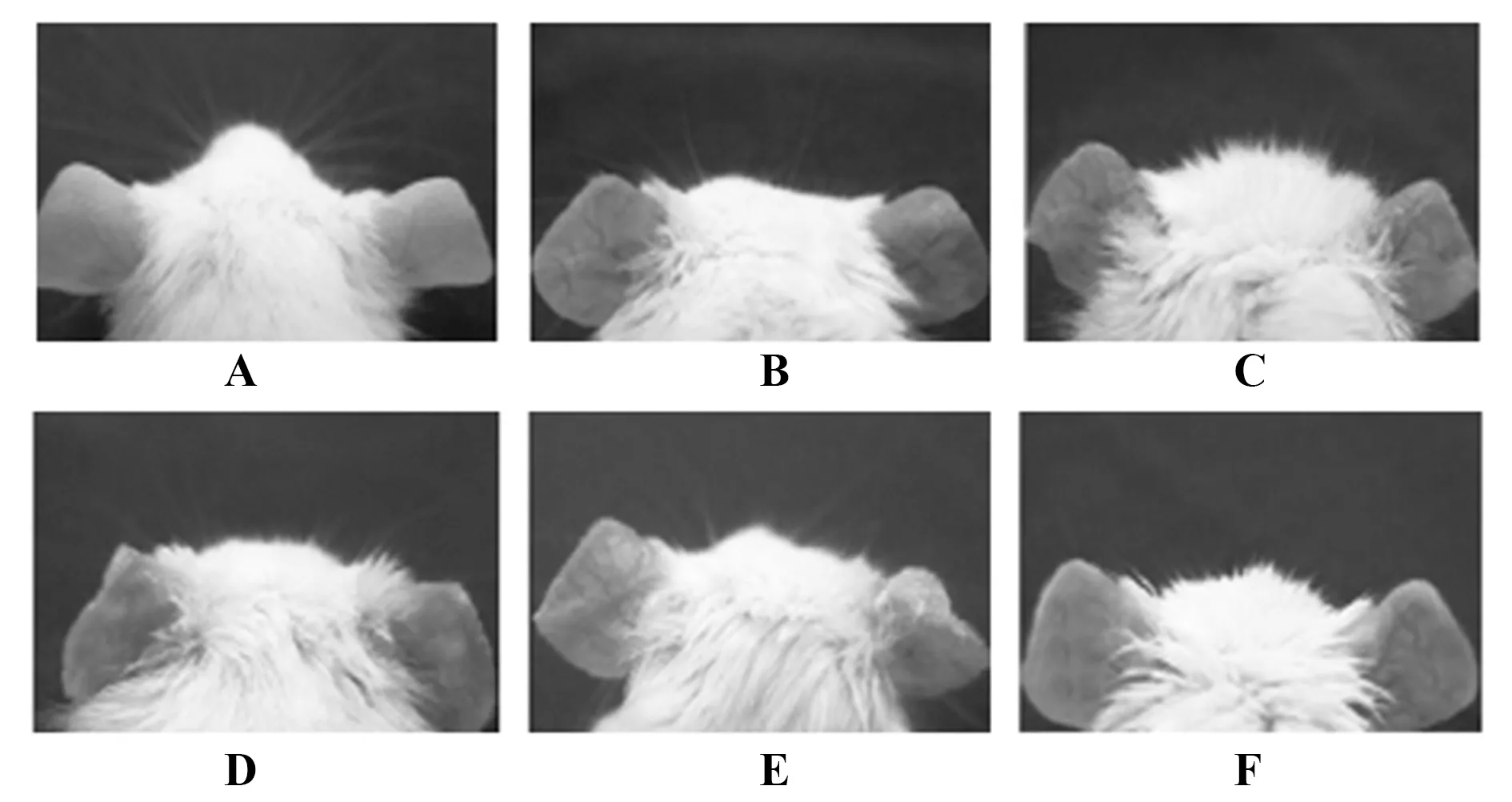
图1 小鼠耳部皮炎症状Fig.1 Dermatitis in mouse earsNote:A.Control group;B.Model group;C.miR-155 agomir group;D.miR-155 agomir negative control group;E.Compound glycyrrhizin group;F.Compound glycyrrhizin +miR-155 agomir group.

表3 各组小鼠耳部皮炎评分
2.2各组小鼠耳组织病理症状 对照组小鼠耳组织结构清晰、正常,无明显病理症状,模型组小鼠耳组织可见表皮层显著增生、棘细胞层变厚、毛细血管扩张、组织水肿充血、大量炎症细胞浸润等病理症状。与模型组相比,miR-155 agomir组小鼠上述病理症状加重;复方甘草酸苷组小鼠上述病理症状减轻。与miR-155 agomir组相比,复方甘草酸苷+miR-155 agomir组小鼠上述病理症状减轻。与复方甘草酸苷组相比,复方甘草酸苷+miR-155 agomir组小鼠上述病理症状加重,见图2。
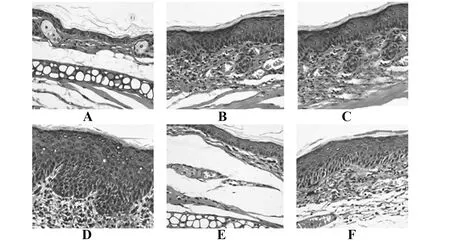
图2 各组小鼠耳组织病理症状比较(×200)Fig.2 Comparison of pathological symptoms of ear tissues of mice in each group(×200)Note:A.Control group;B.Model group;C.miR-155 agomir group;D.miR-155 agomir negative control group;E.Compound glycyrrhizin group;F.Compound glycyrrhizin +miR-155 agomir group.
2.3各组小鼠血清IgE、TNF-α、IL-6水平 与对照组相比,模型组小鼠血清中IgE、TNF-α、IL-6水平均升高(P<0.05)。与模型组相比,miR-155 agomir组小鼠血清IgE、TNF-α、IL-6水平升高(P<0.05);复方甘草酸苷组小鼠血清IgE、TNF-α、IL-6水平降低(P<0.05)。与miR-155 agomir组相比,复方甘草酸苷+miR-155 agomir组小鼠血清IgE、TNF-α、IL-6水平降低(P<0.05)。与复方甘草酸苷组相比,复方甘草酸苷+miR-155 agomir组小鼠血清IgE、TNF-α、IL-6水平升高(P<0.05),见表4。
表4 各组小鼠血清IgE、TNF-α、IL-6水平
2.4各组小鼠耳组织miR-155、SOCS1 mRNA水平比较 与对照组相比,模型组小鼠耳组织miR-155水平升高(P<0.05),SOCS1 mRNA水平降低(P<0.05)。与模型组相比,miR-155 agomir组小鼠耳组织miR-155水平升高(P<0.05),SOCS1 mRNA水平降低(P<0.05);复方甘草酸苷组小鼠耳组织miR-155水平降低(P<0.05),SOCS1 mRNA水平升高(P<0.05)。与miR-155 agomir组相比,复方甘草酸苷+miR-155 agomir组小鼠耳组织miR-155水平降低(P<0.05),SOCS1 mRNA水平升高(P<0.05)。与复方甘草酸苷组相比,复方甘草酸苷+miR-155 agomir组小鼠耳组织miR-155水平升高(P<0.05),SOCS1 mRNA水平降低(P<0.05),见表5。

表5 各组小鼠耳组织miR-155、SOCS1 mRNA相对表达
2.5各组小鼠耳组织SOCS1蛋白表达水平 与对照组相比,模型组小鼠耳组织SOCS1蛋白表达降低(P<0.05)。与模型组相比,miR-155 agomir组小鼠耳组织SOCS1蛋白表达降低(P<0.05);miR-155agomir阴性对照组小鼠表达差异无统计学意义(P>0.05);复方甘草酸苷组小鼠耳组织SOCS1蛋白表达升高(P<0.05)。与miR-155 agomir组相比,复方甘草酸苷+miR-155 agomir组小鼠耳组织SOCS1蛋白表达升高(P<0.05)。与复方甘草酸苷组相比,复方甘草酸苷+miR-155 agomir组小鼠耳组织SOCS1蛋白表达降低(P<0.05),见图3、表6。
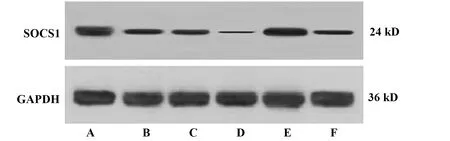
图3 Western blot检测各组小鼠耳组织中SOCS1蛋白表达水平Fig.3 Western blot was used to detect expression of SOCS1 protein in ear tissues of mice in each groupNote:A.Control group;B.Model group;C.miR-155 agomir group;D.miR-155 agomir negative control group;E.Compound glycyrrhizin group;F.Compound glycyrrhizin +miR-155 agomir group.

表6 各组小鼠耳组织SOCS1蛋白相对表达
3 讨论
AD是慢性、复发性、湿疹性皮肤炎症,治愈率较低,儿童发病率较高,患儿生长发育和身心健康。AD发病机制复杂,与遗传、免疫、环境等多种因素有关,是活化的Th2型淋巴细胞、嗜酸性粒细胞、肥大细胞相互作用引起的以炎症细胞浸润为主的皮肤炎症反应[15]。既往研究表明,MC903作为人工合成的维生素D3类似物,可促进小鼠T细胞活化,介导炎症,导致AD[16]。IgE是一种分泌型免疫球蛋白,可引起Ⅰ型超敏反应,TNF-α、IL-6为炎症反应的调节因子,AD患者血清IgE、TNF-α及IL-6水平明显升高,其表达水平与AD严重程度呈正相关[17]。本研究使用MC903涂布小鼠耳背部建立AD模型,结果显示模型组小鼠双侧耳背出现皮肤增厚、红斑、充血水肿、干燥鳞屑等皮炎症状,耳组织出现表皮层显著增生、棘细胞层变厚、毛细血管扩张、组织水肿充血、大量炎症细胞浸润等病理症状,耳部皮炎评分、血清IgE及TNF-α、IL-6水平、可组织miR-155水平显著升高,表明模型组小鼠血清中炎症相关因子明显升高,耳部发生严重炎症,出现AD典型症状,建模成功。
复方甘草酸苷可通过降低磷酯酶A2活性抑制炎症介质合成分泌,减轻炎症反应,可作为激素的替代药物,用于AD治疗,疗效较好,且更为安全,广泛应用于临床,但其作用机制尚不明确[18,19]。研究表明,miR-155/SOCS1可介导炎症反应,下调miR-155表达可促进SOCS1表达,抑制Ox-LDL诱导炎症反应[20]。AD患者血清中,miR-155表达显著升高,SOCS1 mRNA表达显著降低,且miR-155表达与AD严重程度呈正相关,与SOCS1 mRNA表达呈负相关,推测miR-155/SOCS1信号可能是复方甘草酸苷治疗AD的作用靶点[21]。本研究结果显示,复方甘草酸苷灌胃治疗后,小鼠AD症状减轻,且耳组织miR-155水平显著降低,SOCS1 mRNA及蛋白水平升高,尾静脉注射miR-155 agomir可上调miR-155表达,加重小鼠AD症状,SOCS1 mRNA及蛋白水平进一步降低,表明复方甘草酸苷可调控miR-155/SOCS1信号,且可能是治疗AD的作用机制。联合应用复方甘草酸苷及miR-155 agomir,小鼠耳部炎症、病理症状比单独使用miR-155 agomir减轻,比复方甘草酸苷组加重;血清IgE及TNF-α、IL-6水平、耳组织miR-155水平低于miR-155 agomir组,高于复方甘草酸苷组;耳组织SOCS1 mRNA及蛋白表达高于miR-155 agomir组,低于复方甘草酸苷组,表明上调miR-155表达可抑制复方甘草酸苷减轻炎症反应的作用,拮抗其对AD小鼠的治疗作用,提示调控miR-155/SOCS1轴是复方甘草酸苷治疗AD的作用机制之一。
综上所述,miR-155在AD小鼠中高表达,SOCS1在SD小鼠中低表达,复方甘草酸苷可通过抑制miR-155表达,促进SOCS1表达减轻AD小鼠炎症反应,改善临床症状。复方甘草酸苷治疗AD的作用机制之一可能是通过调控miR-155/SOCS1轴实现的。本文初步探讨了复方甘草酸苷治疗AD的作用机制,但具体调控步骤尚需进一步研究。

